布依药野苏麻的二萜类化学成分研究
2020-11-30李继新叶江海邹娟潘炉台张敬杰
李继新 叶江海 邹娟 潘炉台 张敬杰
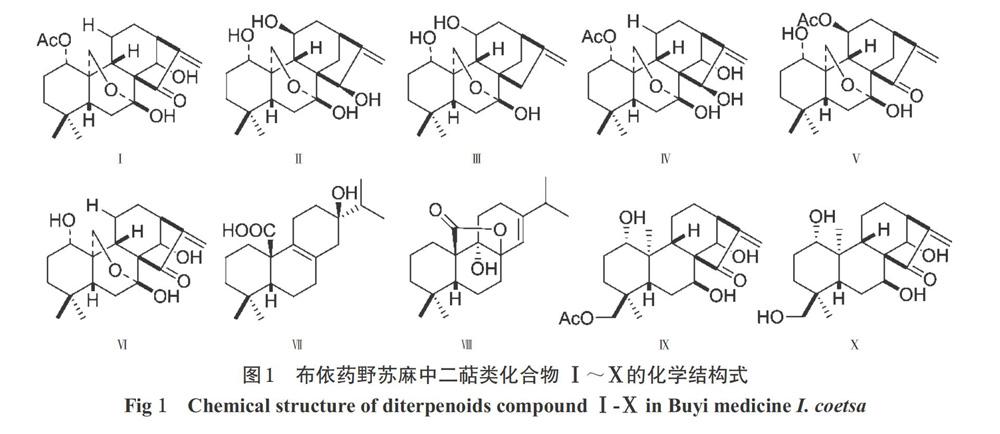
摘 要 目的:对布依药野苏麻的二萜类成分进行研究,为其资源开发利用提供参考。方法:采用硅胶柱、Sehadex LH-20凝胶柱、MCI柱等对野苏麻的95%甲醇提取物进行分离纯化,通过波谱分析(质谱、氢谱、碳谱)技术鉴定所得化合物的结构,并与民间混用苗药“喔嘎良”的活性成分进行比对。结果与结论:从野苏麻中分离鉴定出10个二萜类化合物,分别为细锥香茶菜乙素(化合物Ⅰ)、大锥香茶菜乙素(化合物Ⅱ)、细锥香茶菜甲素(化合物Ⅲ)、Enanderianin N(化合物Ⅳ)、细锥香茶菜丁素(化合物Ⅴ)、大锥香茶菜甲素(化合物Ⅵ)、线纹香茶菜酸(化合物Ⅶ)、Rubesanolide D(化合物Ⅷ)、Excisanin D(化合物Ⅸ)、Excisanin K(化合物Ⅹ),其中化合物Ⅶ、Ⅸ、Ⅹ均为首次从该植物中分离得到;化合物Ⅶ(线纹香茶菜酸)为布依药野苏麻与苗药“喔嘎良”中共同含有的活性成分。
关键词 布依药;野苏麻;二萜类;化学成分;鉴定
ABSTRACT OBJECTIVE: To study the chemical constituents of diterpenoids from Buyi medicine Isodon coetsa, and to provide reference for the development and utilization of the medicinal resources. METHODS: The 95% methanol extract of Buyi medicine I. coetsa were isolated and purified with silica gel column, Sehadex LH-20 gel column and MCI column. The structures of the compounds were obtained by spectral analysis (mass spectrum, hydrogen spectrum and carbon spectrum), and then compared with active components of Miao medicine “Isodon flavidus”. RESULTS & CONCLUSIONS: Ten diterpenoids were obtained from I. coetsa, including rabdocoetsin B(Ⅰ), megathgrin B(Ⅱ), rabdocoetsin A(Ⅲ), enanderianin N(Ⅳ), rabdocoetsin D(Ⅴ), megathyrin A(Ⅵ), lophanic acid(Ⅶ), rubesanolide D(Ⅷ), excisanin D(Ⅸ), excisanin K(Ⅹ). The compounds Ⅶ, Ⅸ and Ⅹ were isolated from this specie for the first time. Compound Ⅶ (lophanic acid) is a common active component in the Buyi medicine I. coetsa and Miao medicine “I. flavidus”.
KEYWORDS Buyi medicine; Isodon coetsa; Diterpenoids; Chemical constituents; Identification
布依药野苏麻为唇形科香茶菜属植物细锥香茶菜Isodon coetsa(Buch.-Ham. ex D. Don)Hara.的地上部分,原植物主要分布于我国贵州、广西、云南、四川等地區[1]。据《新华本草纲要》记载,野苏麻味苦辛,性微温,具有解表散寒、除风温的功效[2]。本课题组于2013年8月在黔东南地区进行苗族传统医药文化调研中发现了一种用于治疗脚癣病的苗药(苗语名:喔嘎良),来源于唇形科香茶菜属植物淡黄香茶菜Isodon flavidus(Hand.-Mazz.)Hara.,通过成分分析发现其中含量较高的二萜类成分线纹香茶菜酸(Lophanic acid),并首次明确该成分为喔嘎良治疗脚癣病的物质基础[3]。2017年10月,本课题组在随后的植物资源调查中发现,贵州开阳地区的布依族群众常将淡黄香茶菜与同属植物细锥香茶菜混用,两种植物均俗称为“野苏麻”,除了将其用于治疗脚癣外还用于治疗蚊虫叮咬和无名肿毒。本研究基于民族植物学调研结果和香茶菜属植物研究经验(该属植物中的贝壳杉烷型、松香烷型、海松烷型二萜类成分是其特征性成分及主要生物活性成分)[4],运用液质联用(LC-MS)技术导向分离野苏麻的特征性二萜类成分,借助核磁共振(NMR)和质谱(MS)等波谱技术对上述二萜类成分进行结构鉴定,并与前期对苗药喔嘎良的成分研究结果相比对,以期验证两种植物在布依族民间同作为“野苏麻”混用的物质基础,并为布依药野苏麻资源的开发利用提供科学依据。
1 材料
1.1 仪器
ECX-500 500MHz型超导NMR仪(日本JEOL公司);Thermo U3000型超高效液相色谱系统,配备二元泵、 自动进样器、 柱温箱、二极管阵列检测器(DAD)和在线分析软件等(美国Thermo Fisher Scientific公司);Bruker Compact 型四极杆-飞行时间MS仪(德国Bruker公司);1100型分析和半制备高效液相色谱仪(美国Agilent公司);R-215型旋转蒸发仪(瑞士Buchi公司);WFH-308B型三色紫外分析仪(上海精科实业有限公司);AE240型十万分之一电子天平(瑞士Metter Toledo公司);葡聚糖凝胶Sephadex LH-20填料(40~70 ?m,瑞士Pharmacia & Upjohn 公司);MCI填料(75~150 ?m,日本Mitsubishi Chemical公司)。
1.2 试剂
薄层色谱(GF254)制备用硅胶、柱层析色谱制备用硅胶(100~200、200~300目)均购自青岛海洋化工有限公司;氘代试剂(宁波旋光医药科技有限公司);其余试剂均为分析纯和工业用试剂(天津化学试剂有限公司);水为纯净水(杭州娃哈哈集团有限公司)。
1.3 药材
野苏麻药材于2018年9月采自贵阳市开阳县,经贵州中医药大学药学院赵俊华教授鉴定为唇形科香茶菜属植物细锥香茶菜I. coetsa(Buch.-Ham.ex D. Don)Hara.的地上部分。植物标本存放于贵州中医药大学贵州省苗医药重点实验室(凭证标本号:GY20150701)。
2 方法与结果
2.1 化合物提取分离
取自然干燥野苏麻药材8.5 kg,粉碎成粗粉(60~80目),加入8倍量(L/kg)95%甲醇冷浸提取,每次提取4 d,共提取4次;合并提取液,减压浓缩,得提取物467 g。将该提取物缓慢分散于1.3 L水中使成混悬液,加入3倍量乙酸乙酯萃取,共萃取3次。对水层和萃取层进行溶剂回收,分别得乙酸乙酯部位211 g、水部位238 g。通过超高效液相色谱-四极杆-飞行时间质谱(UHPLC-Q- TOF-MS2)技术[4]分析,结果显示二萜类成分主要富集于乙酸乙酯部位。
取乙酸乙酯部位与硅胶(100~200目)500 g拌样,采用硅胶柱(200~300目)层析,以二氯甲烷-乙酸乙酯(10 ∶ 1、8 ∶ 1、4 ∶ 1、6 ∶ 4、1 ∶ 1,V/V)梯度洗脱,经薄层色谱法(TLC)以GF254薄层板进行检测后合并,得Fr.A~F共6組流分。经UHPLC-Q-TOF-MS2技术分析显示,流分Fr.A(21.3 g)中主要为色素、脂肪酸和酚类等低极性成分(分子量小于200);流分Fr.F(37.4 g)中主要为三萜和苷类成分(分子量大于500),故未对这2组流分进行系统分离。取流分Fr.B(33.8 g),经硅胶柱层析,以石油醚-乙酸乙酯(10 ∶ 1→1 ∶ 1,V/V)梯度洗脱,经TLC检测后合并,用甲醇重结晶后,得化合物Ⅰ(893.2 g);将Fr.B余下部分合并入Fr.C(18.7 g),经MCI柱脱色后,采用硅胶柱层析,以石油醚-乙酸乙酯(10 ∶ 1→1 ∶ 1,V/V)反复梯度洗脱,用甲醇重结晶后,得化合物Ⅱ(126.3 mg)、Ⅲ(42.2 mg),经Sephadex LH-20柱层析,以甲醇洗脱并重结晶后,得化合物Ⅳ(86.7 mg)。取流分Fr.D(43.1 g),经硅胶柱层析,以石油醚-丙酮(10 ∶ 1→7 ∶ 3,V/V)梯度洗脱,经Sephadex LH-20柱层析,以甲醇洗脱并重结晶后,得化合物Ⅴ(35.9 mg)、Ⅵ(18.2 mg)。取流分Fr.E(18.1 g),经MCI柱层析,以甲醇-水(3 ∶ 7→9 ∶ 1,V/V)梯度洗脱后,经TLC检测后合并,得Fr.E.1~E.3共3个流分,其中Fr.E.2(7.4 g)用甲醇重结晶得化合物Ⅶ(1.4 g);剩余母液过滤后与Fr.E.1(6.3 g)合并,通过硅胶柱层析,以石油醚-丙酮(10 ∶ 1→7 ∶ 3,V/V)梯度洗脱,然后使用Sephadex LH-20柱层析,以甲醇洗脱,再用石油醚-乙酸乙酯(9 ∶ 1→8 ∶ 2,V/V)梯度洗脱,用甲醇重结晶得化合物Ⅷ(28.8 mg);剩余部分与Fr.E.3(4.8 g)合并,经硅胶柱层析,以二氯甲烷-乙酸乙酯(20 ∶ 1→4 ∶ 1,V/V)梯度洗脱,经Sephadex LH-20柱层析,以甲醇洗脱,再经半制备高效液相色谱分离(75%甲醇洗脱)、甲醇重结晶后,得化合物Ⅸ(7.8 mg)、Ⅹ(10.6 mg)。
2.2 化合物的结构鉴定
化合物Ⅰ:白色块晶(甲醇)。EI-MS:m/z 391[M+H]+,分子式:C22H30O6。1H-NMR(400 MHz,CDCl3)δ:6.27、5.44(each 1H,brs,H2-17),5.28(1H,brs,H-14α),4.78(1H,dd,J=10.8、5.0 Hz,H-1β),4.57、4.47(each 1H,d,J=9.9 Hz,H2-20),1.98(3H,s,OAc),1.12、0.83(each 3H,s,Me-18,19)。13C-NMR(100 MHz,CDCl3)δ:76.0(C-1),25.2(C-2),37.9(C-3),33.7(C-4),48.6(C-5),30.5(C-6),97.9(C-7),58.8(C-8),52.7(C-9),39.3(C-10),18.2(C-11),32.1(C-12),42.5(C-13),73.3(C-14),203.0(C-15),151.2(C-16),118.7(C-17),31.5(C-18),21.7(C-19),63.9(C-20),170.2、20.4(OAc)。以上数据与文献报道[4]基本一致,故鉴定化合物Ⅰ为细锥香茶菜乙素(Rabdocoetsin B)。
化合物Ⅱ:无色块状晶体(甲醇)。EI-MS:m/z 351[M+H]+,分子式:C20H30O5。1H-NMR(400 MHz,CD3OD)δ:5.05、4.99(each 1H,brs,H2-17),4.24(1H,q,H-11),4.21、4.14(each 1H,dd,J=9.8、5.7 Hz,H-20),3.68(1H,dd,J=11.1、5.9 Hz,H-1β),1.07(3H,s,Me-19),0.81(3H,s,Me-18)。13C-NMR(100 MHz,CD3OD)δ:75.0(C-1),28.4(C-2),40.2(C-3),33.9(C-4),48.6(C-5),34.9(C-6),97.3(C-7),54.2(C-8),51.0(C-9),41.8(C-10),64.1(C-11),42.7(C-12),37.2(C-13),26.5(C-14),75.7(C-15),163.1(C-16),107.8(C-17),32.2(C-18),21.6(C-19),65.1(C-20)。以上数据与文献报道[5]基本一致,故鉴定化合物Ⅱ为大锥香茶菜乙素(Megathgrin B)。
化合物Ⅷ:无色晶体(甲醇)。EI-MS:m/z 319[M+H]+,分子式:C20H30O3。1H-NMR(500 MHz,CDCl3)δ:5.28(1H,brs,H-14),1.04(3H,d,J=6.8 Hz,H-16),1.03(3H,d,J=6.8 Hz,H-17),0.92(3H,s,H-18),0.91(3H,s,H-19)。13C-NMR(125 MHz,CDCl3)δ:24.7(C-1),18.1(C-2),41.2(C-3),33.4(C-4),41.4(C-5),19.8(C-6),28.8(C-7),81.1(C-8),75.1(C-9),51.8(C-10),26.6(C-11),22.2(C-12),150.7(C-13),117.7(C-14),34.7(C-15),20.2(C-16),20.7(C-17),32.1(C-18),20.0(C-19),178.8(C-20)。以上数据与文献报道[11]基本一致,故鉴定化合物Ⅷ为Rubesanolide D。
化合物Ⅸ:白色片状晶体。EI-MS:m/z 393[M+H]+,分子式:C22H32O6。1H-NMR(CD3OD,600 Hz)δ:6.09(1H,d,J=1.4 Hz,H-17α),5.41(1H,d,J=1.2 Hz,1H,H-17β),4.93(d,J=1.5 Hz,H-14),3.34(1H,p,J=1.6 Hz,H-13),1.55(1H,s,H-OAc),1.24(3H,s,H-20),1.04(3H,s,Me-19)。13C-NMR(100 MHz,CD3OD)δ:81.3(C-1),30.0(C-2),35.0(C-3),37.9(C-4),48.0(C-5),29.9(C-6),75.6(C-7),62.8(C-8),57.4(C-9),46.2(C-10),20.8(C-11),32.5(C-12),53.5(C-13),76.7(C-14),209.3(C-15),150.1(C-16),117.2(C-17),67.9(C-18),20.6(C-19),15.4(C-20),173.0、27.7(OAc)。以上數据与文献报道[12]基本一致,故鉴定化合物Ⅸ为Excisanin D。
化合物Ⅹ:白色片状晶体(甲醇)。EI-MS:m/z 373[M+Na]+,分子式:C20H30O5。1H-NMR(CD3OD,600 Hz)δ:6.09(1H,s,H-17),5.40(1H,s,H-17),4.92(1H,s,H-7),3.76~3.63(1H,m,H-18),3.44(1H,d,J=11.1 Hz,H-1),3.32~3.26(1H,m,H-18),2.19~2.00(2H,m,H-2,6),1.91~1.67(2H,m,H-11),1.22(3H,d,J=1.9 Hz,H-20),1.04~1.00(3H,m,Me-19)。13C-NMR(100 MHz,CD3OD)δ:81.6(C-1),30.0(C-2),34.5(C-3),39.5(C-4),48.0(C-5),29.9(C-6),75.8(C-7),62.9(C-8),57.5(C-9),46.3(C-10),27.6(C-11),32.5(C-12),53.5(C-13),76.8(C-14),209.5(C-15),150.2(C-16),117.2(C-17),65.1(C-18),20.7(C-19),15.5(C-20)。以上数据与文献报道[13]基本一致,故鉴定化合物Ⅹ为Excisanin K。
3 讨论
本研究从野苏麻药材中分离鉴定了10个二萜类成分,其中包括8个对映-贝壳杉烷型二萜类化合物,即细锥香茶菜乙素(化合物Ⅰ)、大锥香茶菜乙素(化合物Ⅱ)、细锥香茶菜甲素(化合物Ⅲ)、Enanderianin N(化合物Ⅳ)、细锥香茶菜丁素(化合物Ⅴ)、大锥香茶菜甲素(化合物Ⅵ)、Excisanin D(化合物Ⅸ)、Excisanin K(化合物Ⅹ),其中化合物Ⅸ、Ⅹ为首次从该植物中分离得到的7,20-环氧对映-贝壳杉烷型二萜生源前体。此外,首次从该植物中分离得到松香烷二萜成分线纹香茶菜酸(化合物Ⅶ),该化合物对脚癣致病菌——红色毛廯菌(Trichophyton rubrum)的最小抑菌浓度为62.5 ?g/mL[3]。本研究通过化学成分研究证实了布依药野苏麻与苗药喔嘎良均含有相同的抗菌成分——线纹香茶菜酸,初步验证了其与苗药喔嘎良在贵州民间被混用的物质基础,为进一步研究开发野苏麻民族药资源提供了依据。
参考文献
[ 1 ] 中国科学院北京植物研究所.中国高等植物图鉴:第3册[M].北京:科学出版社,1974:700-701.
[ 2 ] 吴征镒.新华本草纲要[M].上海:上海科学技术出版社,1988:458-459.
[ 3 ] LI JX,LI QJ,GUAN YF, et al. Discovery of antifungal constituents from the Miao medicinal plant Isodon flavidus[J]. J Ethnopharmacol,2016,191(6):372-378.
[ 4 ] 杨雅欣,叶江海,邓锐,等.野苏麻中5个特征二萜成分裂解规律研究[J].中草药,2017,48(17):3493-3496.
[ 5 ] QIN SX,SUN HD,LOBKOVSKY E,et al. Megathyrin B:a cytotoxic diterpene from Isodon megathyrsus[J]. Planta Medica,1998,64(8):728-731.
[ 6 ] XU YL,KUBO I. Direpenoid constituents from Rabdosia aoersa[J]. Phytochemisity,1993,34(2):576-578.
[ 7 ] WEI X,ZHI N,LI SH,et al. Cytotoxic diterpenoids from Isodon enanderianus[J]. Planta Medica,2003,69(9):1031-1035.
[ 8 ] 陈一平,孙汉董,林中文.细锥香茶菜二萜的研究[J].植物学报,1990,32(4):293-296.
[ 9 ] SUN HD,LIN ZW,NIU FD,et al. Cytotoxic diterpenoids from Isodon megathyrsus[J]. J Nat Prod,1994,57(10):1424-1429.
[10] 王兆全,许风鸣,董华章.线纹香茶菜酸的化学结构[J].天然产物研究与开发,1995,7(4):24-29.
[11] ZOU J,PAN LT,LI QJ,et al. Rubesanolides C-E:abietane diterpenoids isolated from Isodon rubescens and evaluation of their anti-biofilm activity[J]. Org Biomol Chem,2012,10(26):5039-5044.
[12] WANG Y,CHEN Y,KIM D,et al. Two diterpenes from Isodon excis[J]. Phytochemistry,1997,45(5):1015-1017.
[13] DING L,LIU GA,YANG DJ,et al. Cytotoxic ent-kaurane diterpenoids from Isodon weisiensis C. Y. Wu[J]. Pharma- zie,2005,60(6):458-460.
(收稿日期:2020-03-19 修回日期:2020-09-09)
(编辑:段思怡)
