内脏脂肪组织沉默信息调节因子1在高脂诱导西藏小型猪胰岛素抵抗中的表达研究*
2020-11-30戎亦骊潘永明黄俊杰朱科燕陈民利
戎亦骊,潘永明,黄俊杰,郁 晨,朱科燕,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
近几十年来,儿童和青少年中超重和肥胖的患病率呈逐年上升趋势。流行病学调查显示,儿童期或青少年期肥胖增加是成年人2型糖尿病、心血管疾病、高血压、哮喘等疾病发展的重要危险因素[1]。可见,当前肥胖的流行是重要的社会公共卫生问题之一。近来发现,体内脂肪分布和受损的脂肪组织功能可用于预测个体出现胰岛素抵抗(insulin resistance, IR)和相关并发症[2],故体内脂肪分布可能比机体的全身肥胖更为重要。内脏脂肪已成为代谢功能障碍的独立预测因子,内脏脂肪组织中巨噬细胞过量产生的促炎性细胞因子被认为是肥胖相关的脂肪组织炎症的关键,并导致IR的发生[3]。
沉默信息调节因子1(sirtuin1, Sirt1)是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶,参与多种基因转录、调节细胞周期等过程,与肝脏中的脂肪酸氧化、下丘脑的营养物质利用以及代谢综合征的保护有关[4]。Sirt1在白色脂肪组织中表达,并通过影响过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)的转录活性来调节脂肪形成,在Sirt1过表达或敲除的3T3-L1细胞中,脂肪形成分别减弱或增强[5]。最近发现,人体Sirt1基因在脂肪组织中高表达可以防止老化导致的胰岛素敏感性下降。此外,脂肪Sirt1基因敲除的小鼠在高脂环境下表现出严重的葡萄糖耐受以及胰岛素抵抗症状,提示脂肪组织Sirt1是维持机体能量平衡及胰岛素敏感性的关键基因[6]。本课题组前期研究发现,西藏小型猪高脂诱导后产生明显的肥胖、IR以及心血管代谢的紊乱[7],这些改变是否与内脏脂肪组织中Sirt1的调控变化有关,进而促进高脂诱导的西藏小型猪肥胖和IR的发生?为此,本文选取青年期的西藏小型猪,采用高脂饮食16周以诱导肥胖模型,观察Sirt1途径在内脏脂肪组织中的表达调控情况,探讨Sirt1与西藏小型猪肥胖和IR的联系,为研究青少年肥胖及其并发症的发生机制奠定基础。
1 材料与方法
1.1 实验用动物
自南方医科大学实验动物中心【SCXK(粤)2011-0015】选购普通级4~5月龄雄性西藏小型猪12只,体重10~14 kg左右,并饲养于浙江中医药大学动物实验研究中心普通级实验室【SYXK(浙)2013-0184】,环境温度控制在(22±1)℃,相对湿度控制在45%~65%。每天两次饲喂全价营养饲料并给予饮水自由,光照为12 h/12 h明暗交替。试验期间,所有小型猪遵照3R原则给予人道主义关怀,福利伦理审查号:ZLL-2016-128。
1.2 主要仪器和试剂
总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)试剂盒(上海申能德赛诊断技术有限公司);RNA提取试剂盒(RNAiso Plus)、荧光定量试剂盒(SYBR Premix Ex TaqTMII)购自日本TaKaRa公司;总蛋白提取及含量测定试剂盒(凯基生物有限公司);NanoDrop2000(美国Thermo公司)、DNA Engine仪(美国Bio-Rad 公司)、Steponeplus实时荧光定量PCR仪(美国ABI公司)、CLx红外荧光扫描成像系统(美国Odyssey公司)、7020全自动生化分析仪及ASP 200S 封闭式组织自动脱水机、RM2245 型石蜡切片机(日本日立公司)、ThermoVarioskan Flash连续光谱酶标仪(芬兰Thermo Fisher 公司;Nanozoomer S210全自动病理扫描切片仪(日本滨松光子公司)。
1.3 造模方法
12只西藏小型猪适应性饲养4周后,随机分成两组,即正常对照组(normal control group, NC)和高脂模型组(high fat/cholesterol diet group,HFC),每组6只。高脂饲料配方为73.5%基础饲料、1.5%胆固醇、10%蛋黄粉及15%油脂。造模方法参考潘永明[6]等文献,造模16周后安乐死各组动物,取样进行检测。
1.4 表型特征与生化指标测定
经过16周造模处理后,所有小型猪禁食12 h 后进行称重并测量体长(体长测量方法为两耳中间至尾根部的长度),用以计算身体质量指数,即体重(kg)/体长(m2);安乐死后采集内脏脂肪组织并称重,计算内脏脂肪率,即内脏脂肪重量(kg)/体重(kg)×100%;每只动物采集抗凝血3 ml,分离血浆并测定TC、LDL-C及HDL-C含量,计算动脉粥样硬化指数AI=(TC-HDL-C)/HDL-C。
1.5 糖耐量试验
造模16周时对小型猪进行糖耐量试验。具体方法如下,经3 d的吊床适应训练后,用2%~3%异氟烷诱导吸入麻醉,在右耳皮下静脉建立静脉通路;为减少麻醉的影响,于恢复3 h后开始试验;向耳缘静脉内注射0.5 g/kg的葡萄糖注射液,分别在给糖前(0 min)、给糖后5 min、15 min、30 min、60 min、90 min、120 min时从静脉通路内取血,测量血糖变化;同时测量胰岛素水平,计算血糖和胰岛素曲线AUC面积。
1.6 RT-PCR法检测内脏脂肪组织中Sirt1及下游相关因子mRNA表达水平
取脂肪组织于液氮中磨碎,利用Trizol法提取组织中的总RNA,于Nanodrop上测定RNA浓度,利用逆转录法获得cDNA,-20℃保存待用。利用RT-PCR方法检测沉默信息调节因子1(Sirtuin1, Sirt1)、胰岛素样生长因子-1(insulin-like growth factor 1, IGF-1)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)、过氧化物酶体增殖活化受体γ辅助活化因子1α(peroxisome proliferator-activated receptorγcoactivator-1α, PGC-1α)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、叉头框蛋白O1(forkhead box protein O1,FoxO1)、脂肪分解相关基因激素敏感性脂肪酶(hormone-sensitive lipase, HSL)及脂肪合成相关基因脂肪酸合成酶(fatty acid synthase, FASN)的表达量。
RT-PCR反应步骤:采用20 μl的反应体系:SYBR 染料10 μl,Forward 和Reverse 引物工作液(10 mmol/L)各1 μl,ROX 染料0.4 μl,cDNA 模板1 μl,无酶水6.6 μl。每个样品2个平行。反应条件:95℃预变性30 s,95℃ 5 s、60℃ 34 s 共40个循环;熔解曲线反应条件:60℃升温至95℃,60℃ 1 min、95℃ 15 s,自动采集荧光。

Tab. 1 Primer sequences of polymerase chain reaction
1.7 HE病理组织学观察
取脂肪组织用10%甲醛固定,然后脱水透明、浸蜡包埋、切片(厚度为5 μm)、贴片,最后HE染色封片。用Image pro plus 6.0 软件测量脂肪细胞直径,每张切片随机选择100个脂肪细胞,统计分析脂肪直径大小的分布率和计算平均脂肪直径大小。
1.8 统计学处理
2 结果
2.1 高脂饮食对西藏小型猪表型特征及血脂水平的影响
由表2可知,高脂组与正常对照组比较,体重和BMI指数显著升高(P<0.01),且内脏脂肪率显著增加(P<0.01);另外,高脂组的血浆TC、LDL-C、HDL-C以及AI指数均显著高于正常对照组(P<0.01)。

Tab. 2 Phenotypic characteristics of Tibetan mini-pigs induced by high-fat/cholesterol n=6)
2.2 高脂饮食对西藏小型猪血糖及胰岛素水平的影响
由表4,5可知,HFC组给糖后时间-血糖浓度反应曲线下面积显著高于NC组(P<0.05),且在给葡萄糖后5 min和15 min时差异显著(P<0.05,P< 0.01);同时胰岛素水平时间-浓度反应曲线下面积显著高于NC组(P<0.05),并在给葡萄糖后5 min的时间点差异显著(P<0.05)。

Tab. 3 Blood lipid levels of Tibetan mini-pigs induced by high-fat/cholesterol n=6)

Tab. 4 Glucose response to intravenous glucose tolerance test(IVGTT)in Tibetan mini-pigs induced by high-fat/cholesterol diet
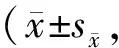
Tab. 5 Insulin response to IVGTT in Tibetan mini-pigs induced by high-fat/cholesterol diet n=6)
2.3 高脂饮食对西藏小型猪脂肪组织病理学变化的影响
HE染色结果显示,与NC组比较,高脂饮食16周后西藏小型猪内脏脂肪明显肥大(图1);定量分析显示,高脂模型组西藏小型猪平均脂肪细胞直径为(82.14±6.71)μm,正常对照组平均脂肪细胞直径为(44.47±0.73)μm,差异有显著性(P<0.01)。

Fig. 1 HE staining of fat tissues in Tibetan mini-pigs induced by high-fat/cholesterol diet
2.4 高脂饮食对西藏小型猪脂肪组织Sirt1及下游相关基因mRNA表达水平的影响
与正常对照组相比,高脂饮食诱导16周后西藏小型猪脂肪组织中Sirt1、PGC-1α、GLUT4 的mRNA水平均有不同程度的降低,其中Sirt1 mRNA表达显著降低(P<0.05),FOXO1和IGF-1的mRNA表达则显著升高(P<0.05,P<0.01);另外,脂肪组织中HSL的mRNA表达水平显著降低(P<0.05),同时PPAR-γ和FASN的mRNA表达水平则显著升高(P<0.05,P<0.01,表6)。
3 讨论
儿童或青少年时期肥胖的增加与心脏代谢危险因素和疾病密切相关,是成年后早期高发病率的预测因素[8]。其中饮食因素,如过量食用饱和脂肪、胆固醇及简单的碳水化合物会影响糖尿病、心脏代谢疾病的发展[9]。相比常规饮食,高脂饮食诱导16周后西藏小型猪的体重、BMI指数和内脏脂肪率显著增加,提示高脂饮食致西藏小型猪肥胖模型成立。同时,本研究发现高脂诱导后西藏小型猪内脏脂肪细胞直径明显增加;糖耐量实验结果显示,高脂组静脉注射葡萄糖后时间-血糖浓度曲线和时间-胰岛素浓度曲线变化均明显延迟且曲线下面积均显著高于常规饮食组,说明在西藏小型猪肥胖模型中还存在胰岛素抵抗。
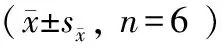
Tab. 6 Relative gene expressions of Sirt1,FOXO1,PGC-1α,GLUT4,IGF-1,PPAR-γ, HSL, FASN in fat tissue in Tibetan mini-pigs induced by high-fat/cholesterol diet
近年来研究发现,Sirt1是各种组织中的关键代谢传感器,可响应不同的环境刺激,直接将细胞代谢状态与染色质结构和基因表达调节联系起来,从而调节能量代谢和应激反应等过程[10]。Sirt1还可以通过控制肝脏中的葡萄糖和脂质代谢,促进脂肪动员并刺激白色脂肪组织中白色脂肪的棕色重塑,控制胰腺中胰岛素的分泌,进而影响肥胖导致的疾病[11]。Sirt1可以负性调控白色脂肪细胞中的PPARγ,从而抑制脂肪酸合成并促进脂肪动员[5]。在本研究中,高脂诱导后西藏小型猪Sirt1的mRNA表达水平显著下调,而PPARγ的mRNA表达水平显著升高,提示高脂饮食导致脂肪组织中Sirt1失活影响内脏脂肪的生成与分解。另外,高脂饮食后西藏小型猪脂肪组织中激素敏感脂肪酶(HSL)基因表达显著降低而脂肪酸合成酶(FASN)表达则明显升高。HSL是脂肪组织脂解中的限速酶,高脂饮食可导致大鼠脂肪组织HSL表达降低[12];而FASN则是体内脂肪酸从头合成过程中的关键酶,在高脂喂养致大鼠脂肪肝模型中发现FASN表达显著增加[13]。可见,HSL表达降低以及FASN表达增加,可能是高脂饮食促进西藏小型猪内脏脂肪沉积从而诱发肥胖的关键过程;提示Sirt1/PPARγ途径参与肥胖西藏小型猪的内脏脂肪沉积。
IR是肥胖的病理基础,高胰岛素血症会引起食欲增加,从而过量进食使得血糖升高,过多的能量则转变成脂肪组织储存起来,最终导致肥胖的出现[14]。胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)具有胰岛素样作用,其通过与IGF-1受体特异性结合,促进细胞生长、发育,并参与肥胖、2型糖尿病等代谢性疾病的发生发展过程[15]。其中,胰岛素(INS)/IGF-1通路是参与代谢的重要调控通路;IR或继发的高胰岛素血症可能通过IGF-1的高表达,导致细胞增殖、凋亡异常。本研究结果显示,高脂诱导后肥胖西藏小型猪的脂肪组织中IGF-1的mRNA表达水平明显升高,提示内脏脂肪细胞肥大增生可能与此有关。另外,叉头框蛋白O1(Foxo1)是FOXO转录因子家族的成员,近来认为FOXO1在肥胖和IR间起着重要的桥梁作用,是INS/IGF-1通路的效应分子[16]。Sirt1可以通过去乙酰化作用影响FOXO介导的下游分子,FOXO1异常激活可引起胰岛素敏感性降低。脂肪组织中GLUT4的表达降低可导致明显的IR[17],且脂肪组织中Sirt1耗尽能抑制胰岛素刺激的葡萄糖摄取和GLUT4转运。本研究发现肥胖小型猪脂肪组织中FOXO1的 mRNA表达水平较NC组显著增加,而GLUT4 mRNA表达则相对减少,这与临床肥胖患者网膜脂肪组织中的表达一致[18]。PGC-1α是一种代谢共激活因子,参与脂肪酸氧化反应,而Sirt1能通过去乙酰化作用提高PGC-1α的转录活性[19],本研究发现高脂诱导后西藏小型猪脂肪组织中PGC-1α表达下调,提示Sirt1可能通过下调PGC-1α表达水平影响机体的脂肪酸氧化过程。以上这些结果提示Sirt1/PGC-1α/FOXO1途径可能参与肥胖有关的脂肪细胞功能紊乱,并影响脂肪组织中的胰岛素信号传导及其敏感性。
综上所述,西藏小型猪经高脂饮食诱导后能形成肥胖模型,并具有脂质代谢紊乱和胰岛素抵抗等表型特征;而Sirt1在肥胖西藏小型猪内脏脂肪沉积和胰岛素敏感性降低中起着关键作用,提高Sirt1的表达水平可能对缓解不良饮食习惯导致的肥胖和IR发生有一定的作用。
