有氧运动对糖尿病大鼠PPARα信号通路的影响及其与PPARγ关系*
2020-11-30王天源王晓慧
王天源,王晓慧
(上海体育学院运动科学学院,上海 200438)
糖脂代谢紊乱如高血糖、高血脂和胰岛素抵抗(insulin resistance, IR)在肥胖及肥胖相关疾病如2型糖尿病的发生、发展中具有重要作用。有氧运动能改善紊乱的糖脂代谢,是预防和治疗糖尿病的有效方式之一,但运动改善糖尿病糖脂代谢紊乱的机制,目前仍未完全阐明。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor, PPAR)是脂类代谢的主要调节因子,有三个成员,PPARα,PPARγ和PPAR/σ[1]。PPARα是游离脂肪酸受体,在脂肪酸β氧化、能量代谢等过程中发挥关键作用,是目前糖尿病治疗的研究热点之一。据报道PPARα通过调节肝脏中脂肪酸的摄取和代谢,降低极低密度脂蛋白(very low-density lipoprotein, VLDL)与甘油三酯(triglycerides, TG)产生,并调节血管内TG的水解和高密度脂蛋白(high-density lipoprotein HDL)的产生,从而实现降血脂的作用[2]。PPARα发挥作用需被其上游信号分子腺苷酸活化蛋白激酶(adenosine monophosphate(AMP)-activated protein kinase, AMPK)激活[3];而PPARα最主要的下游靶分子是肉碱棕榈酰转移酶-1(carnitine palmitoyl transferase 1, CPT1)。研究已证实,一些激活AMPK-PPARα-CPT1通路的药物能改善肥胖及肥胖相关疾病的脂代谢[4]。运动也可通过上调该通路来改善肥胖及肥胖相关疾病的脂代谢,但也有完全相反的研究报道,认为运动对该通路的下调才能改善脂代谢[5]。因此,运动对AMPK-PPARα-CPT1通路的调控及意义尚未完全阐明。PPARγ也是肥胖、糖尿病等疾病治疗的主要靶分子之一,在调控糖脂代谢和胰岛素敏感性等方面也起重要作用[6]。多不饱和脂肪酸是PPARγ的天然配体,它们激活PPARγ后能增加葡萄糖摄取和胰岛素敏感性,从而在调控糖脂代谢中起关键作用。运动增加PPAR水平,且PPAR的增加与糖脂代谢改善有关[7]。
目前PPARα与PPARγ单独信号通路在肥胖及肥胖相关疾病中作用的研究较多,但它们之间是否存在相互作用仍不清楚;而运动状态下两者的作用是否有关联,目前仍鲜有报道。因此,本研究首先证实PPARα信号通路在有氧运动改善糖尿病大鼠血糖血脂和脂肪肝中的作用,然后利用PPARγ的抑制剂和激动剂来研究PPARα的作用是否依赖PPARγ,以及PPARγ对PPARα是否有调控作用,这将为有氧运动改善糖尿病患者血糖血脂水平提供新的理论依据
1 材料与方法
1.1 大鼠建模、分组和训练方案
6周龄健康雄性Sprague-Dawley(SD)大鼠48只(200±10)g,购于北京维通利华实验动物有限公司(合格证号:SCXK(京)2016-0006),饲养于上海体育学院SPF级动物实验室,自由饮食、饮水,室温控制在20~24℃,空气相对湿度为40%~55%,明暗周期为12 h∶12 h。随机选取8只大鼠喂以普通饲料作为安静对照组(Con),其余大鼠采用高脂饮食联合链脲佐菌素(streptozotocin, STZ)建立糖尿病(DM)模型大鼠。具体方法:高脂高糖饲料喂养8周后,一次性空腹腹腔注射小剂量(30 mg/kg)的STZ,在注射后第3日和第7日检测大鼠空腹血糖(fasting blood glucose, FBG),两次均高于11.1 mmol/L则为建模成功。
将建模成功的DM大鼠随机分为4组:DM组、DM运动组(TDM)、TDM+PPARγ激动剂吡格列酮组(TDP)、TDM+PPARγ抑制剂GW9662组(TDG),每组8只。所有运动组大鼠先进行3 d跑台适应性训练,之后进行递增负荷的4周中等强度有氧训练,每周6 d,每天1次。第1、2周跑速为15 m/min,训练时间从30 min增加至60 min;第3、4周跑速为20 m/min,训练时间从60 min增加至90 min。每次训练前30 min,TDP和TDG组大鼠分别灌胃补充吡格列酮(10 mg/kg体重)和GW9662(1 mg/kg体重)。运动干预期间所有大鼠使用普通饲料喂食。本研究得到上海体育学院动物福利伦理委员会的批准(批准号:2016004)。
1.2 血液和组织样本采集
在最终运动训练结束后36 h,大鼠禁食12 h,10%水合氯醛麻醉大鼠,下腔静脉取血,收集血清。采血后处死大鼠,采集肝和腓肠肌(糖尿病大鼠无肾周脂肪,故未收集),保存于-80℃冰箱。
1.3 空腹血糖血脂检测
4周运动前、后,大鼠在禁食12 h 后尾静脉取血,用血糖仪检测空腹血糖(fasting blood glucose, FBG)水平。全自动生化分析仪检测血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL)水平,试剂盒购于南京建成生物工程研究所。
1.4 Western blot检测肝脏和骨骼肌PPARα等蛋白表达水平
取适量肝或腓肠肌,加入适量体积的蛋白酶裂解液,机械匀浆后超声裂解组织,离心(4℃,12 000 r/min,30 min)后取上清,BCA法检测蛋白浓度。取50 μg待测样品进行聚丙烯酰胺凝胶电泳,电泳后转膜。转好的PVDF膜用5%脱脂奶粉4℃封闭过夜,然后加入靶蛋白(PPARα、AMPK或CPT1)和内参(β-actin和GAPDH)的一抗,4℃封闭过夜,TBST洗3次后加入相应的二抗,常温孵育1 h,TBST洗3次后加入发光液,用Tanon 5200 Multi全自动化学发光/荧光图像分析系统(上海天能科技有限公司)曝光目的条带,ImageJ分析软件测定各目的蛋白和内参条带的灰度值,以目的蛋白/内参的灰度值比值表示蛋白表达相对水平。
1.5 统计学处理
2 结果
2.1 有氧运动对DM大鼠的空腹血糖血脂水平的影响
如表1所示,运动干预前,除HDL外,DM大鼠的FBG、TC、TG和LDL水平均比对照组均显著升高(P均<0.01);而4周训练后,TDM与DM组相比,FBG和TG(P<0.05)以及TC和LDL均显著降低(P均<0.01)。
2.2 有氧运动对DM大鼠肝和骨骼肌AMPK-PPARα-CPT1的蛋白表达水平的影响
如图1所示,大鼠肝(A)和腓肠肌(B)的PPARα蛋白表达水平,DM组比Con组显著降低(P<0.05),而TDM组比DM组显著提高(P<0.05)。
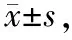
Tab. 1 Blood glucose and blood lipid in DM rats were improved by 4-week aerobic exercise(mmol/L, n=8)
Fig. 1 Effects of 4-week aerobic training on the protein levels of PPARα in the liver(A)and gastrocnemius(B)of DM rats
类似地,大鼠肝(图2A)和腓肠肌(图2B)的AMPK蛋白表达水平,DM组比Con组显著降低(P<0.05或P<0.01),而TDM组比DM组显著提高(P<0.01)。

Fig. 2 Effects of 4-week aerobic training on the protein levels of AMPK in the liver(A)and gastrocnemius(B)of DM rats
此外,如图3所示,4周训练显著增加DM组大鼠肝(A)和腓肠肌(B)的CPT1蛋白水平(P< 0.01),尽管DM组大鼠只有肝CPT1水平比Con组显著降低(P<0.05)、而腓肠肌的无显著改变。

Fig. 3 Effects of 4-week aerobic training on the protein levels of CPT1 in the liver(A)and gastrocnemius(B)of DM rats
2.3 有氧运动对DM大鼠PPARα的上调作用是否与PPARγ有关?
2.3.1 PPARγ激动剂与抑制剂对运动DM大鼠PPARα蛋白表达水平的影响 如图4所示,与TDM组相比,TDP组大鼠(外源补充PPARγ激动剂吡格列酮)的肝(A)和腓肠肌(B)PPARα蛋白水平显著提高(P<0.01),但外源补充PPARγ抑制剂GW9662的TDG组大鼠与TDM组相比,PPARα蛋白水平无显著差异(P>0.05)。

Fig. 4 Effects of PPARγ agonist and antagonist on PPARα protein expression in the liver and gastrocnemius of trained DM rats
2.3.2 PPARγ激动剂与抑制剂对运动DM大鼠CPT1蛋白表达水平的影响 CPT1的结果与PPARα的类似。即与TDM组相比,TDP组大鼠肝(图5A)和腓肠肌(图5B)的CPT1蛋白水平显著提高(P<0.01),而与TDM组比较,TDG组的CPT1蛋白表达水平无显著差异(P>0.05)。

Fig. 5 Effects of PPARγ agonist and antagonist on CPT1 protein expression in the liver and gastrocnemius of trained DM rats
2.3.3 PPARγ激动剂与抑制剂对运动DM大鼠AMPK蛋白表达水平的影响 如图6所示,与TDM组相比,TDP组大鼠肝(A)和腓肠肌(B)的AMPK蛋白水平显著提高(P<0.01),与TDM组比较,TDG组的肝AMPK蛋白水平无显著差异(P>0.05)、腓肠肌AMPK的蛋白水平显著降低(P<0.05)。
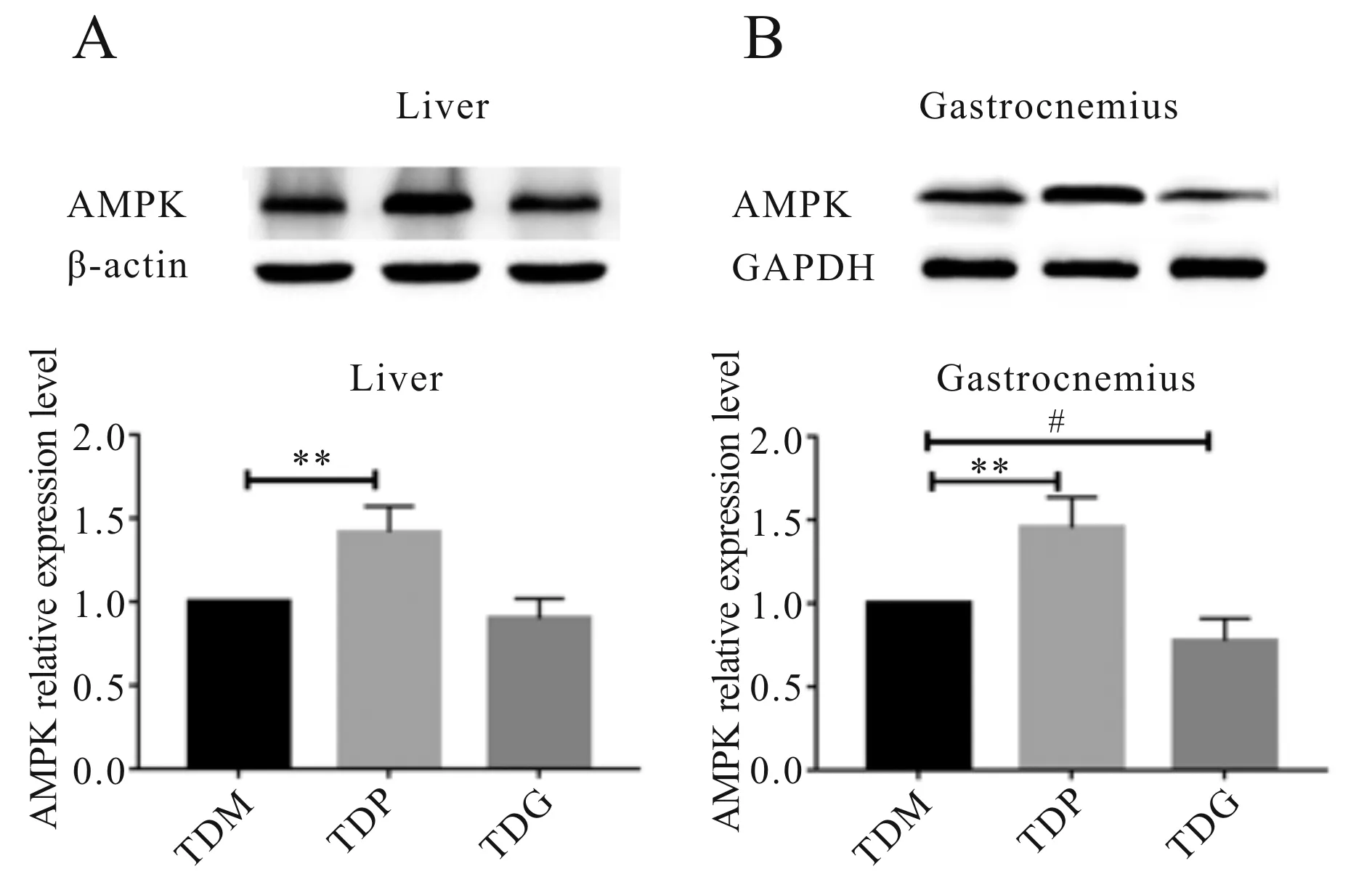
Fig. 6 Effects of PPARγ agonist and antagonist on AMPK protein expression in the liver and gastrocnemius of trained DM rats
3 讨论
作为脂质感受器以及脂肪酸氧化驱动器,PPARα参与脂肪酸氧化、脂质代谢和炎症调节。PPARα激活导致脂肪氧化、并减少脂肪储存。反之,PPARα减少导致脂肪酸氧化减少、脂肪增多,在肥胖及肥胖相关疾病的发生、发展中发挥重要作用。例如,肝PPARα表达降低可引起肝脂肪变性和脂肪性肝炎的发生[8];PPARα缺陷小鼠存在严重的肝脏脂肪积累和心脏脂肪化[9]。也因此,PPARα合成激动剂贝特类被用作肥胖及肥胖相关疾病降血脂的治疗药物。除了最为熟知的降血脂作用外,近年来发现PPARα还能调控胰岛素敏感性。例如,PPARα敲除小鼠不仅有高血脂、脂肪肝,还出现胰岛素抵抗;脂肪组织特异性PPARα过表达小鼠,其胰岛素敏感性提高[10]。PPARα要发挥作用离不开其上游信号分子AMPK的激活,以及它最重要下游分子CPT1来实现功能。AMPK是能量感受器,在脂质代谢和胰岛素敏感性上起关键作用[3],CPT1是转运长链脂酰辅酶A进入线粒体的脂肪酸氧化限速酶,对脂肪酸摄取和氧化具有重要调节作用。
有氧运动是减轻肥胖、改善糖脂代谢紊乱、防治肥胖相关疾病的有效方法和主要方式,其机制与运动对PPARα的调控有关。例如,跑步、游泳等有氧运动可通过上调肝或心肌PPARα的蛋白表达来改善糖尿病、代谢综合征和动脉粥样硬化大鼠的脂代谢。然而,也有相反的报道,认为有氧运动是通过降低肝或心肌PPARα蛋白水平来改善肥胖和糖尿病大鼠的脂代谢。分析相反结果的原因,可能是PPARα蛋白水平在后者的肥胖和糖尿病大鼠中是增加的缘故。运动能提高大鼠股四头肌与肝脏AMPK活性[11],运动也能激活野生型小鼠的PPARα及CPT1,且运动对野生型小鼠PPARα的激活作用依赖于AMPK的激活[12]。本研究发现,糖尿病模型大鼠的PPARα和AMPK、CPT1的蛋白水平均降低;而4周有氧运动在改善糖尿病大鼠血糖血脂[13]的同时,增加肝和腓肠肌PPARα和AMPK、CPT1的蛋白水平,提示外周代谢器官(如肝和骨骼肌)AMPK-PPARα-CPT1通路的激活是有氧运动改善DM大鼠血糖血脂的机制之一。类似的研究结果在本课题组的其他研究中也被证实,即运动改善肥胖和动脉粥样硬化大鼠血糖血脂的作用与运动增加肝、骨骼肌和脂肪AMPK、PPARα和CPT1蛋白水平有关[14]。PPARα主要在富含线粒体和脂肪酸分解代谢率高的器官或组织(如肝脏,心脏和骨骼肌)中表达[15]。本研究证实有氧运动不仅增加糖尿病大鼠肝PPARα蛋白水平,还增加腓肠肌的PPARα蛋白水平;而运动增加糖尿病大鼠腓肠肌PPARα蛋白水平,目前尚未见相关报道。
PPARγ主要表达于肝和白色脂肪组织[16],PPARγ最熟知的是调控糖代谢的重要作用,包括增加葡萄糖摄取、抑制糖异生和提高胰岛素敏感性等[17]。近年的研究发现PPARγ对脂代谢也起关键作用,如PPARγ激活能减少大鼠骨骼肌内脂质积累、减轻脂肪肝模型小鼠的肝脏脂质积累[18]等。荷叶水提物促进脂肪动员和分解,降低肥胖大鼠体重和血脂的作用与其改善大鼠脂肪组织PPARγ的表达有关[19]。我们课题组前期的研究证实,4周有氧运动改善糖尿病大鼠血糖血脂的作用与运动增加PPARγ表达,进而增加糖脂代谢关键酶有关[13]。
尽管PPARα与PPARγ受不同基因编码,在不同组织中表达程度不同,但两者结构相似,功能相近,它们之间是否有相互作用?目前这方面的研究报道很少。仅有的研究报道PPARγ激动剂(如二甲双胍和罗格列酮)可通过激活AMPK间接激活PPARα[20]。鉴于有氧运动能调控这两种PPARs,且这两种PPARs均能调控糖脂代谢和胰岛素敏感性,我们推测在运动状态下PPARγ和PPARα之间可能有调节作用,但尚未见相关文献报道。为明确此问题,本文利用PPARγ特异性抑制剂GW9662(仅对PPARγ有抑制作用,并不会抑制PPARα表达[15])来研究4周有氧运动对糖尿病大鼠AMPK-PPARα-CPT1的激活是否依赖PPARγ。结果发现,GW9662对运动糖尿病大鼠的PPARα和CPT1的蛋白水平无显著影响,仅显著降低骨骼肌AMPK的蛋白水平,表明有氧运动对糖尿病大鼠PPARα及CPT1的上调不依赖于PPARγ,但对骨骼肌AMPK的上调至少部分是通过PPARγ介导。此外,本文还利用PPARγ激动剂吡格列酮来研究有氧运动状态下PPARγ激动剂是否能进一步上调运动糖尿病大鼠PPARα信号通路蛋白的水平,结果发现PPARγ的激活可进一步增加运动糖尿病大鼠的AMPK-PPARα-CPT1蛋白水平。类似地,Piché ME等人的研究发现PPARγ激活可进一步增强运动对2型糖尿病成年男性血压的降低作用[21]。
值得一提的是,已有研究报道,PPARα激动剂和PPARγ激动剂的联合使用比单用任一种激动剂有更好的改善血糖血脂作用。例如非诺贝特(广泛应用于临床治疗的PPARα激动剂)和吡格列酮各一半剂量的合用比任一全剂量的单激动剂,能更好地降低非酒精性脂肪肝大鼠血清和肝脏的TC和TG水平[22]。相反,PPARα抑制剂MK886和PPARγ抑制剂GW9662联合使用,可使脂肪肝大鼠的血清、肝脏TC、TG水平升高得更显著[15]。PPARα和PPARγ同时激活不仅比单一激动剂的作用更好,而且可减轻单一激动剂的副作用(如体重增加是TZDs在临床上的一个典型不良效果),因此,PPARα/γ双重激动剂的发现和合成成为目前的一个关注点。已有文献报道PPARα/γ双重激动剂的作用可能是由于它更好地改善瘦素及脂联素的平衡以及调控糖脂代谢关键酶实现的[22]。
总之,4周有氧运动对DM大鼠血糖血脂的改善作用与运动激活肝和腓肠肌的AMPK-PPARα-CPT1通路有关。运动对DM大鼠PPARα通路的激活与PPARγ无关,但PPARγ激活具有进一步增强运动对AMPK-PPARα-CPT1蛋白水平上调的作用。
