帕比司他抑制卵巢癌裸鼠移植瘤上皮-间质转化和生长机制探讨
2020-11-30秦杰柴晓菲李向龙
秦杰,柴晓菲,李向龙
卵巢癌是最常见的妇科恶性肿瘤之一,其前期临床特征不明显,发现时患者多已处于癌症晚期,临床以手术和化疗为主要治疗手段[1]。研究显示,卵巢癌细胞的过度增殖、侵袭和转移是导致卵巢癌患者病死率和复发率高的主要原因[2]。具有PDZ结合域的转录共刺激因子(transcriptional co-activator with PDZ-binding motif,TAZ)是哺乳动物Hippo通路下游的效应因子之一,可通过调控下游靶因子转录共激活过程,参与细胞增殖、迁移等进程[3-4]。表皮生长因子受体(epidermal growth factor receptor,EGFR)与其特异性受体结合可激活下游通路,促进细胞增殖、分化[5]。有研究认为抑制EGFR基因表达水平可降低卵巢癌细胞的增殖能力[6]。抑制TAZ表达水平可有效抑制下游EGFR信号通路的激活,降低视网膜细胞瘤的增殖水平[7]。帕比司他(panobinostat,LBH589)是一种组蛋白去乙酰化酶抑制剂,具有较高的抗癌活性,可抑制三阴性乳腺癌转移和上皮-间充质表型转化(epithelial-mesenchymal transition,EMT)[8]。然而,目前关于LBH589在卵巢癌中的研究报道较少。本研究旨在通过观察LBH589对卵巢癌裸鼠移植瘤生长和EMT的影响,尝试揭示其可能作用机制,以期为卵巢癌的临床治疗提供参考。
1 材料与方法
1.1 实验材料人卵巢上皮癌细胞株Skov3购自上海素尔生物科技有限公司。无特定病原体(SPF)级雌性BALB/c裸鼠55只,6周龄,体质量20 g左右,购自北京维通利华实验动物技术有限公司。LBH589购自美仑生物科技公司;贝伐单抗购自上海赛迈生物科技有限公司;细胞培养液购自美国Sigma公司;抗TAZ、EGFR、钙黏附蛋白E(E-cadherin,ECad)、波形蛋白(Vimentin,Vim)、GAPDH抗体购自赛默飞世尔科技公司;辣根过氧化物酶标记的兔抗鼠IgG二抗购自美国Abbkine公司。
1.2 细胞培养常规复苏人卵巢上皮癌细胞Skov3培养2 d,进行细胞传代,取对数生长期细胞进行后续实验。
1.3 实验方法
1.3.1 卵巢癌裸鼠移植瘤模型构建及分组参照文献[9]于55只雌性BALB/c裸鼠的单侧腋窝皮下注射0.2 mL(1×107/mL)人卵巢上皮癌细胞Skov3的单细胞悬液,3周后当裸鼠出现直径约12 mm的皮下结节时随机抽取5只进行病理切片,结果证实卵巢癌裸鼠移植瘤模型均制作成功。将剩余造模成功的50只小鼠按随机数字表法分为阳性对照组、阴性对照(模型)组,以及LBH589低、中、高浓度组,每组10只。阳性对照组:腹腔注射5 mg/kg贝伐单抗溶液;模型组腹腔注射等量生理盐水;LBH589低、中、高浓度组:分别腹腔注射10、30及50 nmol/L的LBH589,剂量同模型组,各组均1次/d。
1.3.2 小鼠肿瘤生长情况观察HE染色法(×400)观察小鼠移植瘤组织病理学变化。各组干预后每3 d测定瘤体最长直径(a)和最短直径(b),计算移植瘤的体积(V,mm3)=(l/2)×a×b2,并根据移植瘤体积计算抑瘤率=(模型组平均体积-实验组平均体积)/对照组平均体积×100%,计算除模型组外各组间抑瘤率的变化情况。
1.3.3 Western blot检测移植瘤组织中TAZ、EGFR、E-Cad、Vim表达情况各组小鼠连续干预14 d后处死,取出移植瘤组织并剪取约1 g用于提取组织蛋白,然后置于-80℃冰箱中备用。BCA法检测移植瘤组织蛋白浓度,调整上样蛋白至50μg,行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE),移至硝酸纤维素膜上,用5%脱脂奶室温封闭2 h,加入一抗(抗TAZ、EGFR、E-Cad、Vim、GAPDH抗体,稀释浓度均为1∶1 000),4℃孵育过夜,次日加入对应二抗室温孵育2 h、洗膜,加ECL发光液,用Bio Rad成像系统检测蛋白灰度信号,Image J 1.8.0版软件定量分析蛋白表达情况。目的蛋白相对表达量=目的蛋白灰度值/GAPDH蛋白灰度值。
1.4 统计学方法采用GraphPad Prism 7.0统计软件进行数据分析。符合正态分布的计量数据以均数±标准差(x±s)表示,重复测量资料采用重复测量资料的方差分析。多组间比较用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌裸鼠移植瘤病理表现造模开始3周后,造模成功小鼠移植瘤组织中肿瘤细胞呈实片状排列,核增大,间质促纤维组织增生明显,周围可见炎症细胞浸润,见图1。
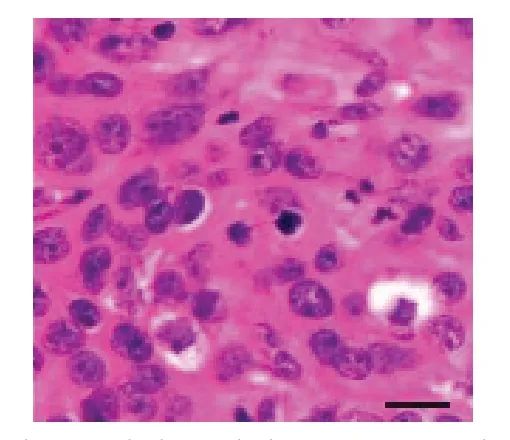
Fig.1 Results of histopathological changes of transplanted tumor in mice(HE staining,×400)图1小鼠移植瘤组织病理学变化结果(HE染色,×400)
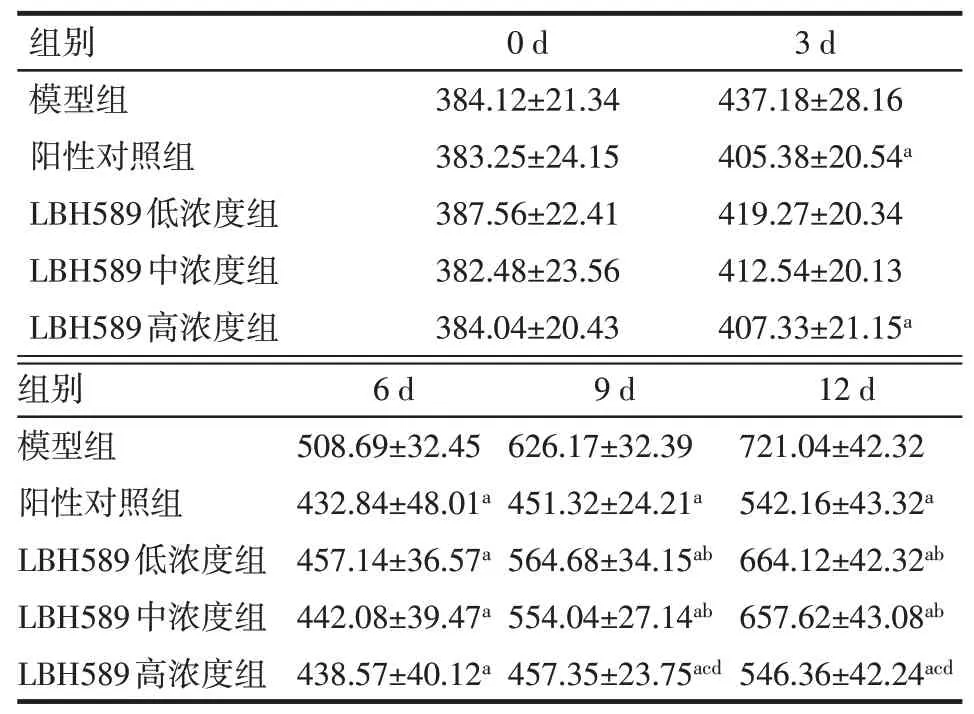
2.2 各组小鼠皮下移植瘤体积变化干预方式与时间点间存在交互作用,随时间持续各组移植瘤体积均呈升高趋势(P<0.05)。与模型组比较,3 d时阳性对照组、LBH589高浓度组小鼠皮下移植瘤体积减小,6、9、12 d时阳性对照组、LBH589各浓度组小鼠皮下移植瘤体积均减小(P<0.05);与阳性对照组比较,9、12 d时LBH589低、中浓度组小鼠皮下移植瘤体积增大(P<0.05),而LBH589高浓度组的差异无统计学意义;与LBH589低、中浓度组比较,9、12 d时LBH589高浓度组小鼠皮下移植瘤体积减小(P<0.05),LBH589低、中浓度组间移植瘤体积差异无统计学意义,见表1。
Tab.1 The comparison of transplanted tumor volumes at different time points between five groups表1 5组间不同时间点移植瘤体积比较(n=10,mm3,±s)
Tab.1 The comparison of transplanted tumor volumes at different time points between five groups表1 5组间不同时间点移植瘤体积比较(n=10,mm3,±s)
F组间=71.395,F时间=452.391,F交互=13.234,均P<0.01;a与模型组比较,b与阳性对照组比较,c与LBH589低浓度组比较,d与LBH589中浓度组比较,P<0.05
组别模型组阳性对照组LBH589低浓度组LBH589中浓度组LBH589高浓度组0 d 384.12±21.34 383.25±24.15 387.56±22.41 382.48±23.56 384.04±20.43 3 d 437.18±28.16 405.38±20.54a 419.27±20.34 412.54±20.13 407.33±21.15a组别模型组阳性对照组LBH589低浓度组LBH589中浓度组LBH589高浓度组6 d 508.69±32.45 432.84±48.01a 457.14±36.57a 442.08±39.47a 438.57±40.12a 9 d 626.17±32.39 451.32±24.21a 564.68±34.15ab 554.04±27.14ab 457.35±23.75acd 12 d 721.04±42.32 542.16±43.32a 664.12±42.32ab 657.62±43.08ab 546.36±42.24acd
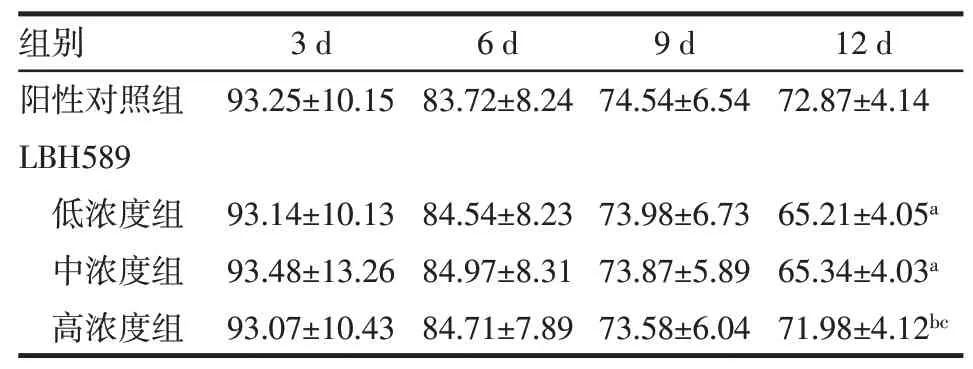
2.3 4 组小鼠皮下移植瘤抑瘤率比较不同干预方式与时间点间无交互作用,在各组干预12 d时,与阳性对照组、LBH589高浓度组比较,LBH589低、中浓度组小鼠皮下移植瘤抑瘤率降低(P<0.05),阳性对照组与LBH589高浓度组间抑瘤率差异无统计学意义,见表2。
Tab.2 The comparison of tumor inhibition rates of subcutaneously transplanted tumors between different time points of four groups of mice表2 4组不同时点小鼠皮下移植瘤抑瘤率比较(n=10,%,±s)
Tab.2 The comparison of tumor inhibition rates of subcutaneously transplanted tumors between different time points of four groups of mice表2 4组不同时点小鼠皮下移植瘤抑瘤率比较(n=10,%,±s)
F时间=0.601,F交互=0.758,均P>0.05;F组间=77.162,P<0.05;a与阳性对照组比较,b与LBH589低浓度组比较,c与LBH589中浓度组比较,P<0.05
组别阳性对照组LBH589低浓度组中浓度组高浓度组3 d 93.25±10.15 6 d 83.72±8.24 9 d 74.54±6.54 12 d 72.87±4.14 93.14±10.13 93.48±13.26 93.07±10.43 84.54±8.23 84.97±8.31 84.71±7.89 73.98±6.73 73.87±5.89 73.58±6.04 65.21±4.05a 65.34±4.03a 71.98±4.12bc
2.4 各组E-Cad、Vim、TAZ、EGFR蛋白相对表达水平比较与模型组比较,阳性对照组、LBH589各浓度组E-Cad蛋白相对表达水平升高,Vim、TAZ、EGFR蛋白相对表达水平降低(P<0.05);与阳性对照组比较,LBH589低、中浓度组E-Cad蛋白相对表达水平降低,Vim、TAZ、EGFR蛋白相对表达水平升高(P<0.05),而LBH589高浓度组各蛋白相对表达水平差异均无统计学意义;与LBH589低、中浓度组比较,LBH589高浓度组E-Cad蛋白相对表达水平升高,Vim、TAZ、EGFR蛋白表达降低(P<0.05),见图2、表3。
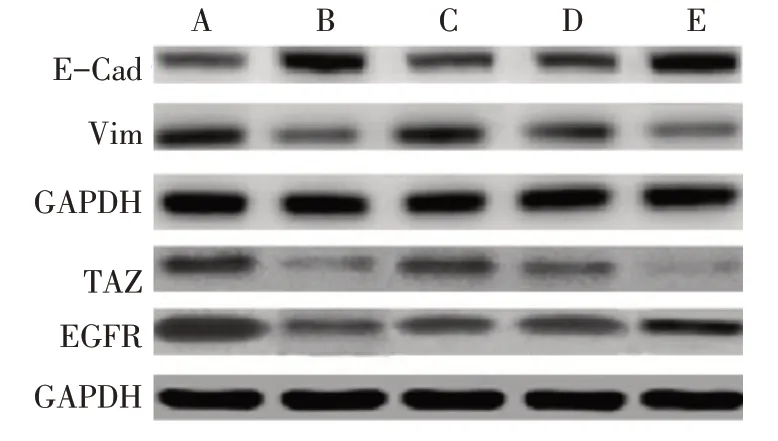
Fig.2 The Western blot results of E-Cad,Vim,TAZ and EGFR proteins in each group图2各组E-Cad、Vim、TAZ、EGFR蛋白相对表达情况
3 讨论
在妇科恶性肿瘤中,卵巢癌患者死亡率最高,是乳腺癌死亡率的5倍[10]。研究认为,卵巢癌细胞侵袭转移及化疗药物耐药的产生是导致卵巢癌预后较差、病死率高的主要原因,而卵巢原位移植瘤裸鼠模型是探究卵巢癌的致病及侵袭转移机制的重要手段[11]。本研究结果显示,卵巢原位移植瘤裸鼠模型的肿瘤细胞呈实片状排列,肿瘤细胞核增大,间质中促纤维组织增生,周围可见炎症细胞浸润,提示卵巢癌裸鼠移植瘤模型构建成功。
Tab.3 The effects of E-Cad,Vim,TAZ and EGFR protein expressions in each group表3各组E-Cad、Vim、TAZ、EGFR蛋白表达的影响(n=10,±s)
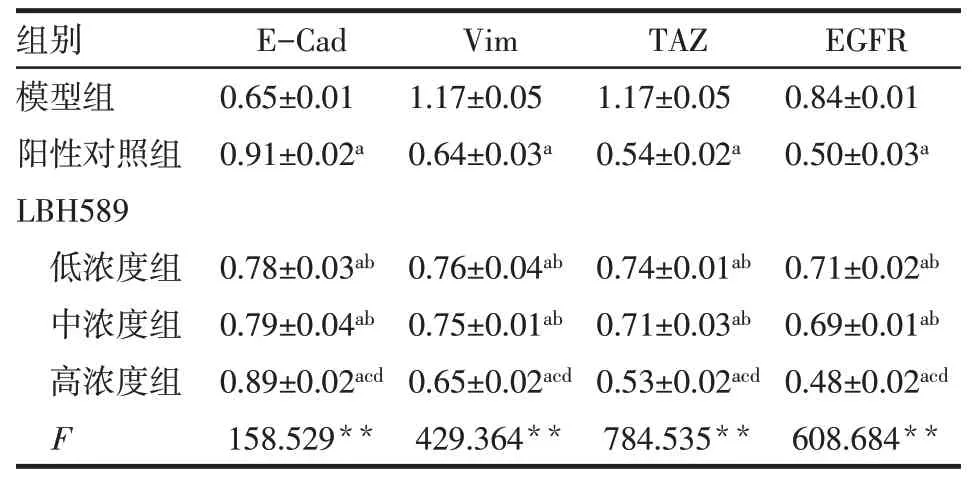
Tab.3 The effects of E-Cad,Vim,TAZ and EGFR protein expressions in each group表3各组E-Cad、Vim、TAZ、EGFR蛋白表达的影响(n=10,±s)
**P<0.01;a与模型组比较,b阳性对照组比较,c与LBH589低浓度组比较,d与LBH589中浓度组比较,P<0.05
组别模型组阳性对照组LBH589低浓度组中浓度组高浓度组F E-Cad 0.65±0.01 0.91±0.02a Vim 1.17±0.05 0.64±0.03a TAZ 1.17±0.05 0.54±0.02a EGFR 0.84±0.01 0.50±0.03a 0.78±0.03ab 0.79±0.04ab 0.89±0.02acd 158.529**0.76±0.04ab 0.75±0.01ab 0.65±0.02acd 429.364**0.74±0.01ab 0.71±0.03ab 0.53±0.02acd 784.535**0.71±0.02ab 0.69±0.01ab 0.48±0.02acd 608.684**
目前,大量研究表明LBH589在多种癌症中发挥着重要作用。Yao等[12]研究显示,LBH589可以抑制胶质母细胞瘤的细胞增殖,有显著的抗肿瘤作用。朱静等[13]研究显示,LBH589可抑制上皮性卵巢癌OVCAR-3细胞增殖。Lin等[14]研究显示,LBH589可减少小鼠乳腺癌移植瘤的肿瘤体积。本研究发现,在干预6、9、12 d时,与模型组比较,LBH589阳性对照组、LBH589各浓度组小鼠皮下移植瘤体积减小,表明LBH589可有效抑制卵巢癌裸鼠移植瘤生长;与阳性对照组比较,6 d时LBH589各浓度组小鼠皮下移植瘤体积差异无统计学意义,9、12 d时阳性对照组小鼠皮下移植瘤体积小于LBH589低、中浓度组,表明LBH589的药效发挥与给药时间有关;在同一时间点,LBH589高浓度组与阳性对照组相比,小鼠皮下移植瘤体积、抑瘤率差异无统计学意义,表明LBH589抑制卵巢癌裸鼠移植瘤生长效果与贝伐单抗作用效果相近;与LBH589低、中浓度组相比,LBH589高浓度组小鼠皮下移植瘤体积减小、抑制率升高,提示LBH589高浓度对小鼠皮下移植瘤体积抑制效果较好。
EMT是肿瘤发生侵袭和转移的主要影响因素,在肿瘤的发生、发展过程中发挥着重要的作用。ECad属于黏附分子钙依赖性黏附素家族,与细胞间黏附性及细胞活动性关系密切,是EMT的上皮标志物。Vim属于中间丝蛋白家族,主要作用是维持细胞完整性,是EMT的重要标志物[15]。研究显示,卵巢癌患者的癌组织中E-Cad中表达降低,Vim蛋白相对表达水平升高[16]。Matossian等[8]研究显示,LBH589可抑制乳腺癌转移和间质表型转化。本研究发现,与模型组比较,阳性对照组和LBH589高浓度组小鼠癌组织中E-Cad蛋白相对表达水平升高,Vim蛋白降低,表明LBH589高浓度可能通过调节E-Cad、Vim蛋白表达,抑制小鼠皮下移植瘤EMT。Zhang等[17]研究显示,可以通过调节SKOV3细胞的EMT来减慢其增殖。因此,笔者推测LBH589可能通过抑制小鼠皮下移植瘤EMT,减缓皮下移植瘤体积的增加,但其具体机制仍需进一步确认。
TAZ是一种致癌基因,在乳腺癌、肺癌等多种癌组织中高表达。研究显示,TAZ在结肠癌组织中表达升高,与结直肠癌浸润转移潜能关系密切[18]。修子涵等[19]研究表明,Yes相关蛋白(Yes-associated protein,YAP)/TAZ在肿瘤细胞EMT中发挥重要作用,通过敲低TAZ基因可以逆转EMT,并减少间充质标志物Vim的表达,增加上皮标志物E-Cad的表达。EGFR属于ErbB受体家族,在细胞的生长、增殖和分化等过程中起重要作用。研究发现,肝细胞癌中EGFR表达升高,EGFR在促进癌细胞侵袭过程中发挥重要作用[20]。Cao等[21]研究显示,可通过调节TAZ/EGFR信号通路来抑制卵巢癌细胞的EMT。Lee等[22]研究显示,LBH589可抑制TAZ转录,同时下调TAZ下游靶标EGFR和EGFR配体表达。本研究发现,与模型组比较,阳性对照组、LBH589高浓度组小鼠移植瘤组织中TAZ、EGFR蛋白相对表达水平降低,表明LBH589可以下调TAZ、EGFR蛋白表达,抑制TAZ/EGFR信号通路激活,提示LBH589可能通过抑制TAZ/EGFR通路,上调E-Cad,下调Vim蛋白表达,从而抑制卵巢癌裸鼠移植瘤生长和EMT。
