黄颡鱼寄生东肌吸虫属(复殖吸虫亚纲:东肌吸虫科)3种复殖吸虫的分类学研究
2020-11-30李寄仟李云臻范丽仙
李寄仟,李云臻,范丽仙,2*
(1.云南师范大学生命科学学院,昆明650500;2.生物能源持续开发利用教育部工程研究中心,昆明650500)
复殖吸虫亚纲Digenea包括140多科1 000多属(唐崇惕,唐仲璋,2015),约18 000个物种,是最大的寄生虫类群之一(Cribb et al.,2001)。Tubangui(1931)在菲律宾的胡鲇Clarias batrachus消化道中首次发现东肌吸虫,并为其创立了东方肌体属Orientocreadium Tubangui,1931,简称东肌吸虫属,并将其隶属于异肌科Allocreadiidae Stossich,1904,命名为O.batrachoides(拟柏他东肌吸虫),Tubangui(1933)又将此虫置于异肌亚科Allocreadiinae Looss,1902。Pande(1934)补充了东肌吸虫属的一些特征,且将其归属于 Plesiocreadiinae Winfield,1929亚科。Bychowsky和Dubinina(1954)描述了新属新种Paratormopsolus siluri,将其归于棘体科Acanthocolpidae Lǔhe,1909,但据其形态特征,P.siluri属于东肌吸虫属。Yamaguti(1958)在异肌科中创立了东肌亚科Orientocreadiinae Yamaguti,1958,将拟柏他东肌吸虫及其他近似种编目在其中,他认为下列各属Ganada Chatterji,1933、Neoganada Dayal,1938、Nizamia Dayal,1938、Ganadatrema Dayal,1949 和 Paratormopsolus Bychowsky et Dubinina,1954均为东肌吸虫属的同物异名,除模式种拟柏他东肌吸虫外,同时还对11种属内种进行了描述;但Beverley-Burton(1962)曾报告拟柏他东肌吸虫的形态变异范围较大,认为O.barabankiae、O.indicum、O.dayali、O.secundum、O.mohendrai、O.philippai以及 O.vermai等7种吸虫均是拟柏他东肌吸虫的同种异名。Skrjabin和Koval(1960)为本类吸虫创立东肌吸虫科Orientocreadiidae Skrjabin et Koval,1960新科。唐仲璋和林秀敏(1973)报告了拟柏他东肌吸虫的生活史研究结果,并从幼虫期发育史与其他科属的亲缘关系对其分类位置问题进行了讨论,认为东肌吸虫科应是一个独立的科,隶属于斜睾总科Plagiorchioidea Dollfus,1930。Jones和 Bray(2008)认为,东肌吸虫科是一个单属科,其下只有东肌吸虫属Orientocreadium Tubangui,1931,而原有的 Ganada Chatterji,1933、Neoganada Dayal,1938、Nizamia Dayal,1938、Ganadotrema Dayal,1949、Macrotrema Gupta,1951 nec Regan,1912 和 Paratormopsolus Bychowsky et Dubinina,1954均是东肌吸虫属的异名。Sokolov和Shchenkov(2017)、Dumbo等(2019)分别基于O.pseudobagri和拟柏他东肌吸虫的分子数据,通过28S rDNA序列系统发育分析,确定了该家族的系统发育位置,均证明了东肌吸虫科是一个独立的分类单元,并隶属于斜睾总科。
东肌吸虫的成体通常寄生于非洲和欧亚大陆的淡水鲇形目Siluriformes和鲈形目Perciformes的消化道中,但也有些种类寄生在印度的陆生爬行动物中(Beverley-Burton,1962;Yamaguti,1971;Hafeezullah,1989)。该类吸虫目前已记录28种,我国记录3种:拟柏他东肌吸虫、印度东肌吸虫O.indicum Pande,1934和鲶东肌吸虫O.siluri(Bycbowsky et Dubinina,1954)Yamaguti,1958(Yamaguti,1971;唐仲璋,林秀敏,1973;Wang et al.,1985;王溪云,1985;Hafeezullah,1989;Agrawal & Sharma,1990;Shimazu,1990;Kim & Rim,1995;Besprozvannykh et al.,2009;Nigam et al.,2015)。该属一些物种的有效性存在争议。
对于东肌吸虫的分类研究,目前仍以形态学鉴定为主,其主要的形态学鉴定依据为:体表具棘或光滑;子宫充满了大部分的后体,环褶多或少;有一定区域分布的卵黄腺,具有内外贮精囊和受精囊(Jones&Bray,2008)。该类吸虫的分子系统发育研究开始于 Sokolov和 Shchenkov(2017)提交的O.pseudobagri 28S rDNA序列,他们构建的系统发育树确定了东肌吸虫科的分类地位。之后,Dumbo等(2019)对拟柏他东肌吸虫的18S、28S rDNA序列进行了测序分析。
本研究通过形态分类学方法和分子系统学手段对采自云南澜沧江水系黄颡鱼Pelteobagrus fulvidraco体内的东肌吸虫属物种进行了分类鉴定和系统发育分析。
1 材料与方法
1.1 宿主采集
黄颡鱼采自云南省澜沧江水系西双版纳傣族自治州景洪流域段(100°36'53″E,22°02'16″N,海拔576 m)和大理白族自治州洱海喜洲流域(100°17'30″E,25°87'27″N,海拔1 972 m)以及购自当地集市,共16尾;寄生部位均位于宿主消化道末段(近泄殖孔)。
1.2 标本处理及制作方法
将宿主鱼处死,剪开腹腔,取出完整的消化道,用0.65% ~0.70%生理盐水浸泡,并将其剖开置于解剖镜(Olympus SZ)下检查寄生虫。发现虫体后观察活体,将其移至薄荷酒精中麻醉数分钟至虫体自然舒展后将虫体进行压片,放入4%甲醛溶液浸泡12 h固定。将固定好的虫体用70%乙醇溶液浸洗后置于Mayer's洋红染液或硼砂洋红染液中染色2~12 h,用70%酸酒精分色,至虫体逐渐褪色到内部结构清晰为止。依次将虫体置于70%、80%、90%、95%、100%和100%乙醇中梯度脱水(70% ~95%各1 h,100%各2 h),置于透明液(二甲苯∶无水乙醇=1∶1)中透明1 h,再置于丁香油中透明过夜,然后取出虫体用中性树胶封片,平放晾干。将封片置于微分干涉差显微镜(Olympus BX53)下对虫体的形态结构进行观察、测量、拍照及绘图。标本保存于云南师范大学生命科学学院动物学教研室(正模标本:201807JH105、副模标本:201807JH101)。
1.3 分子系统发育研究方法
将虫体初步鉴定后浸泡于100%乙醇的1.5 mL的离心管中备用,使用D3399-01石蜡DNA提取试剂盒提取吸虫的总DNA。PCR反应体系为:2 × Power Taq PCR Master Mix(25 μL)、ddH2O(19 μL)、DNA 原液(2 μL)、上游引物(2 μL)、下游引物(2 μL)。引物由昆明硕擎生物科技有限公司合成:上游引物LSU-5(5'-TAGGTCGACCCGCTGAAYTTAAGCA-3')和下游引物1500R(5'-GCTATCCTGAGGGAAACTTCG-3')(Sokolov&Shchenkov,2017)。反应条件:94℃ 1 min;92℃ 30 s,50℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 4 min。PCR反应产物由昆明硕擎生物科技有限公司进行双向测序。使用Chromas Pro V2和DNAMAN V6对序列进行校正和拼接。采用MEGA 7.0比较分析各物种间的序列相似性和基于双参数模型计算的遗传距离(Kimura 2-parameter)(Thompson et al.,1997)。基于 28S rDNA部分序列,采用邻接(Neighbor-Joining,NJ)法、最大似然 (Maximum Likelihood,ML)法和最大简约(Maximum Parsimony,MP)法构建系统发育树。
2 鉴定结果
复殖吸虫亚纲Digenea van Beneden,1858
前口目Prosostomata Odhner,1905
斜睾总科Plagiorchioidea Dollfus,1930
东肌吸虫科Orientocreadiidae Skrjabin et Koval,1960
东肌吸虫属Orientocreadium Tubangui,1931
2.1 形态学鉴定
东肌吸虫科隶属于吸虫纲Trematoda Rudolphi,1808复殖吸虫亚纲前口目斜睾总科。东肌吸虫科虫体伸长,体表具棘(有的光滑),口吸盘亚端位,具前咽,咽较大,食道短,两肠管到达体后端。腹吸盘位于体前端约1/3处,或距前端稍远,个别位于体赤道线部位。两睾丸团块状,前后或斜列于体后半部。阴茎囊棒状,含内贮精囊、前列腺和阴茎。具有外贮精囊。生殖孔位居中于腹吸盘直接前方,阴茎囊延伸到腹吸盘的后方。卵巢在腹吸盘和前睾丸之间。子宫延伸到体后端,越过两肠支外侧。虫卵小而数多,具卵壳。卵黄腺分布在体后部两侧,常到达体末端附近,由卵黄滤泡组成,呈近圆形或不规则团块状。排泄囊管状,前伸到后睾丸。成虫通常寄生于非洲和欧亚大陆的淡水鲇形目和鲈形目鱼类的消化道中,也有一些种类寄生在印度的陆生爬行动物中(Jones&Bray,2008)。东肌吸虫科目前被认为是一个单属科(Sokolov&Shchenkov,2017),科下仅有东肌吸虫属。本研究共记述3种(新种、地理新记录种及已记录种各1种)。
东肌吸虫属虫体体表具棘,有的光滑,子宫充满了大部分的后体,卵黄腺分布在一定区域,具有内外贮精囊和子宫精囊。属内种鉴定特征主要为:虫体大小、体表具体棘或光滑、口腹吸盘大小比较、卵黄腺分布水平、卵黄管细胞形态、子宫环褶多或少,虫体末端尖锐或圆钝等。东肌吸虫属目前共记录有效种约28种(Sokolov& Shchenkov,2017),我国已记录其中3种(唐仲璋,林秀敏,1973;王溪云,1985)。模式种:拟柏他东肌吸虫。
3种东肌吸虫属口吸盘亚顶端位,略小于腹吸盘。咽球形,具4个肌质前突。食道较短。阴茎囊与腹吸盘重叠,向右侧弯曲,从生殖孔延伸至腹吸盘后方。外贮精囊向阴茎囊右后方折叠,位于腹吸盘与卵巢之间。卵巢近圆形,光滑,位居中于腹吸盘与前睾丸之间。睾丸近圆形,光滑,居中位,前后排列于虫体的后部,前睾丸略小于后睾丸。卵黄腺分布在卵巢前缘至后睾丸之后水平。子宫末段发育良好,肌质,位于阴茎囊左侧,内壁具棘(图1~图3)。
2.1.1 黄颡东肌吸虫,新种Orientocreadium fulvidraconis sp.nov.(图1)
宿主:黄颡鱼。
寄生部位:肠道。
采集地点:澜沧江水系云南西双版纳景洪流域段(100°79'53″E,22°00'78″N,海拔 576 m)。
采集时间:2018年7月。
感染率:16.7%(1/6)。
感染强度:每尾鱼感染1~45枚虫体。
词源:以宿主命名。
正模标本:201807JH105、副模标本:201807JH101均存放于云南师范大学生命科学学院。
对正模和5个副模进行形态特征数据测量,度量单位mm,正模标本虫体全形见图1。虫体末端稍圆钝,体长为 2.42(2.08~2.98),宽为 0.42(0.35~0.51)。体表无棘。口吸盘大小为0.17(0.16~0.20)×0.15(0.11~0.18)。腹吸盘位于虫体前1/3处,大小为0.19(0.17~0.21)×0.18(0.15~0.20)。口腹吸盘比为1∶1.35(1.15~1.55)。前咽长0.15(0.10~0.19),咽大小为0.12(0.10~0.13)×0.10(0.08~0.12)。食道长0.08(0.05~0.14)。阴茎囊大小为 0.34(0.28~0.46)×0.11(0.09~0.13),内贮精囊大小为0.06(0.05~0.07)×0.05(0.04~0.05)。外贮精囊大小为0.22(0.20~0.25)×0.12(0.11~0.14)。卵巢位于虫体1/2处,大小为0.15(0.13~0.19)×0.13(0.11~0.15)。前睾丸大小为0.20(0.16~0.23)×0.16(0.13~0.19),后睾丸大小为0.22(0.18~0.25)×0.18(0.14~0.21)。子宫环褶较少,子宫末段大小为0.26(0.22~0.34)×0.05(0.04~0.07)。卵大小为0.033(0.030~0.038)×0.020(0.016~0.026)。
经以上形态学特征和测量数据的比较,该种吸虫与寄生于印度胡鲇消化道内的O.lucknowensis Nigam,2015(Nigam et al.,2015)和寄生于日本叉尾疯鲿Tachysurus nudiceps和石鲶Silurus lithophilus消化道内的O.pseudobagri Yamaguti,1934(Shimazu,2014)相似度较高。虽然 O.lucknowensis体表也无体棘,但其虫体较短,前咽缺失,卵黄腺从卵巢前缘水平分布至虫体末端等;O.pseudobagri体表具体棘,卵黄管细胞呈“晶格”状等。二者的这些特征均明显区别于新种。综合以上形态学鉴定结果认为,该种吸虫为东肌吸虫属一新种,以终末宿主名命名为黄颡东肌吸虫新种O.fulvidraconis sp.nov(表1;图1)。
2.1.2 Orientocreadium pseudobagri
宿主:黄颡鱼。
寄生部位:肠道。
采集地点:澜沧江水系云南西双版纳景洪流域段(100°79'53″E,22°00'78″N,海拔 576 m)。
采集时间:2018年7月。
感染率:33.3%(2/6)。

图1 黄颡东肌吸虫新种Orientocreadium fulvidraconis sp.nov.Fig.1 Orientocreadium fulvidraconis sp.nov.
感染强度:每尾鱼感染2~8枚虫体。
对正模和4个副模进行形态学数据测量,度量单位mm,正模标本虫体全形见图2。该吸虫体末端稍圆钝,体长为2.19(1.57~3.03),宽为0.41(0.30~0.53)。体表具棘,前端较为密集,向后分布逐渐变稀疏,至后睾丸后缘处消失。口吸盘大小为0.16(0.14~0.20)×0.16(0.13~0.19)。腹吸盘位于虫体前1/3处,大小为0.19(0.16~0.24)×0.18(0.13~0.22)。口腹吸盘比为 1∶1.32(1.10~1.65)。前咽长0.12(0.05~0.20),咽大小为0.11(0.09~0.13)×0.11(0.09~0.13)。食道长0.08(0.07~0.10)。阴茎囊大小为 0.33(0.27~0.45)×0.09(0.07~0.12),内贮精囊大小为0.08(0.07~0.12)×0.06(0.05~0.07)。外贮精囊大小为0.15(0.11~0.19)×0.09(0.06~0.10)。卵巢位于虫体1/2处,大小为0.16(0.13~0.21)×0.15(0.12~0.20)。前睾丸大小为0.19(0.15~0.25)×0.17(0.13~0.21),后睾丸大小为0.21(0.16~0.29)×0.18(0.13~0.25)。两侧的输卵黄小管由晶格状细胞组成。子宫环褶较少,子宫末段大小为0.24(0.20~0.32)×0.05(0.03~0.06)。卵大小为0.031(0.027~0.037)×0.019(0.016~0.023)。
经以上形态学特征和测量数据的比较,该种吸虫与寄生于日本 P.surantiacus消化道内的O.pseudobagri Yamaguti,1934(Shimazu,2014)、寄生于日本叉尾疯鲿和石鲶消化道内的O.pseudobagri Yamaguti,1934(Shimazu,2014)和寄生于朝鲜黄颡鱼消化道内的O.pseudobagri Kim and Rim,1995(Kim&Rim,1995)的形态特征相一致。故认为该种吸虫为记录种O.pseudobagri,中国首次记录(表1;图2)。
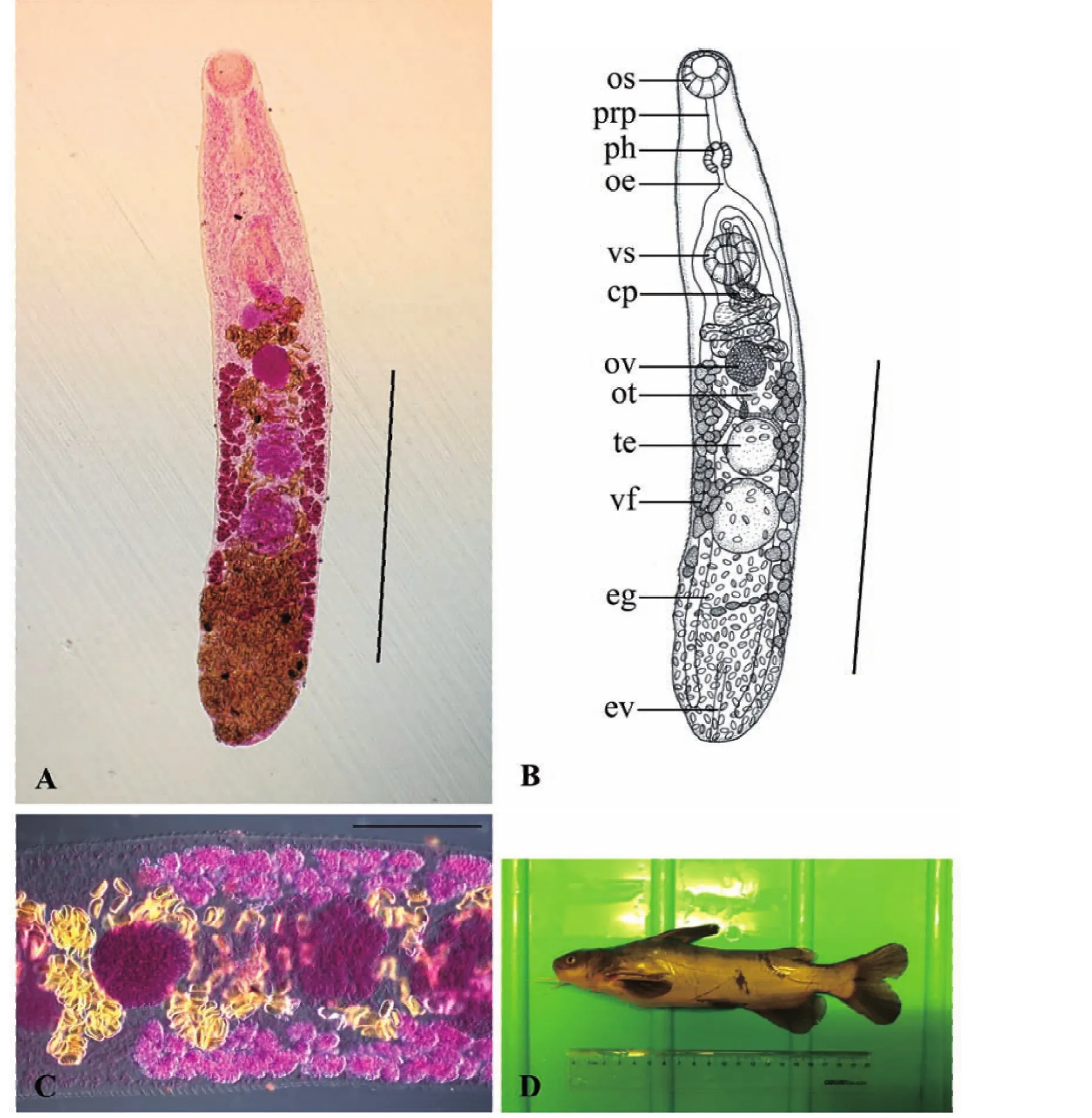
图2 Orientocreadium pseudobagriFig.2 Orientocreadium pseudobagri
2.1.3 印度东肌吸虫Orientocreadium indicum
宿主:黄颡鱼。
寄生部位:肠道。
采集地点:澜沧江水系云南大理洱海喜洲流域段(100°17'29″E,25°87'26″N,海拔 1 972 m)。
采集时间:2019年6月。
感染率:40%(4/10)。
感染强度:每尾鱼感染8~34枚虫体。
对正模和14个副模进行形态学数据测量,度量单位mm,正模标本虫体全形见图3。该吸虫体末端稍尖,体长为1.43(1.13~1.88),宽为0.29(0.23~0.37)。体表具棘,前端较为密集,向后分布逐渐变稀疏,至后睾丸后缘处消失。口吸盘大小为0.13(0.10~0.14)×0.12(0.09~0.13)。腹吸盘位于虫体前1/4或1/5处,大小为0.14(0.11~0.16)×0.13(0.10~0.15)。前咽长0.06(0.03~0.10),咽大小为 0.10(0.07~0.12)×0.07(0.06~0.08)。食道长0.04(0.03~0.06)。阴茎囊大小为 0.31(0.24~0.35)×0.06(0.05~0.08),内贮精囊大小为0.05(0.04~0.07)×0.04(0.03~0.05)。外贮精囊大小为0.12(0.08~0.18)×0.05(0.04~0.07)。卵巢位于虫体前1/3或1/2处,大小为0.12(0.10~0.14)×0.09(0.08~0.11)。前睾丸大小为0.16(0.12~0.19)×0.12(0.09~0.15),后睾丸大小为0.17(0.12~0.19)×0.14(0.10~0.17)。子宫环褶较多,子宫末段大小为0.17(0.11~0.22)×0.03(0.02~0.05)。卵大小为0.033(0.027~0.038)×0.019(0.014~0.023)。
经以上形态学特征和测量数据的比较,该种吸虫与寄生于我国黄颡鱼消化道内的印度东肌吸虫O.indicum Wang,1985(王溪云,周静仪,1993)的形态特征相一致。故认为该种吸虫为印度东肌吸虫(表1;图3)。
2.2 中国东肌吸虫属物种检索表
a.体表具棘 ………………………………………………b
体表无棘…………………………………………………… 黄颡东肌吸虫Orientocreadium fulvidraconis sp.nov.
b.口吸盘小于腹吸盘,卵黄腺从卵巢前缘水平分布至后睾丸后方 …………………………………………………c口吸盘大于腹吸盘,卵黄腺从卵巢前缘水平分布至虫体末端 ………………… 拟柏他东肌吸虫O.batrachoides
c.腹吸盘位于虫体前1/3,子宫环褶少,体棘由前体分布至后睾丸后部水平 ………………………………………d腹吸盘位于虫体前1/5,子宫环褶多,体棘由前体分布至后睾丸水平 ………………… 印度东肌吸虫O.indicum
d.虫体较长,前咽较短,卵黄管细胞非“晶格”状……………………………………………… 鲶东肌吸虫O.siluri虫体较短,前咽较长,卵黄管细胞呈“晶格”状………………………………………………………O.pseudobagri
2.3 基于28S rDNA序列东肌吸虫属的分子鉴定及系统发育研究
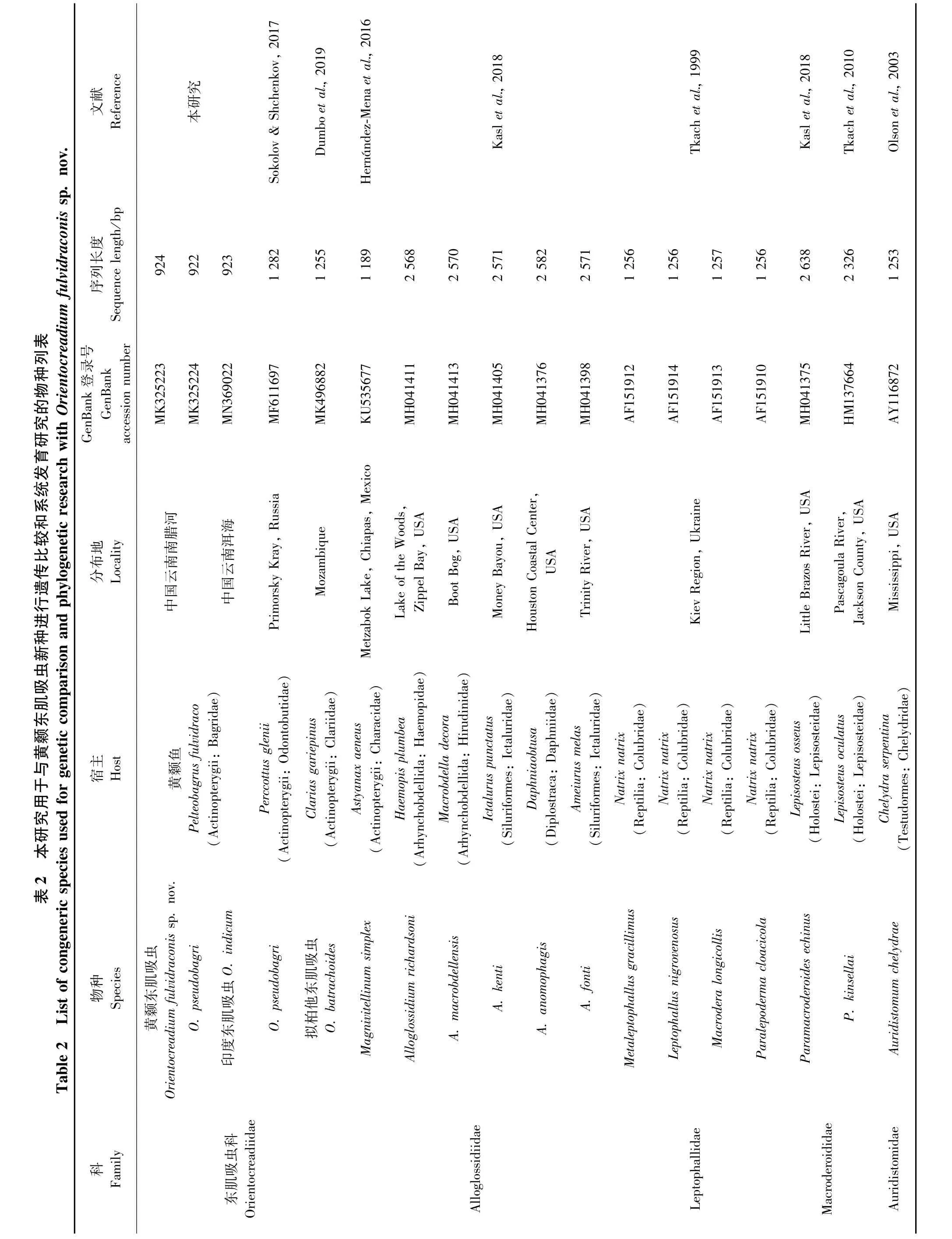
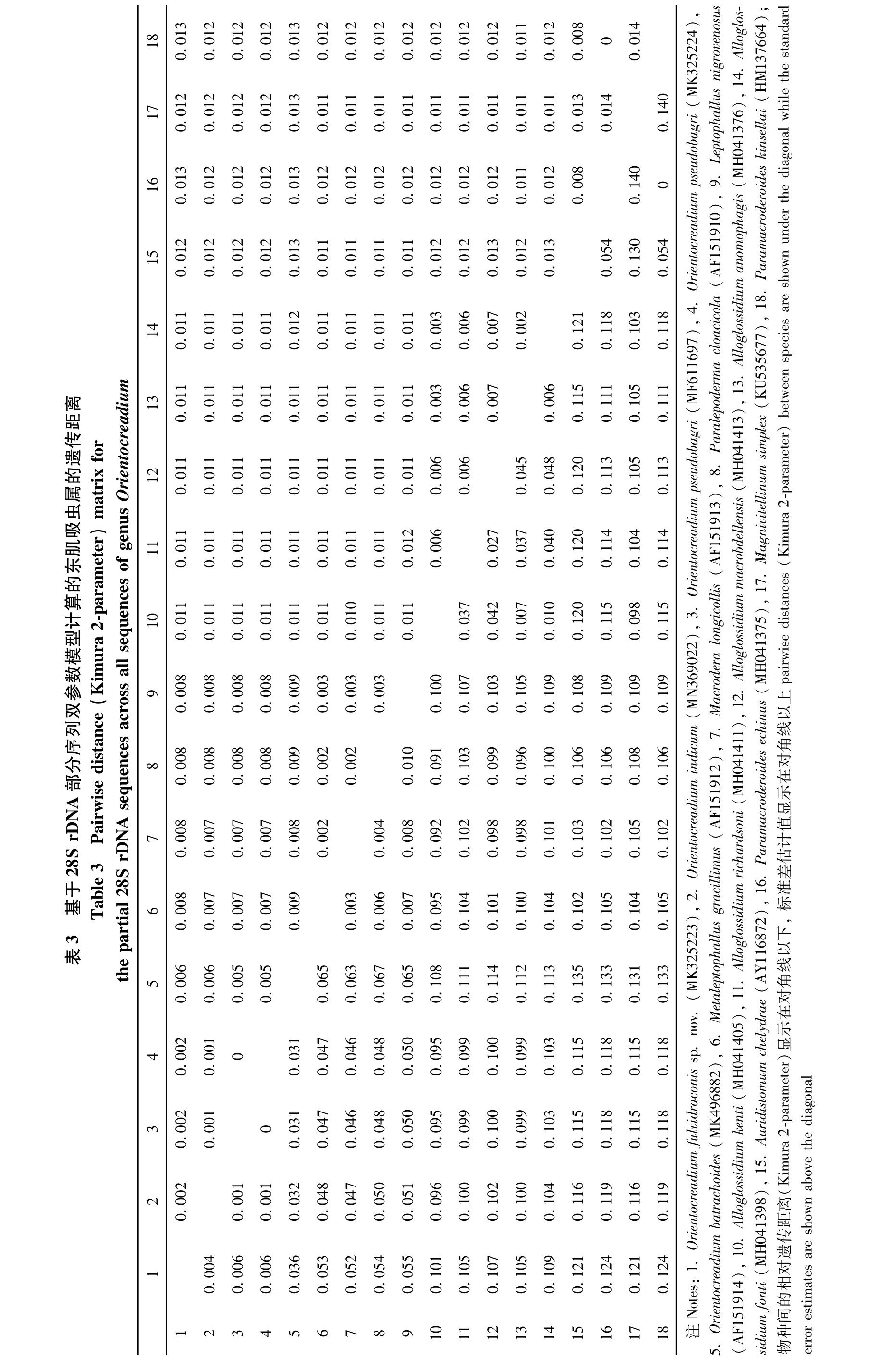
本研究首次测序得到黄颡东肌吸虫(MK325223)、O.pseudobagri(MK325224)和印度东肌吸虫(MN369022)的28S rDNA部分序列,长度分别为924 bp、922 bp和923 bp。对黄颡东肌吸虫的序列进行了碱基组分分析(BLAST),将从Gen-Bank中选取的18条28S rDNA部分序列(包括本研究的序列)对齐后长度为935 bp,其中保守位点692个、变异位点241个、简约信息位点162个、自裔位点79个。T、A、C、G碱基的平均含量为27.3%、21.4%、20.6%、30.6%,A+T 的含量低于C+G。18条序列来自斜睾总科的5个科(Macroderoididae、Auridistomidae、Orientocreadiidae、Leptophallidae、Alloglossidiiae)(表 2)。该新种与 Gen-Bank中目前仅有的4条东肌吸虫属复殖吸虫的同源性序列相似度比较结果显示,序列相似度在95.96% ~99.57%之间,其中与印度东肌吸虫(本研究)的最高,为99.57%,与O.pseudobagri(俄罗斯)的为99.35%,与O.pseudobagri(本研究)的为99.13%,与拟柏他东肌吸虫(南非)的最低,为95.96%。基于28S rDNA部分序列双参数模型计算的遗传距离为0.004~0.124,黄颡东肌吸虫新种序列与东肌吸虫科的其他4条序列之间的遗传距离为0.004~0.036,与印度东肌吸虫的遗传距离最近(0.004),与O.pseudobagri(本研究)和 O.pseudobagri(俄罗斯)的遗传距离均为0.006(表3)。以Macroderoididae+ Auridistomidae[Paramacroderoides echinus(MH041375)、Paramacroderoides kinsellai(HM137664)、Auridistomum chelydrae(AY116872)]作为外群,采用NJ法、ML法和MP法构建了以NJ树为拓扑结构的50%多数一致树(图4),系统发育关系表明,东肌吸虫科为一个独立的分类单元并支持与Leptophallidae为姊妹群聚为一支。黄颡东肌吸虫新种与印度东肌吸虫聚为姐妹群。
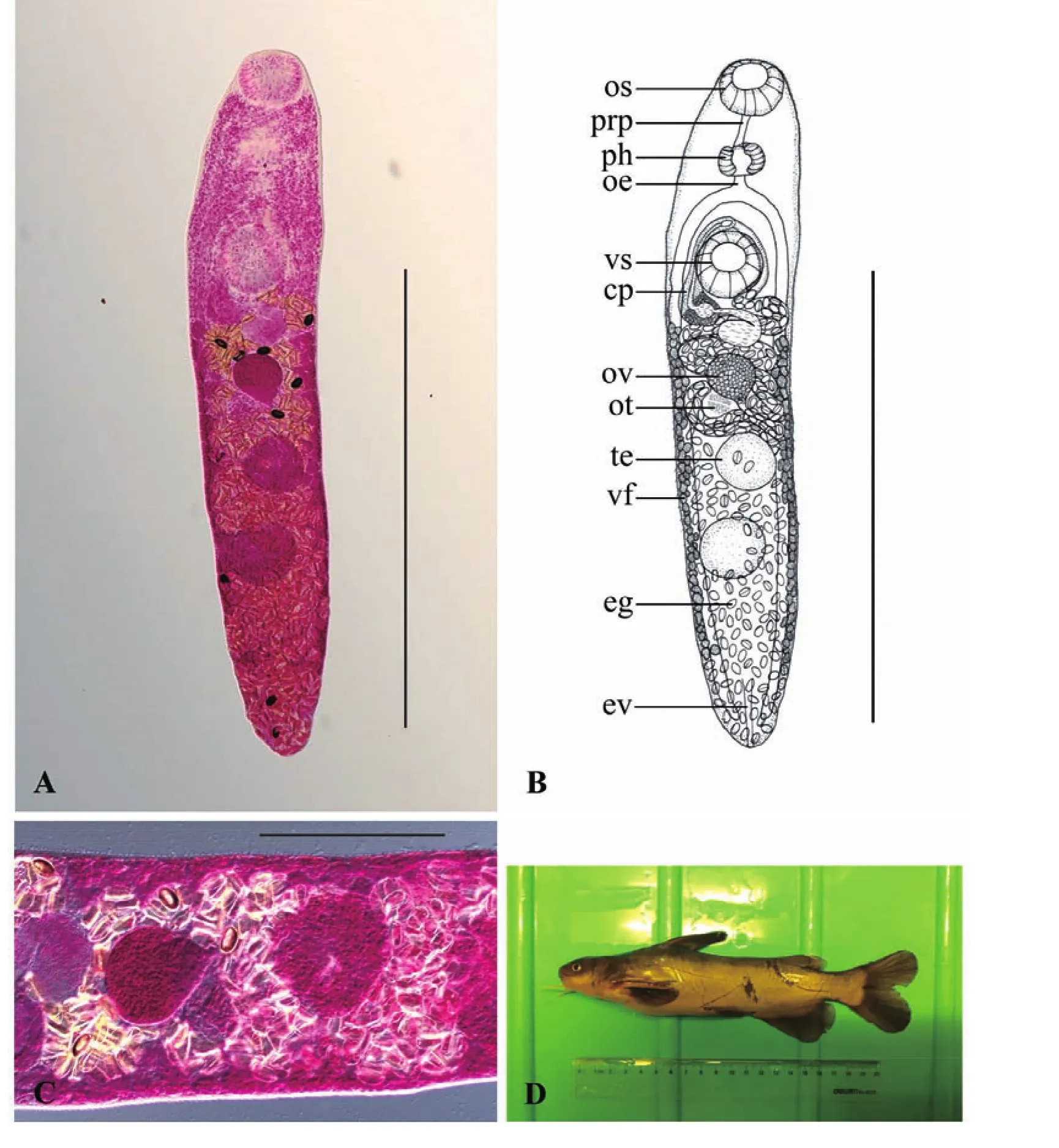
图3 印度东肌吸虫Orientocreadium indicumFig.3 Orientocreadium indicum
3 讨论
!=/<;$#:9 8 7 6 5 4 3 2 1 0/.-,+*)(’&%$#""!!,:9/9*2#0./#*")(’%-+,&’("$)*#+"#$%!)+6 8 1’*’$1.6’+).7&,0’/624$/$1)*,/2.,5’+).0’/-,1*’4 3’.)’**2’1).0’/.,/,-)*+("!&’$%#1 0)<)6)1*);:5(/.%)18.9-,’)74)1*)+*"135)6 14#)12"13))12 0 0"**)++$-1(’&-*"%$.&/$% ,-+.#"’()*$)+! !$%&"#JHK GHIHHG D E B A@@?>=<7 6 1-@?+(?5 4 3 2 7-+./#*")(’%#0 6"#$%&’("$)*#+,!G F E JHH GHIHHK D E-+./#*")(’$.&$’2)3"+0 5 1 0$+*’2)3"#?!"8 6$>")#2*.$1-(.)6&8$$"A !JHG GMJNHH L E D C@?>=#%*#(+,?!5 4 3 2/8!5 4 3 2 6$)1.-*6)">$$>")=HNOP’9*9)13-@$R’-3-%-@HQH O MOOMJP!E 4++$";6"&$D-6+3&6$#C 3.$%##$"((’&&+0>-1.-54.$>")#=5*.$1-(.)6&8$$"A !1 0$+*’2)3"#?!HNOJ).?$$&5-4#S HII O KJMQQH D E 5$74)-F"#E 3)"#$1#%+0%"6$$>")#B.)"#)0 6*.$1-(.)6&8$$"A !5 4 3 2;:2)&")(4’#*$0?9!HNOM).?$$&)1")6 1Z1>)F[E,OQJ O IGIMPP U D)T$*-E 9$"("+$B"3)$/).F"5-3 E)$%$+0 9"6"*$>")#B 0&:)%)8 9*.$1-(.)6&8$$"A !1.$8 0#,)3%#/#&$..#%+,7 IMQ H NKOKOO,E-->+$’A V U.9)"&$-<2"3)$(()%/W 2$)-($>")#1.+,")#,’1#0)$,;6 9&1*9-5>)%%$>""A !"#(4)"*0’%#..’3.’0 0#*#+,9 IPN H NKOKOG,E’A U-8$2--.2*$(’")$6 4>$1$>")#,)("’2*$..)7 6 9&1*9-5>)%%$>""A !)("’2*$..$%0#0,9?%%-8%-++$>$$>")A HNOQ).?$$&"+%D IPO H NKOKNI,E’A U $"&-4 2-1)&E 1+%(&)&+0 X*."%46$>")#=(&).+"+0)+"’$%46$<-6#!<$% ?IQH H NKOGPM,E)1.)6$B-"+."%’A B U-4+.-1,)1 4%#)’2&+0)"(91$$>")#S>$(%-+.6"*""S !’1 4)3#0)%’,9?IPO H NKOGJQ,E’A U$@)6$;6$1$.&Y$.)0,$#+"+0 X*."%46$>")#)+",9’$%46$<-6#!-’% ?HIM O!OIOJOH A%)&"#8-%456$>")#)&"#8B?)(.$%$"";!+0 3")(#..#,$&).$1&’1 4)..+0 7 HIM O!OIOJOK A%)&"#8-%456$>")#)&"#8B?)(.$%$"";!%#3"’/$%’0+0@$1&’1 4)..+0 OJJJ).?$$&3"*9 Y 36"$1)U $)8$-1;$)@D)(.-(9"%%$>")/HIP O!OIOJOG A%)&"#8-%456$>")#)&"#8B?)(.$%$"";!.’%3#(’..#0)("’*$")7 HIM O!OIOJON A%)&"#8-%456$>")#)&"#8B?)(.$%$"";!(.’)(#(’.)))").$1’*$",5 HNOQ).?$$&"+%D MGQ H NKOGPI,E’A U$@)6$;6"F-+2$..%)/’0 0$+0@$1#0’0&$+0)($+-+.)$>")#/-%-+.)$",!$(4#%+0)("’*$"’#*$0)"),5"*6->)6-$>$>")E HNON).?$$&3"*9 Y GHM H OGPMMK E ,$@)6$’A U;"+*"8-4%"-41.&$B C "*3+-1’(+.)&+0@$1#0’0&$+0)($+-+.)$>")#/-%-+.)$",!<#%0$..)#?5 HNNG).?$$&%+-1=HIG O OOMQPH]A’A U$++$++$(($$E 0$"1$%&#%)9)%&>6$>")#B 4$.:*"))+"6)+.4>-6#Y !(4$.:*")$+,+"#*#0&’,9$>")46$>$+.-#A
8 7 6 5/4 3 2 1 0/.-,+*)(’&%()$&’%#$#!""!=>&+4&0<8.4.&"+&+8:;#&+9 0 8 7!6.0 2 4+5 3 0 2.+0&1/"!-.+,*,&’("$)*#+"#$%!29 A.5>=6.2.59 2.@+--+6&>2 2 6.2.59 2.@)(&’%#$+&4 0+-;.4?!(!’!&!%!$!#!"!!!*)(’&%$#"!*+*!#*+*!"*!#*+*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+**(*+**(*+**(*+**(*+**&*+**"*+**"*+**"!*+*!"*+*!"*+*!"*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+**(*+**(*+**’*+**’*+**&*+**!*+**!*+**$"*+*!"*+*!"*+*!"*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+**(*+**(*+**’*+**’*+**%**+**!*+**&#*+*!"*+*!"*+*!"*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+**(*+**(*+**’*+**’*+**%**+**!*+**&$*+*!#*+*!#*+*!#*+*!#*+*!"*+*!!*+*!!*+*!!*+*!!*+**)*+**)*+**(*+**)*+*#!*+*#!*+*#"*+*#&%*+*!"*+*!!*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+*!!*+**#*+**"*+**"*+*&%*+*$’*+*$’*+*$(*+*%#&*+*!"*+*!!*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+*!**+**#*+**"*+**#*+*&#*+*$&*+*$&*+*$’*+*%"’*+*!"*+*!!*+*!"*+*!!*+*!!*+*!!*+*!!*+*!!*+*!!*+**#*+**$*+**&*+*&’*+*$(*+*$(*+*%**+*%$(*+*!"*+*!!*+*!"*+*!!*+*!!*+*!!*+*!!*+*!"*+*!!*+*!**+**(*+**’*+*&%*+*%**+*%**+*%!*+*%%)*+*!"*+*!!*+*!"*+*!"*+**#*+**#*+**&*+**&*+!***+*)!*+*)"*+*)%*+!*(*+*)%*+*)%*+*)&*+!*!!**+*!"*+*!!*+*!"*+*!"*+**&*+**&*+**&*+*#’*+!*’*+!*#*+!*"*+!*$*+!!!*+*))*+*))*+!***+!*%!!*+*!"*+*!!*+*!"*+*!#*+**’*+**’*+*"’*+*$"*+!*#*+*))*+*)(*+!*!*+!!$*+!***+!***+!*"*+!*’!"*+*!!*+*!!*+*!!*+*!"*+**"*+*$%*+*#’*+**’*+!*%*+*)&*+*)(*+!***+!!"*+*))*+*))*+!***+!*%!#*+*!"*+*!!*+*!"*+*!#*+**&*+*$(*+*$**+*!**+!*)*+!***+!*!*+!*$*+!!#*+!*#*+!*#*+!*$*+!*)!$*+**(*+*!#*+**(*+!"!*+!!%*+!"**+!"**+!"**+!*(*+!*&*+!*#*+!*"*+!#%*+!!%*+!!%*+!!&*+!"!!%**+*!$*+*%$*+!!(*+!!!*+!!#*+!!$*+!!%*+!*)*+!*&*+!*"*+!*%*+!##*+!!(*+!!(*+!!)*+!"$!&*+*!$*+!$**+!#**+!*#*+!*%*+!*%*+!*$*+*)(*+!*)*+!*(*+!*%*+!*$*+!#!*+!!%*+!!%*+!!&*+!"!!’*+!$***+*%$*+!!(*+!!!*+!!#*+!!$*+!!%*+!*)*+!*&*+!*"*+!*%*+!##*+!!(*+!!(*+!!)*+!"$!($##"%""$65"1 0$+*’2)3"#"#$%&’("$)*#+,!$+$#&!!&)’75"1 0$+*’2)3"#"#$%&’("$)*#+,!#+$##&)*""-5"#%*#(+,"#$%&’("$)*#+,!"+$##"%""#65"3.4+1 2+-+./#*")(’%#0"#$%&’("$)*#+,!!+./0 1!-!,%#3"’/$%’0+7$1&’1 4)..+0)+$#7!%!)!*8"(.’)(#(’.)))").$1’*$",6(+$#7!%!)!#8".’%3#(’..#0)("’*$")5’+$#7!%!)!"8"+0 3")(#..#,$&).$1&’1 4)..+0 5&+$#$)&(("65"2)&")(4’#*$0"#$%&’("$)*#+,!%+..’3.’8!$+$#*$!#’&95"’1 4)3#0)%’,..’3.’0 0#*#+,8!#+$#*$!$!#95")("’2*$..$%0#0,..’3.’0 0#*#+,8!"+$#*$!$!!95""#(4)"*0’%#..’3.’0 0#*#+,8!!+$#*$!$*%95"9$%&#..’3.’0 0#*#+,8!*+$#7!%!)!$8"#!#’&&$59"9#%0$..)#)("’*$"’#*$0)"),6!(+$#%#%&’’;6"1.$<0#,)3%#/#&$..#%+,5!’+$#*$!#’%95"$(4#%+0)("’*$"’#*$0)"),6!&+$#!!&(’":8"(4$.;*")$+,+"#*#0&’,8!%+$#*$!#)(95"-’%�#*#+,1/@3C@?/F0 F
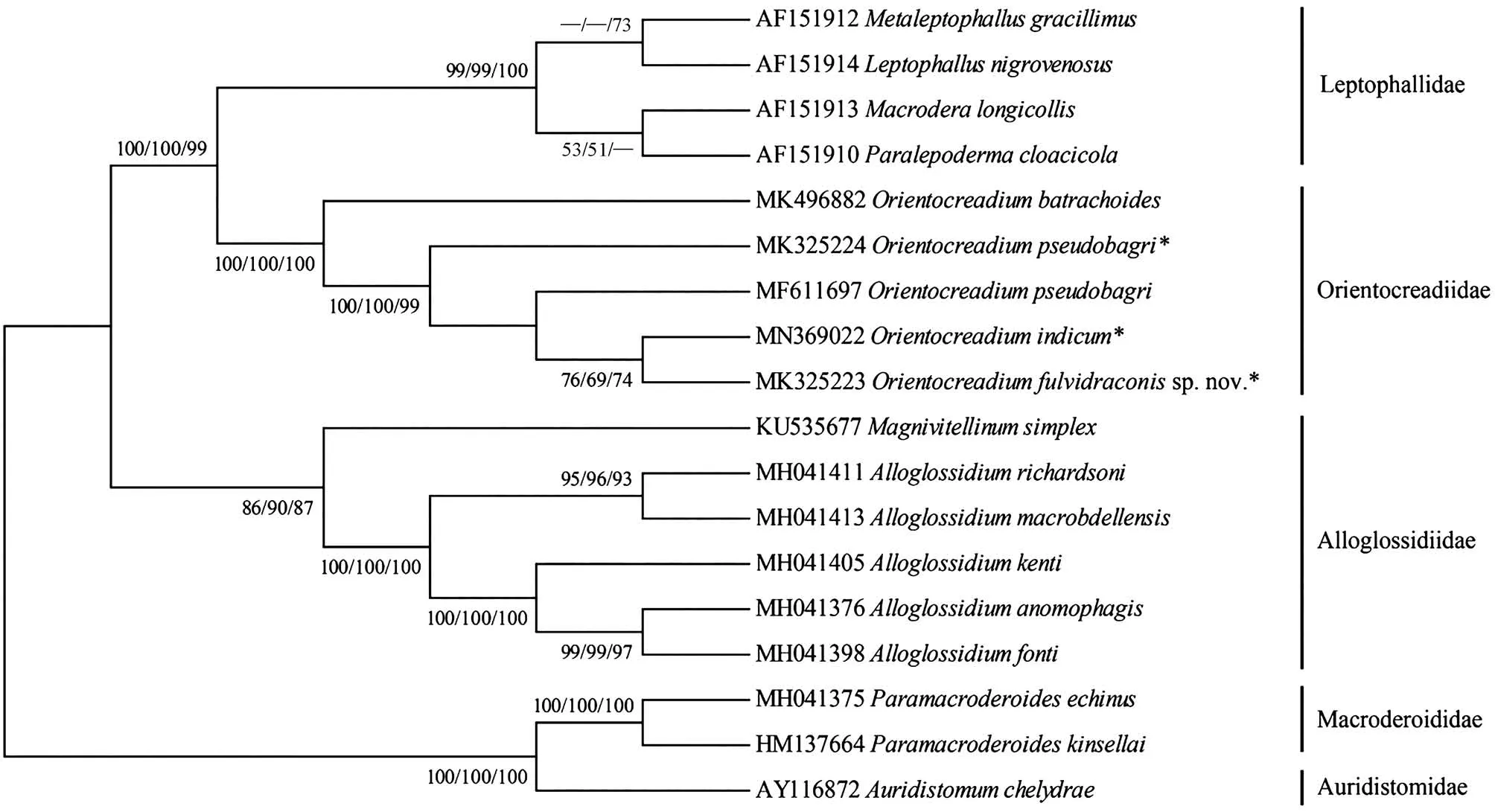
图4 基于28S rDNA部分序列,以邻接法、最大似然法和最大简约法构建的NJ拓扑结构50%多数一致树Fig.4 The rooted condensed tree of NJ/ML/MP analysis based on NJ tree topology constructed from 28S rDNA partial sequence
本研究结果支持Jones和Bray(2008)的形态学鉴定依据,并认同唐仲璋和林秀敏(1973)的观点,获得的3种东肌吸虫属物种隶属于斜睾总科中的东肌吸虫科。黄颡东肌吸虫虫体伸长,体表无棘,卵黄腺分布在卵巢前缘至后睾丸之后水平等,明显区别于属内其他物种,虽然O.lucknowensis体表也无棘,但其虫体较短,前咽缺失,卵黄腺从卵巢前缘水平分布至虫体末端等特征明显将二者区分。此外,O.pseudobagri卵黄腺内侧的输卵黄小管由晶格状细胞组成,汇合到卵黄总管,而在其他2种中不明显。Jones和Bray(2008)认为具晶格状细胞的输卵黄小管存在于未成熟的东肌吸虫属物种中。但在O.pseudobagri成体和未成熟虫体中均明显存在此晶格状细胞,而在其他2种的成体和未成熟虫体中均未发现此类细胞。据此,本研究认为晶格状卵黄管细胞的存在与虫体成熟程度无关,且可作为属内种鉴定依据。
由于目前GenBank中对于东肌吸虫科的分子数据较少,国内外的很多学者对其分类地位及系统发育方面的研究大多仅限于对其生活史和形态特征的研究。本研究首次获得了东肌吸虫属3种吸虫的28S rDNA部分序列,构建了斜睾总科5科9属17种吸虫的系统发育关系。系统发育结果显示 Orientocreadiidae与 Leptophallidae为姊妹群,2类吸虫存在密切的亲缘关系。Dayal(1938)最早注意到Orientocreadiidae在形态学上与Leptophallidae非常相似,它们之间密切的亲缘关系受其生活史中的共源性状所支持,如成虫均存在1个外贮精囊且子宫末段发达;尾蚴在子胞蚴体中形成囊蚴,排泄囊袋状等(Kim & Rim,1995;Tkach,2008)。Orientocreadiidae+Leptophallidae与Alloglossidiidae聚为一支,它们的成虫形态结构相似度较高,体现在虫体伸长,具咽,食道较短,阴茎囊发达,卵巢1个,睾丸2个,卵黄腺分布在虫体两侧,子宫内卵小且多,通常充满大部分后体,排泄囊Ⅰ型等特征,但Orientocreadiidae+Leptophallidae与Alloglossidiidae在生活史中没有共源性状,Alloglossidiidae的成虫不具外贮精囊且子宫末段不发达,幼虫为具眼点的单尾型尾蚴Ophthalmoxiphidio cercariae,排泄囊“Y”型,尾蚴在雷蚴体内发育等(Crawford,1937;Sirikantayakul,1985),推测二者间也存在较密切的亲缘关系。
本研究获得的黄颡东肌吸虫以高自举值在东肌吸虫科进化支中单独聚在了进化支的顶部,厘定了形态学的鉴定结果,同时可推测黄颡东肌吸虫可能是出现较晚的物种且与印度东肌吸虫亲缘关系近。同时在Sokolov和Shchenkov(2017)的研究基础上增加了东肌吸虫科的分子数据量,得到了一致的系统发育关系:东肌吸虫科为斜睾总科中一个独立的分类单元。
致谢:感谢云南省西双版纳环境监测站的王建军老师、云南师范大学生命科学学院的徐伟江老师在鱼类标本采集中给予的帮助。
