3D 打印切片盒在骨盆肿瘤边界三维定位中的应用初探
2020-11-30李小敏张少霆郝永强戴尅戎艾松涛
李小敏,曲 扬,武 文,赵 亮,张少霆,郝永强,戴尅戎,艾松涛
1. 上海交通大学医学院附属第九人民医院放射科,上海 200011;2. 上海交通大学医学院附属第九人民医院骨科,上海 200011; 3. 上海商汤智能科技有限公司,上海 200030
骨盆区恶性肿瘤是一种高致死率和致残率的骨肿瘤[1-2]。术前准确判定肿瘤边界对于确定截骨范围至关重要,有助于降低肿瘤局部复发和重建患肢功能[3-4]。磁共振成像(magnetic resonance imaging,MRI)因软组织分辨率高,是目前评估骨肿瘤浸润范围的主要手段。自1986 年Sundaram 等[5]首次报道骨肉瘤MRI 图像与术后病理图像相关性研究以来,诸多研究都证实了MRI 在评估肿瘤浸润范围中的重要价值[6-8]。然而,相关研究多是基于单一切面的影像与病理共定位研究,仍缺乏三维病理信息支持,成为骨肿瘤手术精准规划并进一步优化和发展的瓶颈。其中,如何实现术后病理图像和术前MRI 图像的精准共定位,尤其是对于巨大骨盆肿瘤,是开展相关研究的至关重要的一步。
随着3D 打印在医学领域的广泛应用[9-11],在影像和病理图像共定位研究方面,诸多学者展开一些探索,这些研究[12-16]主要集中于前列腺、脑、肾、肝等软组织疾病。上述切片模具是基于术前图像的分割建模模型。然而,骨盆肿瘤术前影像图像建立的肿瘤模型与术中切除标本间存在巨大的差异,相关经验并不能直接用于本研究。因而,本研究尝试通过骨盆肿瘤术前MRI/CT 图像与术后肿瘤标本CT 图像之间的配准,基于术后标本的形态设计病理切片盒,从而使术前MRI 的扫描方向同病理切片方向一致,探讨其应用于骨盆肿瘤共定位的可行性。
1 对象与方法
1.1 研究对象
本研究包括从2019 年7 月—2020 年7 月经活检证实患骨盆肿瘤的患者,患者均计划接受保肢切除术。纳入标准:①以骨盆或股骨肿瘤收治于上海交通大学医学院附属第九人民医院骨科。②术前已行CT 和MRI 增强检查,且T1 加权脂肪抑制增强序列有横断位和冠状位图像。③ 能够获得手术切除或穿刺手术病理结果的患者。排除标准:①骨盆腹腔内的肿瘤,图像伪影明显影响诊断。② 影像学成像方法不符合检查规范。③影像学检查方法缺项的 患者。本研究获得了上海交通大学医学院附属第九人民医院伦理审查委员会的批准(沪九院伦审2018-126-T104 号)。
1.2 影像检查与评估
患者术前行骨盆CT 平扫或双下肢CT 血管造影术(CT angiography,CTA,用于评估肿瘤与大血管关系)、骨盆增强MRI 和CT 胸部平扫(用于观察肺转移情况),患者术后切除的骨肿瘤标本行骨盆CT 平扫和MRI 检查,并以DICOM 格式保存CT 和MRI 数据。
CT 检查:128 排双源CT 机(西门子,德国,Somatom Definition FLASH)。扫描参数:管电压为120 kV,基准管电流与曝光时间乘积为333.0 mAs,探测器准直32 mm× 0.6 mm,螺距0.6,采用D30 重建算法(重建视野360 mm, 层厚1 mm,无间隔)。
MRI 检 查:3.0T MR 扫 描 仪( 西 门 子, 德 国,MAGNETOM Verio 3.0T MR)。扫描参数见表1。

表1 MRI 扫描参数Tab 1 MRI scanning parameters
1.3 3D 打印病理切片盒的设计与打印
1.3.1 数据建模 将患者术前薄层CT 扫描图像、术后肿瘤标本薄层CT 扫描图像的DICOM 数据导入SenseCare软件,对术前勾画肿瘤范围、术后切除肿瘤进行三维建模,输出为STL 文件。
1.3.2 CT、MRI 图像配准 将术后肿瘤标本三维建模数据和术前肿瘤CT 数据,以其共有的骨性特征作为互信息基础,结合手工标记方法,以术前CT 坐标系为基准进行领域特征点提取和匹配的点云配准,并结合刚体变换配准算法进一步约束,再将上述配准好的数据基于术前MRI数据进行配准[17]。
1.3.3 病理切片盒设计与打印 将上述配准后的骨盆肿瘤MRI 数据和骨盆肿瘤3D 模型数据导入到SenseCare 软件中,为其做拔模操作。使用编辑器工具设计病理切片时的引导槽。为防止切割引导槽中间的层面在切割时晃动,影响切片的准确性,在切片盒内部添加8 ~10 根细柱进行加固,最后将拔模处理后的切片盒导出为STL文件。用3D 打印机(联泰,中国,lite 450Hd)打印病理切片盒。具体方案:打印材料采用光敏树脂MED 610(Stratasys,以色列),全尺寸打印。
1.4 影像病理相关性分析
标本用10%甲醛固定后,按照骨组织延伸的方向放入切片盒内,采用病理大切片技术,使用骨组织病理切片机(EXAKT,德国,EXAKT 312 金刚石切骨机),按照3D 打印病理切片盒所设定的坐标系,将原始样本纵向片状精密切割,以便后期制片与其在体内的解剖方向相匹配,片状厚度≤5 mm,然后采用网状格分切标准样本,每个样本4.5 mm×4.5 mm 以内。采用15% EDTA 脱钙液进行骨组织脱钙,脱水浸蜡包埋后切片进行苏木精-伊红染色(hematoxylin-eosin staining,H-E staining)。切片制作完成后,使用病理数字化扫描仪进行数字化扫描,在数字化病理切片的最小分辨率上,将所有图像进行旋转、翻转、缩放、拉伸等操作后,完成整层病理图像拼接和三维层次配准及重建。在数字化病理切片的最大分辨率上,由病理医师进行病理分析,选定要分析的肿瘤区域获得靶向组织样本进行放射病理学分析。研究流程见图1。
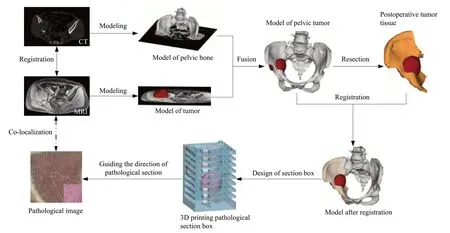
图1 影像病理对照研究Fig 1 Image-pathology control study
2 结果
2.1 患者临床基本资料
本研究共纳入骨盆肿瘤患者5 例,其中男性患者4 例,女性患者1 例。患者年龄26 ~65 岁,平均年龄(46.40±15.66)岁,其中良性1 例,恶性4 例;根据2013 版WHO 骨肿瘤新分型标准[18],骨软骨瘤1 例,软骨肉瘤3 例,浆细胞瘤1 例;根据Enneking 骨盆肿瘤分区方法,患者累及Ⅰ区1 例、累及Ⅰ+Ⅱ区2 例、累及Ⅰ+Ⅱ+Ⅲ区1 例,累及股骨患者1 例。所有患者均成功地接受了骨肿瘤切除术,并完全切除了骨肿瘤。术后骨肿瘤最大直径平均值为(13.96±2.42)cm。患者统计资料、肿瘤特征、手术数据及病理诊断见表2。
2.2 3D 打印病理切片盒验证

表2 患者临床资料Tab 2 Information of patients
通过SenseCare 软件成功重建骨盆肿瘤患者骨盆骨性结构和肿瘤软组织三维模型,以及设计个体化3D 打印病理切片盒。所有患者打印了患者特异性的个体化3D 打印病理切片盒。病理切片盒平均重约2 500 g,平均成本约为2 500 元(2 000 ~3 000 元)。研究纳入的5 例患者的肿瘤标本均能与3D 打印病理切片盒准确拟合。对于第1例患者(图2),术前MRI 图像对应层面(图2D)与术后肿瘤标本MRI 图像(图2E)相一致,为其创建的正方体的3D 打印病理切片盒(图2H),能贴合标本,并且不同病理层面肿瘤区域独特的肿瘤特征实现与相应MRI 层面共定位(图2J)。但正方体的3D 打印病理切片盒需要消耗大量的光敏树脂材料,打印成本会增加;此外,正方体的3D 打印病理切片盒壁厚,病理切割需要一定的时间。因此,改进实验设计,对于另外4 例患者,设计打印了贴合肿瘤轮廓的不规则形3D 打印病理切片盒(图3H),并对切片盒边缘进行圆滑处理,打印体积降低,打印成本大幅减少;其次,在保留切片盒一面壁平整的情况下减少了壁的厚度,使病理切割过程快速、便捷。
2.3 案例
患者,男性,35 岁,左髋部疼痛半年余,以“左侧股骨近端骨肿瘤”收治本院骨科。术前CT、MRI 增强检查示左侧股骨近端巨大肿瘤,股骨颈骨质成膨胀、侵袭样生长,肿瘤最大直径12.40 cm;患肢远端运动、感觉、循环正常。骨盆CT、MRI 数据导入SenseCare 软件,重建骨盆CT 图像骨性结构和MRI 图像软组织结构,结合患者胸部CT 平扫图像,评价病变范围,术前规划手术切除范围,并生成骨肿瘤三维模型,导出STL 文件。手术切除后骨肿瘤标本CT、MRI 数据导入SenseCare 软件,与术前影像数据配准,设计个体化3D 打印病理切片盒并打印。将固定好的骨肿瘤标本放入病理盒中,进行切片染色,病理结果为软骨源性肿瘤,细胞轻度异型,符合软骨肉瘤Ⅰ级。特定肿瘤区域组织样本放射病理学分析如图3 所示。术后肿瘤标本MRI 图像(图3J)与术前患者MRI 图像对应层面(图2K)相一致。不同病理层面肿瘤区域独特的肿瘤特征实现与相应MRI 层面共定位(图2J)。在图4中,骨肿瘤按照骨组织延伸的方向放入切片盒内,因切片盒内头端(图4C)和尾端(图4B)骨性结构,骨肿瘤在切片盒内受到限制,实现骨肿瘤与切片盒的精确贴合,保证术后组织在切片盒中定位的准确性。
3 讨论
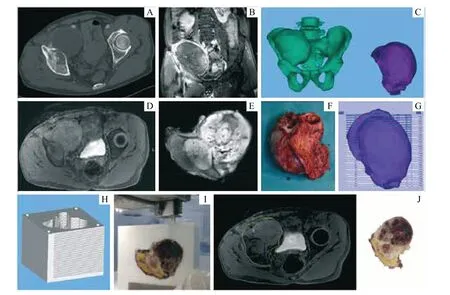
图2 3D 打印病理切片盒病理切片流程图Fig 2 Pathological section diagram of 3D printing pathological section box
术前准确判定肿瘤边界是实施骨盆肿瘤精准手术切除的基础,而病理学信息是衡量影像判定边界是否准确的依据。在既往骨肿瘤影像与病理对照的共定位研究中,研究者多选择最大病理切面同影像图像比较,这种特定面点对点的对比,获取的病理信息有限,而且不能实现病理图像与相应的影像图像对应。目前,已有学者应用3D 打印技术制作切片盒,以实现MRI 图像与病理切片三维图像的准确配准[19-20]。关于使用3D 打印病理切片盒进行MRI 与组织病理学相关性的报道主要局限于前列腺等小的软组织标本。Costa 等[21]报道了体内MRI 图像和体外前列腺标本的配准,使用患者特异性MRI 衍生的病理切片盒切片与常规包埋切片相比,前列腺内部结构的配准也得到了改善,包括周边区、移行区、肿瘤轮廓的勾画。其次,也有学者在脑、肝脏以及肾脏组织结构方面开展了相关的研究[12-14],并对于提升病理标本和术前影像成像的一致性开展了一定的探索,然而这些研究中用于病理切片盒设计的影像数据是术前肿瘤影像图像分割建模的结果,而肿瘤术后切除标本除了肿瘤本身,还带有部分正常组织,影响切除标本与病理切片盒的拟合程度,进而影响影像与病理共定位的准确性。

图3 典型病例的3D 打印病理切片盒在骨肿瘤边界的应用Fig 3 Application of 3D printing pathological section box to typical cases in the boundary of bone tumor

图4 3D 打印病理切片盒与骨肿瘤标本的拟合程度的CT 图像Fig 4 CT images of fitting degree of 3D printing pathological section box and bone tumor specimen
本研究提出的创新病理切片盒,根据体外CT/MRI 成像与体内CT/MRI 成像配准后图像设计而成。切片盒定义了特定的切片平面,与MRI 扫描层的骨肿瘤方向和位置相同,将配准问题从3D 问题简化为2D 问题。骨肿瘤组织可以固定在切片盒内,以支持骨肿瘤的病理检查,而不改变它,并有助于组织切片后续配准到体内MRI。我们设计的独特之处包括允许将组织固定在切片盒中,以保持其体内形状,一个边缘光滑处理的外部形状,适合CT/MRI扫描。切片盒所具有的坐标系,为精确的样本定位提供指导。这种改进的病理切片盒设计提供了在固定后或固定前使用高分辨率体外CT/MRI 扫描切片盒内骨肿瘤的可能性,从而获得与体内MRI 具有相同方向和位置的相应体外CT、体外MRI 和组织切片。这为解决各种研究问题提供了许多可能。
本研究基于3D 打印的患者特异性病理切片盒,将同一骨盆肿瘤的MRI 特征与组织病理学特征相关联。首先,薄层体外CT 图像可作为组织学图像和体内MRI 图像配准的中间参考图像。基于领域特征点提取和匹配的的点云配准并结合刚体变换配准算法剔除错误点对的匹配,以实现最佳配准[17]。高细节的肿瘤标本体外CT 图像很容易与基于切片盒的体内MRI 图像进行配准,为指导组织学切片与体内MRI 的非刚性配准提供了一套丰富的影像特征。其次,利用高三维分辨率和对比度的CT扫描切片盒内骨肿瘤,可以验证切片盒配准的基本假设。再次,切片盒允许在肿瘤区域收集目标组织样本,这些区域在体内表现出特定的特征,如不同的血流、水扩散率或脂肪含量。此外,定量MRI 技术与患者特异性3D 肿瘤病理图像的结合为基于客观定量成像和组织数据的放射组学、放射基因组学分析、纹理分析和机器学习算法提供了新的机会[22-24]。
本研究还具有一定的局限性。首先,研究中所设计的3D 打印病理切片盒的打印成本通常为2000 元~3000 元不等,而模型打印时间需12 ~14 h。研究相关的成本和时间会随着3D 打印技术的进步节省和缩短。其次,术后组织形变影响配准的准确性。研究所采用的图像配准方法可对领域特征点提取和匹配,并对标本手术体积损失和轴向平面方向进行补偿,具有较高的准确性;研究通过在MRI 图像上显示术后CT 图像骨性结构轮廓,观察2 次配准间的效果,从最大限度上减小所带来的影响。再次,共定位研究的准确性受术中的形变、组织固定后组织的变形和收缩、切片技术等诸多因素的影响。研究所探究的骨盆肿瘤中的骨组织具有天然支撑作用,可以在一定程度保证术前术后结构的相似性。
综上所述,本研究提出了一种依据骨盆肿瘤的CT/MRI 间图像配准的方法设计特异性3D 打印病理切片盒的解决方案,该方案可保证术前MRI 扫描方向与术后病理切片方向的一致性,从而实现骨盆肿瘤组织病理学信息在体内MRI 图像中的协同定位。研究将为术前MRI 图像判定和骨盆肿瘤边界准确性评估提供有力工具,并随着纳入病例的增加和组织病理信息的完善,最终为揭示骨盆肿瘤边界MRI 信号的表现特点以及肿瘤的浸润生长状态提供坚实的数据支持,从而进一步规范骨盆肿瘤诊疗过程,提升骨盆肿瘤患者预后。
参·考·文·献
[1] 汤小东, 郭卫. 骨盆原发恶性肿瘤的切除与重建[J]. 中华外科杂志, 2008, 46(12): 904-907.
[2] Eilber FR, Grant TT, Sakai D, et al. Internal hemipelvectomy: excision of the hemipelvis with limb preservation. An alternative to hemipelvectomy[J]. Cancer, 1979, 43(3): 806-809.
[3] Jin T, Deng ZP, Liu WF, et al. Magnetic resonance imaging for the assessment of long bone tumors[J]. Chin Med J, 2017, 130(21): 2547-2550.
[4] Putta T, Gibikote S, Madhuri V, et al. Accuracy of various MRI sequences in determining the tumour margin in musculoskeletal tumours[J]. Pol J Radiol, 2016, 81: 540-548.
[5] Sundaram M, McGuire MH, Herbold DR, et al. Magnetic resonance imaging in planning limb-salvage surgery for primary malignant tumors of bone[J]. J Bone Jo Surg Am Vol, 1986, 68(6): 809-819.
[6] 喻紫晨, 肖兢, 徐海声. 四肢骨肉瘤患者的治疗及预后分析[J]. 实用癌症杂志, 2014, 29(2): 199-201.
[7] Kim TK, Choi BI, Park SW, et al. Gadolinium mesoporphyrin as an MR imaging contrast agent in the evaluation of tumors[J]. Am J Roentgenol, 2000, 175(1): 227-234.
[8] 上官景俊, 徐文坚, 李文, 等. 骨肿瘤与瘤样病变周围组织影像表现分析[J]. 中华放射学杂志, 2011, 45(5): 463-467.
[9] 曲扬, 艾松涛, 杨飞, 等. CT 和MRI 图像配准融合联合3D 打印技术在难治性骨盆肿瘤术前规划中的应用[J]. 上海交通大学学报(医学版), 2017, 37(9): 1238-1244.
[10] 曲扬, 艾松涛, 武文, 等. 3D 打印个体化导板在骨肿瘤经皮穿刺活检中的初步应用[J]. 上海交通大学学报(医学版), 2018, 38(9): 1053-1058.
[11] Bastawrous S, Wake N, Levin D, et al. Principles of three-dimensional printing and clinical applications within the abdomen and pelvis[J]. Abdom Radiol, 2018, 43(10): 2809-2822.
[12] Dwivedi DK, Chatzinoff Y, Zhang Y, et al. Development of a patient-specific tumor mold using magnetic resonance imaging and 3-dimensional printing technology for targeted tissue procurement and radiomics analysis of renal masses[J]. Urology, 2018, 112: 209-214.
[13] Absinta M, Nair G, Filippi M, et al. Postmortem magnetic resonance imaging to guide the pathologic cut: individualized, 3-dimensionally printed cutting boxes for fixed brains[J]. J Neuropathol Exp Neurol, 2014, 73(8): 780-788.
[14] Trout AT, Batie MR, Gupta A, et al. 3D printed pathological sectioning boxes to facilitate radiological-pathological correlation in hepatectomy cases[J]. J Clin Pathol, 2017, 70(11): 984-987.
[15] Baldi D, Aiello M, Duggento A, et al. MR imaging-histology correlation by tailored 3D-printed slicer in oncological assessment[J]. Contrast Media Mol Imaging, 2019, 2019: 1071453.
[16] Mikhail AS, Mauda-Havakuk M, Partanen A, et al. Liver-specific 3D sectioning molds for correlating in vivo CT and MRI with tumor histopathology in woodchucks (Marmota monax)[J]. PLoS One, 2020, 15(3): e0230794.
[17] Jauer P, Kuhlemann I, Bruder R, et al. Eきcient registration of high-resolution feature enhanced point clouds[J]. IEEE Trans Pattern Anal Mach Intell, 2019, 41(5): 1102-1115.
[18] 王朝夫, 朱雄增. 第4 版WHO 骨肿瘤分类解读[J]. 中华病理学杂志, 2013, 42(10): 652-654.
[19] Priester A, Wu H, Khoshnoodi P, et al. Registration accuracy of patient-specific, three-dimensional-printed prostate molds for correlating pathology with magnetic resonance imaging[J]. IEEE Trans Biomed Eng, 2019, 66(1): 14-22.
[20] Wu HH, Priester A, Khoshnoodi P, et al. A system using patient-specific 3D-printed molds to spatially align in vivo MRI with ex vivo MRI and wholemount histopathology for prostate cancer research[J]. J Magn Reson Imaging, 2019, 49(1): 270-279.
[21] Costa DN, Chatzinoff Y, Passoni NM, et al. Improved magnetic resonance imaging-pathology correlation with imaging-derived, 3D-printed, patientspecific whole-mount molds of the prostate[J]. Investig Radiol, 2017, 52(9): 507-513.
[22] Do BH, Langlotz C, Beaulieu CF. Bone tumor diagnosis using a naïve Bayesian model of demographic and radiographic features[J]. J Digit Imaging, 2017, 30(5): 640-647.
[23] Huang L, Xia W, Zhang B, et al. MSFCN-multiple supervised fully convolutional networks for the osteosarcoma segmentation of CT images[J]. Comput Methods Programs Biomed, 2017, 143: 67-74.
[24] Zhang R, Huang L, Xia W, et al. Multiple supervised residual network for osteosarcoma segmentation in CT images[J]. Comput Med Imaging Graph, 2018, 63: 1-8.
