人工听觉脑干植入在先天性耳聋低龄儿童中的应用探索
2020-11-30张治华李静洁陈见清谭皓月汪照炎
贾 欢 ,陈 颖 ,张治华 ,李静洁,李 蕴 ,陈见清 ,李 孛 ,谭皓月 ,汪照炎 ,吴 皓
1. 上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海200011;2. 上海交通大学医学院耳科学研究所,上海市耳鼻疾病转化医学重点实验室,上海200125;3. 上海交通大学医学院附属第九人民医院麻醉科,上海200011
目前,人工耳蜗植入(cochlear implantation,CI)是极重度感音神经性耳聋患儿最常用的听力重建手段,但是据统计仍有3.2%~7.0%的极重度耳聋患儿因耳蜗严重畸形或蜗神经发育不良而无法接受CI[1-2]。对此类患儿,人工听觉脑干植入(auditory brainstem implantation,ABI)是目前唯一的听觉重建手段。ABI 是通过植入脑干耳蜗核的电极直接刺激耳蜗核的听觉神经组织,产生有意义的听觉。
ABI 诞生于1970 年,起初是为神经纤维瘤病Ⅱ型(neurofibromatosis type 2,NF2)患者重建听力所设计的,因为这些患者都存在蜗神经的严重受损[3-4]。逐渐地,ABI适应证也包含了成人非NF2 所致严重内耳、蜗神经病变,如双侧耳蜗骨化、双侧颞骨骨折或内耳畸形的患者[5]。鉴于ABI 手术难度高及风险大,ABI 自2001 年起才开始在儿童中进行,目前全球已有超过300 例儿童患者接受ABI手术[6-13],结果证实长期使用ABI 可明显改善患儿的言语功能。但患儿如果存在发育迟缓等其他问题,会影响ABI植入效果。中国香港已经开展了儿童ABI 手术[14],但中国内地尚无儿童行ABI 的报道,仅有5 例NF2 成人患者接受了ABI 手术,最小年龄为24 岁[15]。近期上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科开展了低龄儿童ABI 手术,手术均顺利完成,患儿听觉重建效果良好,特此报道。
1 对象与方法
1.1 研究对象
纳入2019 年1 月—4 月期间于上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科行ABI 手术的双侧极重度感音神经性聋患儿连续病例,且均小于36 月龄。上述患儿术前通过病史资料收集,听力学、影像学及全身情况综合评估,经多学科团队讨论后判断符合ABI 的适应证。患儿的手术记录、手术录像、术后听力学及影像学结果予以收集分析。本研究经上海交通大学医学院附属第九人民医院伦理委员会批准,患儿家属均签署知情同意书。
1.2 听力学评估
术前评估包括鼓室图测试(Madsen 公司,中耳分析仪Zodiac)、畸变产物耳声发射(distortion product otoacoustic emission,DPOAE;Madsen 公司,耳声发射分析仪Capella)、听性脑干诱发电位测试(auditory brainstem response,ABR;Neurosoft 公 司, 听 力 筛 查 仪Neuro- Audio)、多频听觉稳态诱发反应(multiple auditory steadystate evoked responses, ASSR;Neurosoft 公司,听力筛查仪Neuro-Audio)、行为测听等,以及婴幼儿有意义听觉整合量表(Infant-Toddler Meaningful Auditory Integration Scale,IT-MAIS)、听觉行为分级(Categories of Auditory Performance,CAP)、有意义使用言语量表(Meaningful Use of Speech Scale,MUSS)、言语可懂度分级(Speech Intelligibility Rating,SIR)等评估工具,以明确其双耳听力下降程度和类型,及患儿的听觉、言语能力。术后评估在开机时,开机后2 周、3 个月、6 个月及12 个月左右,主要包括IT-MAIS、CAP、MUSS、SIR,以及患儿助听下平均听阈(pure tone average, PTA)(ABI 装置调试最优条件下的行为测听)。
1.3 影像学评估
患儿术前均行薄层高分辨率颞骨CT 扫描(层厚0.6 mm)、内 听 道MRI 平 扫[ 含 层 厚1 mm 的CISS(constructive interference in steady state) 或FIESTA(fast imaging employing steady-state acquisition)序列],辨别耳蜗、前庭、半规管、内听道、面神经、后组颅神经、第四脑室等形态;明确蜗神经状态、内耳畸形类型及程度,同时排除其他颅内病变,并评估手术风险。
1.4 ABI 装置及配件
本研究采用Med-El Concerto ABI 植入体(奥地利Med-El)。体内植入部分包括刺激器、带有磁铁的线圈和电极阵列。电极阵列为一椭圆形的扁平硅胶片(长5.5 mm,宽3.0 mm,厚0.6 mm),具有12 个电极和1 个参考电极。电极阵列被覆一片预塑形的聚酯网,以适合弯曲的大脑表面。体外机与Concerto 同系列人工耳蜗植入体配套件一致,采用高清晰度连续间隔采样编码策略(high definition continuous interleaved sampling,HDCIS)。此外,为方便术中测试电诱发听性脑干反应(electrically evoked auditory brainstem response,eABR),Med-El 公司额外提供一个仅含4 个电极的测试电极,可连接于配套的刺激盒。
1.5 ABI 手术方法
患儿行全身麻醉后采用平卧位,头转向植入侧的对侧,连接eABR 监测电极至诱发电位仪,连接面神经、舌咽神经、舌下神经、迷走神经监测电极至肌电仪。行耳后C 形切口,切开皮肤及皮下组织,做一个蒂位于下方(胸锁乳突肌)的肌骨膜瓣,于切口后上方制备植入体骨床。定位乙状窦切迹,于其后方磨开3.0 cm×3.0 cm 骨窗,距乙状窦后方、横窦下方1 ~2 mm 处切开硬脑膜,轻下压小脑后,缓慢释放脑脊液,于桥小脑角处辨认面听神经(如存在)及后组颅神经,追踪舌咽神经至进入脑干处,暴露该处绒球和脉络丛。定位第四脑室外侧隐窝、脑干耳蜗核位置,先将ABI 测试电极植入,行eABR 测试,根据电生理反应调整电极。确认电极理想位置后,植入正式ABI 电极,再次行eABR 测试,进一步调整电极位置至最佳。若电极位置确定,用生物蛋白胶固定电极阵列及其导线,植入体放置于骨窗后上方的骨床内,随后水密缝合脑膜,严密缝合肌骨膜瓣、皮下组织及皮肤。
1.6 ABI 开机过程
在ABI 植入后1.5 ~2 个月,患儿在手术室全身麻醉状态下进行ABI 预开机,利用eABR 逐个刺激12 个电极,记录各个电极引出eABR 波形的最小刺激阈值,并观察电极的非听觉反应,即是否出现呼吸心率变化、眼球震颤、面肌痉挛及肢体异常活动等。次日,患儿在清醒状态下,根据预开机的最小刺激阈值、电极不良反应情况,进行各电极调试。开机时先开引出明确听觉电生理波形的电极,若无明显不适反应,尽量打开波形不明确和未引出的电极,设定各电极的最小刺激阈值及最大舒适阈,同时观察患儿是否出现非听觉反应。
2 结果
2.1 患儿一般情况及术前评估
本研究一共纳入4 例患儿,其中3 例男孩,1 例女孩,ABI 植入时为17 ~36 月龄,平均(26.3±7.8)月龄。4 例患儿在新生儿听力筛查时均双侧未通过,出生时否认窒息史、黄疸史、感染史及早产史,术前4 例患儿ABR 双侧鼓室图均为A 型,双侧click 气导>97 dBnHL,骨导>45 dBnHL,DPOAE 未引出,ASSR 示各频率均>90 dBnHL。4 例患儿颞骨CT 结果显示,1 例27 月龄男孩为双侧共同腔畸形,3 例患儿为双侧Michel 畸形(耳蜗未发育)。4 例患儿内听道MRI 结果均显示双侧蜗神经未发育。4 例患儿在ABI 术前均未佩戴过助听器,家长诉对外界声音刺激无反应,行为测听示各频率点均未引出听觉行为反应。IT-MAIS、CAP、MUSS 量表均为0 分,SIR 量表均为1 分。
2.2 手术结果、术中各电极反应及术后情况
4 例患儿均在全身麻醉下实施右侧ABI 手术(图1),手术麻醉时间为(435.0±44.2)min,手术操作时间为(354.4±31.7)min(皮肤切口至缝合完毕),手术径路实施时间为(104.3±16.0)min,测试电极放置、调整、调试时间为(68.9±23.2)min,正式电极放置、调整、调试时间为(100.8±20.2)min,切口关闭时间(80.4± 4.1)min。术中出血5 ~15 mL,手术开始时血红蛋白为(101.8±11.9) g/L,术毕时为 (110.3±5.7) g/L。术中电极阵列所选择电极的听觉电生理波形引出率为(91.0± 10.8)%。术后患儿均回普通病房,且无持续高热、厌食等不良反应,无脑脊液切口漏、鼻漏、切口感染等发生。

图1 ABI 手术流程Fig 1 ABI procedure
2.3 术后预开机及开机情况
预开机对12 个电极进行电刺激时,4 例患儿均未出现呼吸、心率改变,眼球震颤,及面部抽搐等不良反应。电极听觉电生理波形引出率为(79.3±15.8)%,检测电极与术中测试一致率为74%。次日清醒开机时,仅1 例患儿在打开9 和12 号电极时出现身体前倾,因此暂时关闭电极。其余电极按照预开机时的情况进行最小刺激阈值及最大舒适阈的设定,未见不良反应。开机时4 例患儿的激活电极数为(8.5±1.0)个,开机12 个月后为(10.0±1.6)个(表1)。
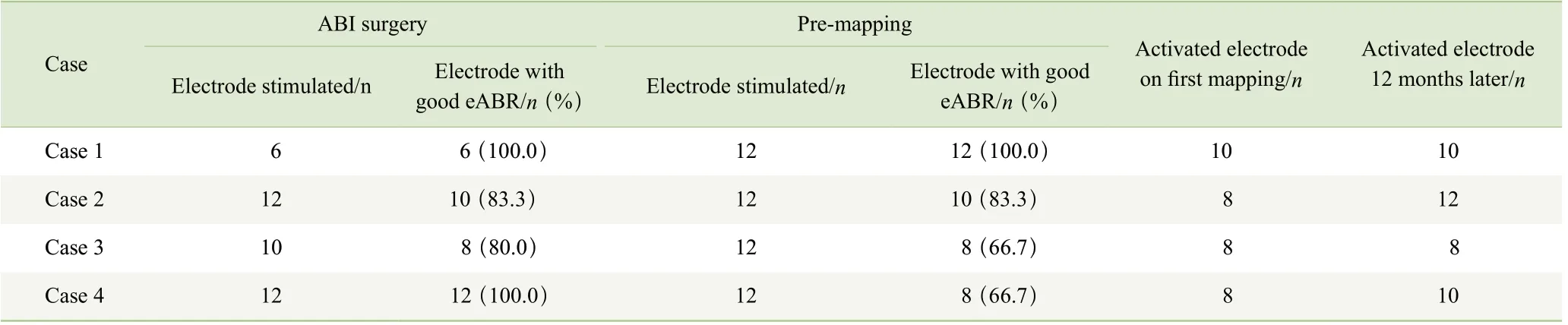
表1 4 例患儿的术中、预开机时eABR 情况及激活电极情况Tab 1 Number of electrodes with good eABR during surgery and pre-mapping, and activated electrode numbers in 4 patients
2.4 术后听觉及言语发育情况
4 例患儿开机后,随着ABI 佩戴时间的延长,ITMAIS、CAP、MUSS、SIR 量表得分,以及助听听阈均较术前有明显改善,并逐步提升;开机12 个月后4 例患儿IT-MAIS 得分为(31.5±1.7)分,CAP 为(4.3±0.8)分,MUSS 为(14.5±3.7)分,SIR 为2.0 分(图2),助听下PTA 为(38.8±5.9)dBHL(图3)。

图2 4 例患儿开机后量表得分变化情况Fig 2 Scales scores over time in four children after the first mapping

图3 4 例患儿开机后助听听阈变化情况Fig 3 Aided audiogram over time in four children after the first mapping
3 讨论
ABI 是目前内耳严重畸形或蜗神经发育不良等因素致极重度耳聋的最有效听力重建手段。该手术的核心区域位于脑干,需要术者具有耳外科、神经外科的丰富经验,而低龄儿童的生理解剖特点又使得手术团队需要对小儿颅脑手术、围手术期的诊疗有扎实的基础。因此,在第1 例成人ABI 手术后很长一段时间才在儿童中开展手术,美国食品药品监督管理局对于ABI 年龄适应证批准也经历了10 余年才从“18 岁以上”降至“12 月龄以上”[1,9-10,16]。本组4 例患儿的成功手术及开机证实了我国小儿ABI 水平已达到国际水平,也为后继该技术的进一步开展奠定了基础。
由于脑干蜗核位于第四脑室外侧隐窝,因此ABI 手术径路主要采用迷路径路或乙状窦后径路。虽然乙状窦后径路在探寻第四脑室外侧隐窝时难度更大(需要下压小脑、视角更倾斜),但综合考虑到迷路径路毗邻中耳、乳突,需要封闭咽鼓管或鼓窦,且内耳的解剖异常可能会导致面神经走形的变异等,因此本组病例均采用乙状窦后径路,所有患儿无术后颅内感染、脑脊液漏发生,且出血量少。这一方式也是目前公认的适用于非肿瘤性患者ABI 手术的首选径路[10]。我们认为,严格的水密性缝合脑膜能良好预防术后脑脊液漏。对于ABI 电极穿过脑膜处,因局部缝合较为困难,可辅以肌肉填塞脑膜缝合不紧密处。
ABI 电极的精确放置是其良好听觉重建的基础。由于接受ABI 的患儿多伴随蜗神经未发育或发育不良,脑干蜗核有时难以通过毗邻关系来精准定位,因此通过术中eABR 辅助确认蜗核位置已是一种常用技术[11,13,17]。本组患儿均先采用测试电极进行蜗核的精准定位,不过由于侧颅底神经外科手术室通常有较多仪器,如显微镜、神经监护仪、电钻、电凝等,易对诱发电位测试造成干扰,因此术中eABR 检测仍较为耗时,本研究中测试电极调试时间基本都超过1 h。而对于正式电极,因其电极数量较测试电极多,所以需时更久。考虑到整体手术时间的控制,若前期手术时间过长,在正式电极测试时可酌情减少电极测试数量,只需确保电极阵列边缘的电极反应良好即可。由于ABI 电极的术中测试会延长手术时间,也有学者认为可以跳过ABI 测试电极调试,直接进行正式电极的调试,以缩短手术时间。但直至目前,测试电极的使用与否仍根据术者的习惯,尚无有关其利弊的科学定论。本研究中,术中各电极eABR 的反应与术后预开机时反应基本一致,可说明不同深度的麻醉或镇静对eABR 干扰不大,与文献结果相同[12];同时术中eABR 的检测能有助于开机时各电极最佳参数的预设[13]。但植入术中若某电极未引出eABR 波形并不意味着该电极开机时不能产生听觉反应[18-20],电极听觉电生理波形引出率与术后听觉重建的关系、预开机时及植入术中的eABR 与术后听觉重建的关系仍待进一步研究。
本研究中4 例患儿均于植入后1.5 ~2 个月进行第1次开机。由于植入电极的刺激靶点毗邻其他颅神经脑干核团等,因此局部的电刺激可能引起一些非听觉感觉,例如眩晕、四肢或舌部刺痛感,甚至可能出现心跳骤停等生命体征改变[21]。同时,考虑到电极在精确放置后有潜在移位的可能(如小脑组织受压后回复、缝合脑膜时对电极导线的牵拉等),因此第1 次开机应慎重地在手术室内进行,以便良好辨识各电极状态,并能够及时处理非听觉反应的不良后果。本组患儿在预开机时均未出现客观不良反应,仅1 例在开机时有2 个电极刺激可诱发身体前倾等前庭反射反应,但在暂时关闭电极数月后再激活时未再次出现该反应,此后这2 个电极均正常激活。
系统回顾研究表明,接受ABI 手术的非肿瘤性患儿的听觉、言语能力在术后均可逐渐进步:CAP 得分在2 年后 基本稳定,5 年后约50%的患儿可达4 分以上;而MAIS/IT-MAIS 得分基本在1 年左右稳定[9]。本组患儿虽然随访时间较短,但同期的听觉重建效果基本与其一致,说明ABI 已使这些患儿重获听觉、言语得到发育。关于儿童ABI 与CI 术后效果的比较,本团队前期曾对28 例3 岁以下单侧CI 患儿开机后IT-MAIS、CAP、MUSS 和SIR 量表进行分析,其术后12 个月得分分别为(35.2±3.8) 分、(4.7± 0.5)分、(5.0±5.9) 分、(1.4±0.6) 分[22]。鉴于ABI和CI 手术适应证不同,且本研究中ABI 例数较少、随访时间较短,因此目前较难比较两者的听力重建效果差异。另外,ABI 对于我国内地市场尚属新技术,后续本团队将 继续扩大样本量及延长随访时间,进行更详细的疗效分 析。
参·考·文·献
[1] Kaplan AB, Kozin ED, Puram SV, et al. Auditory brainstem implant candidacy in the United States in children 0-17 years old[J]. Int J Pediatr Otorhinolaryngol, 2015, 79(3): 310-315.
[2] Bamiou DE, Worth S, Phelps P, et al. Eighth nerve aplasia and hypoplasia in cochlear implant candidates: the clinical perspective[J]. Otol Neurotol, 2001, 22(4): 492-496.
[3] Edgerton BJ, House WF, Hitselberger W. Hearing by cochlear nucleus stimulation in humans[J]. Ann Otol Rhinol Laryngol Suppl, 1982, 91(2 Pt 3): 117-124.
[4] Wu H, Kalamarides M, Bouccara D, et al. Auditory brainstem implant (Nucleus 21-channel) in neurofibromatosis type 2 patients previously operated on: preliminary results[J]. Adv Otorhinolaryngol, 2000, 57: 236-239.
[5] Merkus P, Di Lella F, Di Trapani G, et al. Indications and contraindications of auditory brainstem implants: systematic review and illustrative cases[J]. Eur Arch Otorhinolaryngol, 2014, 271(1): 3-13.
[6] Colletti L, Shannon RV, Colletti V. The development of auditory perception in children after auditory brainstem implantation[J]. Audiol Neurotol, 2015, 19(6): 386-394.
[7] Sennaroglu L, Ziyal I, Atas A, et al. Preliminary results of auditory brainstem implantation in prelingually deaf children with inner ear malformations including severe stenosis of the cochlear aperture and aplasia of the cochlear nerve[J]. Otol Neurotol, 2009, 30(6): 708-715.
[8] Raghunandhan S, Madhav K, Senthilvadivu A, et al. Paediatric auditory brainstem implantation: the South Asian experience[J]. Eur Ann Otorhinolaryngol Head Neck Dis, 2019, 136(3S): S9-S14.
[9] Noij KS, Kozin ED, Sethi R, et al. Systematic review of nontumor pediatric auditory brainstem implant outcomes[J]. Otolaryngol Head Neck Surg, 2015,153(5): 739-750.
[10] Sennaroglu L, Colletti V, Manrique M, et al. Auditory brainstem implantation in children and non-neurofibromatosis type 2 patients: a consensus statement[J]. Otol Neurotol, 2011, 32(2): 187-191.
[11] Anwar A, Singleton A, Fang YX, et al. The value of intraoperative EABRs in auditory brainstem implantation[J]. Int J Pediatr Otorhinolaryngol, 2017, 101: 158-163.
[12] Wong K, Kiringoda R, Kanumuri VV, et al. Effect of anesthesia on evoked auditory responses in pediatric auditory brainstem implant surgery[J]. Laryngoscope, 2020, 130(2): 507-513.
[13] Polak M, Colletti L, Colletti V. Novel method of fitting of children with auditory brainstem implants[J]. Eur Ann Otorhinolaryngol Head Neck Dis, 2018, 135(6): 403-409.
[14] Sung JKK, Luk BPK, Wong TKC, et al. Pediatric auditory brainstem implantation: impact on audiological rehabilitation and tonal language development[J]. Audiol Neurotol, 2018, 23(2): 126-134.
[15] Zhou QY, Yang ZJ, Wang ZM, et al. Awake craniotomy for assisting placement of auditory brainstem implant in NF2 patients[J]. Acta Otolaryngol, 2018, 138(6): 548-553.
[16] House Research Institute. FDA approves clinical trial of auditory brainstem implant procedure for children in U.S.[EB/OL]. [2020-09-01]. https://www.sciencedaily.com/releases/2013/01/130122101334.htm.
[17] Lachowska M, Pastuszka A, Miko ajewska L, et al. Detailed insight in intraoperative eABR measurements to assist auditory brainstem implantation in a patient with neurofibromatosis type 2[J]. Acta Neurol Belg, 2019. DOI: 10.1007/s13760-019-01248-7.
[18] O'Driscoll M, El-Deredy W, Atas A, et al. Brain stem responses evoked by stimulation with an auditory brain stem implant in children with cochlear nerve aplasia or hypoplasia[J]. Ear Hear, 2011, 32(3): 300-312.
[19] O'Driscoll M, El-Deredy W, Ramsden RT. Brain stem responses evoked by stimulation of the mature cochlear nucleus with an auditory brain stem implant[J]. Ear Hear, 2011, 32(3): 286-299.
[20] Anwar A, Singleton A, Fang YX, et al. The value of intraoperative EABRs in auditory brainstem implantation[J]. Int J Pediatr Otorhinolaryngol, 2017, 101: 158-163.
[21] Colletti V, Shannon RV, Carner M, et al. Complications in auditory brainstem implant surgery in adults and children[J]. Otol Neurotol, 2010, 31(4): 558-564.
[22] Chen Y, Huang MP, Li B, et al. Bimodal stimulation in children with bilateral profound sensorineural hearing loss: a suitable intervention model for children at the early developmental stage[J]. Otol Neurotol, 2020. DOI: 10.1097/MAO.0000000000002812.
