刺山柑总生物碱对系统性硬皮病小鼠Wnt3a/β-catenin表达的影响*
2020-11-28卢军何承辉阿依提拉麦麦提江康小龙
卢军,何承辉,阿依提拉·麦麦提江,康小龙
(1.新疆医科大学附属中医医院 药物研究室,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区药物研究所 药剂室,新疆 乌鲁木齐 830004)
系统性硬皮病的病理表现为多组织、多器官纤维化,免疫系统失衡及血管异常[1]。刺山柑为白花菜科山柑属植物,系新疆道地药材。刺山柑果实乙醇提取物对成纤维细胞增殖和Ⅰ型胶原的合成有一定抑制作用[2]。硬皮病模型小鼠的胶原沉积、真皮增厚等病理改变可被刺山柑流浸膏抑制[3]。给硬皮病小鼠外用刺山柑乙酸乙酯和乙醇提取物后,小鼠真皮增厚,Ⅰ型胶原、转化生长因子-β1过表达被抑制[4]。刺山柑总生物碱系本课题组从刺山柑中提取的有效成分,前期研究表明,将刺山柑总生物碱制成乳膏给系统性硬皮病小鼠外用后,小鼠皮肤增厚、纤维化等情况有所改善[5],同时羟脯氨酸及Ⅰ、Ⅲ型胶原过表达被逆转[6-7],提示刺山柑总生物碱可抑制系统性硬皮病胶原合成,改善组织纤维化。本实验观察刺山柑总生物碱对Wnt 通路相关蛋白Wnt3a、Wnt1 诱导的信号通路蛋白1(WISP1)和β-连环蛋白(β-catenin)的影响,研究其对系统性硬皮病Wnt/β-catenin 通路的调控作用。
1 材料与方法
1.1 实验动物
雌性BALB/c 小鼠90 只,体重18 ~22 g,购自北京维通利华实验动物公司,实验动物生产许可证号:SCXK(京)2016-0006。
1.2 实验药物
刺山柑原药材(新疆麦迪森维药饮片厂),刺山柑乳膏(新疆医科大学附属中医医院药物研究室自制)盐酸博莱霉素注射剂(批号:17001711,上海瀚晖制药有限公司),青霉胺片(批号:052160901,上海上药信谊药厂)。
1.3 试剂
β-catenin 抗体、goat anti-rabbit IgG-HRP 购自美国Cell Signaling 公司,SABC 免疫组织化学染色试剂盒、小鼠WISP1 ELISA 试剂盒购自武汉博士德生物工程有限公司,高纯总RNA 快速提取试剂盒、SYBR real-time PCR 试剂盒购自北京百泰克生物技术有限公司,小鼠Wnt3a ELISA 试剂盒购自武汉华美生物公司,蛋白测定试剂盒(BCA 法)购自江苏碧云天生物公司。
1.4 仪器
酶标仪(型号:Multiskan Spectrum)、低温离心机(型号:Multifuge X1R)购自美国Thermo Fisher 公司,显微镜(型号:LEICA DFC360 FX)、切片机(型号:LEICA RM2245)购自德国Leica 公司,实时定量PCR 仪(型号:C1000 Thermal Cycler)购自美国Bio-Rad 公司。
1.5 方法
1.5.1 小鼠系统性硬皮病模型的复制及给药方法BALB/c 小鼠90 只随机分为6 组:空白对照组、系统性硬皮病模型组(SSc 模型组)、刺山柑总生物碱低剂量组(225 mg/kg)、刺山柑总生物碱中剂量组(450 mg/kg)、刺山柑总生物碱高剂量组(900 mg/kg)及青霉胺组(125 mg/kg),每组15 只。剃除小鼠背部中央区被毛,除空白对照组背部皮下注射生理盐水外,其余各组皮下注射盐酸博莱霉素复制系统性硬皮病模型[8-9]:30 μg/d×30 d,然后各给药组小鼠背部外敷刺山柑乳膏,青霉胺组小鼠给予青霉胺灌胃,1 次/d×60 d。
1.5.2 小鼠皮肤组织Wnt3a 和WISP1 浓度的检测未次给药4 h 后处死小鼠,取小鼠背部皮肤用组织匀浆机研磨成10%组织匀浆,离心(4 000 r/min,10 min),ELISA 试剂盒测定上清液中Wnt3a 和WISP1 的浓度,ELISA 结果用上清液中总蛋白浓度(BCA 蛋白定量试剂盒检测)进行校正。
1.5.3 实时荧光定量聚合酶链反应(qRT-PCR)检测小鼠皮肤组织β-catenin mRNA 表达未次给药4 h 后处死小鼠,取小鼠背部皮肤,液氮迅速冷冻10 min,置入-80℃冰箱冷冻保存。采用高纯总RNA 快速提取试剂盒(离心柱型)提取组织总RNA,操作按试剂盒说明书进行,逆转录获到cDNA,设计特异性β-catenin 引物,β-catenin 正向引物为5'-GATTACTGCTCTGGCTCCTAGC-3',反向引物为5'-GACTCATCGTACTCCTGCTTGC-3';内参照Rn18s 正向引物为5'-CTATTTTGGTTTTCGGAACTGAG-3',反向引物为5'-TTGGCAAATGCTTTCGCTCTG-3'。采用2-△△Ct法计算mRNA 相对表达,即相对表达量=2-△△Ct,△Ct=Ct目标基因-Ct内参基因,△△Ct=△Ct实验组-△Ct对照组。
1.5.4 免疫组织化学法检测小鼠皮肤组织β-catenin蛋白表达未次给药4 h 后处死小鼠,取小鼠背部注射区皮肤,4%多聚甲醛中固定、脱水、包埋、切片。脱蜡,放入柠檬酸钠液中,微波修复5 min,用3%H2O2封闭20 min,磷酸盐缓冲液(PBS)冲洗,β-catenin一抗4℃孵育过夜,二抗室温孵育1 h,DAB 染色后用苏木精复染。显微镜摄片后输入计算机,Image-Pro Plus 6.0 专业图像分析软件对图片进行分析,求得积分光密度与组织面积的比值即平均光密度,各组平均光密度与空白对照组平均光密度的比值作为β-catenin的相对表达量。
1.6 统计学方法
数据分析采用SPSS 11.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Wnt3a 和WISP1 浓度的比较
各组小鼠皮肤组织Wnt3a 和WISP1 浓度比较,差异有统计学意义(P<0.05);SSc 模型组Wnt3a和WISP1 较空白对照组升高(P<0.05);刺山柑总生物碱中剂量组Wnt3a 较SSc 模型组降低(P<0.05);刺山柑总生物碱各剂量组、青霉胺组WISP-1与SSc 模型组比较差异无统计学意义(P>0.05)。见表1。
2.2 β-catenin mRNA 相对表达量比较
各组小鼠皮肤组织β-catenin mRNA 相对表达量比较,差异有统计学意义(P<0.05);SSc 模型组较空白对照组升高(P<0.05),刺山柑总生物碱中剂量组、高剂量组及青霉胺组较SSc 模型组降低(P<0.05);刺山柑总生物碱中剂量组、高剂量组与青霉胺组比较,差异无统计学意义(P>0.05)。见表2和图1。
表1 各组小鼠皮肤组织Wnt3a 和WISP1 浓度比较(n =15,±s)
注:①与空白对照组比较,P <0.05;②与SSc 模型组比较,P <0.05。
组别 Wnt3a/(pg/mg) WISP1/(ng/mg)空白对照组 182.79±47.05 1.32±0.36 SSc 模型组 293.17±59.66① 2.02±0.40①刺山柑总生物碱低剂量组 300.73±46.77 1.93±0.32刺山柑总生物碱中剂量组 245.77±56.09② 1.89±0.35刺山柑总生物碱高剂量组 269.84±44.64 2.11±0.44青霉胺组 274.84±39.48 2.00±0.50 F 值 11.336 7.499 P 值 0.000 0.000
2.3 β-catenin 蛋白相对表达量比较
免疫组织化学实验结果显示,各组小鼠皮肤组织β-catenin 蛋白相对表达量比较,差异有统计学意义(P<0.05);SSc 模型组较空白对照组升高(P<0.05);刺山柑总生物碱各剂量组及青霉胺组较SSc 模型组降低(P<0.05);刺山柑总生物碱各剂量组与青霉胺组比较,差异无统计学意义(P>0.05)。见表3和图2、3。
表2 各组小鼠皮肤组织β-catenin mRNA 相对表达量比较 (n =15,±s)

表2 各组小鼠皮肤组织β-catenin mRNA 相对表达量比较 (n =15,±s)
注:①与空白对照组比较,P <0.05;②与SSc 模型组比较,P <0.05。
组别 β-catenin mRNA 相对表达量空白对照组 1.00±0.00 SSc 模型组 2.50±0.39①刺山柑总生物碱低剂量组 2.30±0.40刺山柑总生物碱中剂量组 1.71±0.46②刺山柑总生物碱高剂量组 1.81±0.46②青霉胺组 1.37±0.39②F 值 10.620 P 值 0.000
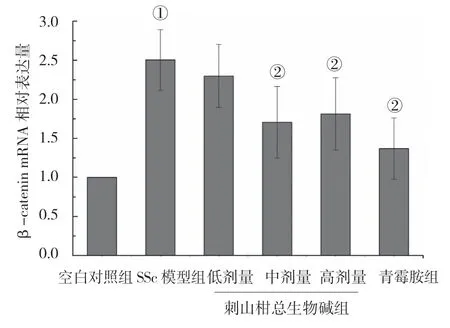
图1 小鼠皮肤组织β-catenin mRNA 相对表达量比较(±s)
表3 各组小鼠皮肤组织β-catenin 蛋白相对表达量比较(n =15,±s)
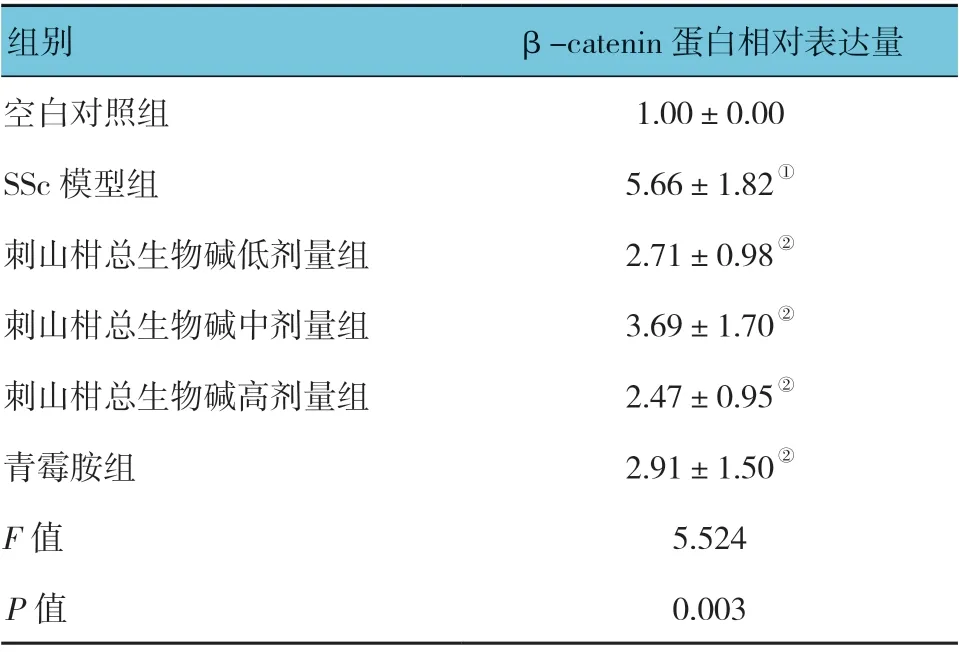
表3 各组小鼠皮肤组织β-catenin 蛋白相对表达量比较(n =15,±s)
注:①与空白对照组比较,P <0.05;②与SSc 模型组比较,P <0.05。
组别 β-catenin 蛋白相对表达量空白对照组 1.00±0.00 SSc 模型组 5.66±1.82①刺山柑总生物碱低剂量组 2.71±0.98②刺山柑总生物碱中剂量组 3.69±1.70②刺山柑总生物碱高剂量组 2.47±0.95②青霉胺组 2.91±1.50②F 值 5.524 P 值 0.003
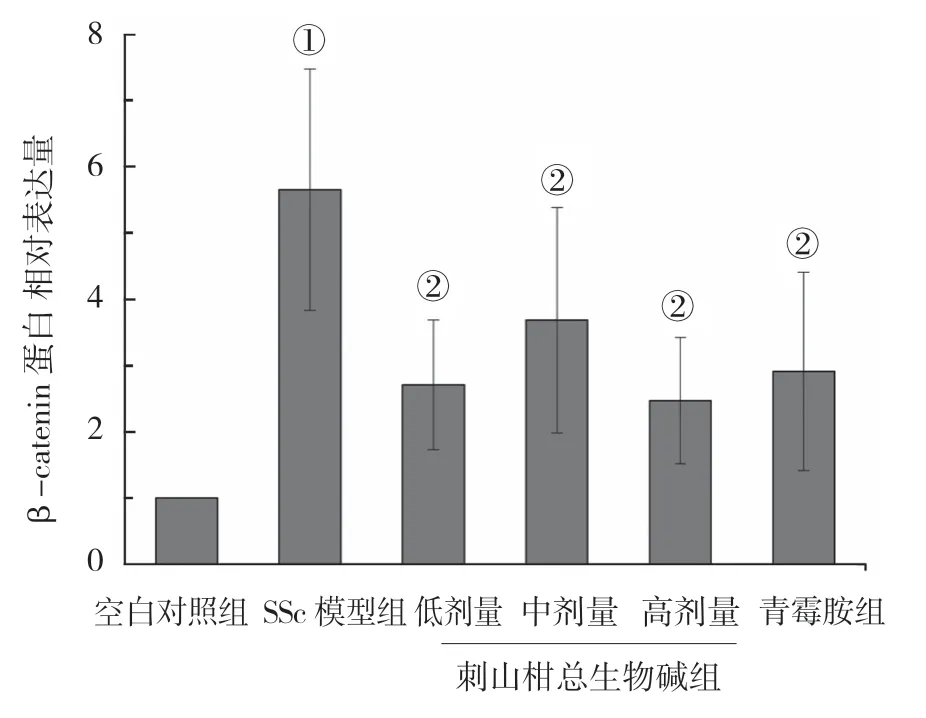
图2 小鼠皮肤组织β-catenin 蛋白相对表达量比较(±s)
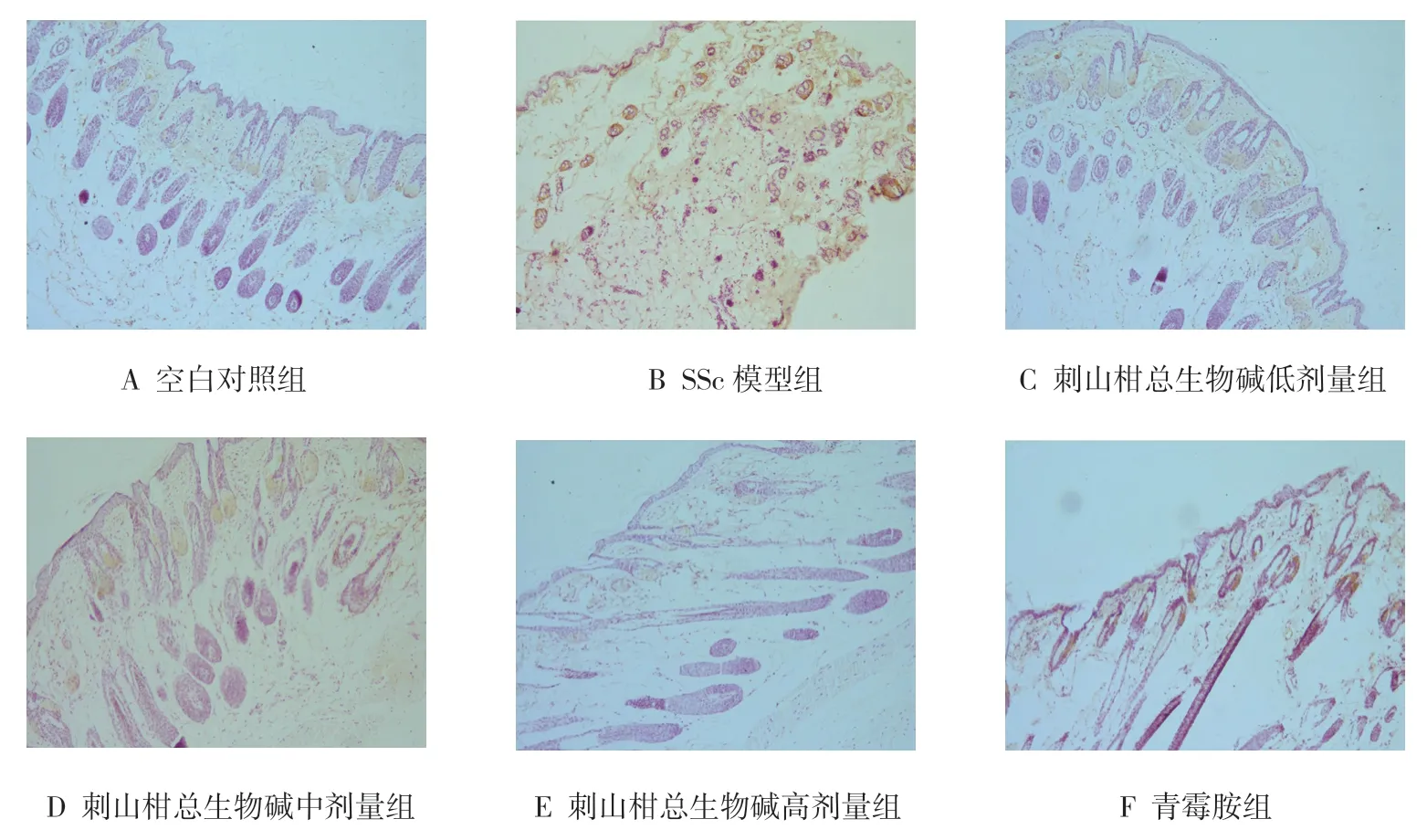
图3 小鼠皮肤组织β-catenin 蛋白表达情况 (免疫组织化学×100)
3 讨论
系统性硬皮病呈现多组织、多器官进行性纤维化,其病因与成纤维细胞异常增殖,胶原、纤维连接蛋白等细胞外基质(extracellular matrix, ECM)过度合成并沉积有关[10-11]。Wnt/β-catenin 信号通路是成纤维细胞持续活化的关键途径之一,在肺、皮肤等器官纤维化进程中起重要作用[12]。研究表明,在系统性硬皮病皮肤和肺组织成纤维细胞中Wnt/β-catenin 通路被激活,β-catenin 水平升高,导致系统性硬皮病成纤维细胞中β-catenin 蓄积,细胞核内β-catenin 水平升高使目标基因转录增加,引起系统性硬皮病组织纤维化[13-15]。Wnt3a 是Wnt 通路中的重要配体,WEI 等[16]和BAYLE 等[17]研究表明,Wnt3a/β-catenin 通路过度激活,可引起系统性硬皮病患者皮肤成纤维细胞增殖,ECM 合成增加,异常增多的Wnt3a 与受体结合激活β-catenin 可引发系统性硬皮病组织纤维化,是因为后者可活化成纤维细胞向肌成纤维细胞转分化,使ECM合成增多。本研究发现,SSc 模型组小鼠皮肤Wnt3a和β-catenin 表达升高,与上述研究结果一致;刺山柑总生物碱450 mg/kg 可降低系统性硬皮病小鼠皮肤Wnt3a的浓度;450 mg/kg和900 mg/kg可降低β-catenin mRNA 和蛋白表达,提示刺山柑总生物碱对系统性硬皮病Wnt/β-catenin 信号通路的过度激活有一定抑制作用。
WISP1,又名CCN4,是Wnt/β-catenin 下游靶蛋白,有研究表明,多组织器官的纤维化过程都与WISP1水平的异常升高有关[18]。本实验发现,WISP1 在SSc模型组小鼠皮肤组织表达升高,提示WISP1 可能参与系统性硬皮病皮肤纤维化的形成;刺山柑总生物碱组WISP1 表达与SSc 模型组差异无统计学意义,提示刺山柑总生物碱可能不会改变系统性硬皮病小鼠WISP1的异常升高。
