皮肤鳞状细胞癌和基底细胞癌组织中VEGF、COX-2及ID-1的表达及临床意义
2020-11-28黄林陈江艳
黄林,陈江艳
(重庆市江津区中心医院 1.皮肤科,2.肿瘤科,重庆 402260)
鳞状细胞癌(squamous cell carcinoma, SCC)及基底细胞癌(basal cell carcinoma, BCC)是皮肤恶性肿瘤中最常见的亚型,近年来发病率逐年升高,需要引起高度重视[1]。SCC、BCC 的发病早期无明显临床表现,当出现特异性改变时往往已处于中晚期,极易贻误有效治疗时机。同时,SCC 与BCC 的治疗方法存在差异,且早期鉴别诊断较困难。因此,寻求疾病的早期诊断方法有利于鉴别诊断并及时进行针对性治疗,从而提升预后质量。皮肤SCC、BCC 形成的重要环节是新生血管的形成,既往研究表明,血管内皮生长因子(vascular endothelial growth factor, VEGF)、环氧化酶-2(Cyclooxygenase-2, COX-2)及分化抑制因子-1(Inhibitor of DNA differentiation-1, ID-1)等可能对新生血管存在加速效应,对SCC、BCC 的形成具有促进作用[2]。本研究检测VEGF、COX-2 及ID-1 在皮肤SCC、BCC 中的表达,以探讨其临床意义和应用前景,现报道如下。
1 资料与方法
1.1 临床资料
选取2016年3月—2019年3月重庆市江津区中心医院收治的皮肤恶性肿瘤患者76 例,SCC 组和BCC 组均38 例。其中,男性62 例,女性34 例;年龄30 ~73 岁,平均(63.64±6.30)岁。纳入标准:①恶性肿瘤经病理检查确诊;②临床资料完整且随访完成;③与患者进行详细沟通并签署知情同意书。排除标准:①已接受放疗等其他影响本研究的治疗;②受身体条件限制不适合研究或不配合研究;③存在心、肺等严重器官衰竭的症状。采用配对的方式选取30 例无恶性肿瘤的同期皮肤移植患者为对照组。SCC 组及BCC组的组织取材部位包括头皮、面部、四肢等,对照组的组织来源于皮肤移植的剩余材料。3 组患者的性别构成比、平均年龄比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会批准备案。
1.2 方法
1.2.1 试剂和仪器兔抗人VEGF、COX-2、ID-1抗体购自英国Abcam 生物有限公司,磷酸盐缓冲液(PBS)、辣根过氧化物酶(HRP)、十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)购自北京科展生物科技有限公司,RT-PCR 仪、Invitrogen 凝胶成像系统购自美国赛默飞世尔科技有限公司。

表1 两组患者术前基线资料的比较
1.2.2 免疫组织化学检测VEGF、COX-2 及ID-1的阳性表达率[3]对皮肤组织进行包埋、切片、脱蜡及抗原修复处理。一抗选用兔抗人VEGF、COX-2、ID-1 抗体,采用PBS 稀释,PBS 作为对照。二抗选用羊抗兔多克隆抗体,采用HRP 稀释,染色后封存处理。光学显微镜下细胞内检测出棕色颗粒为VEGF、COX-2 及ID-1 阳性表达。
1.2.3 RT-PCR 检测VEGF、COX-2 及ID-1 mRNA的表达[4-5]对皮肤组织提取总RNA,行RT-PCR 检测。具体步骤:96℃预变性5 min,92℃变性2 min,55℃退火30 s,75℃延伸3 min;重复25 个循环获取PCR 产物。此后行电泳分离,并利用Invitrogen 凝胶成像系统对电泳各条带进行平均灰度值的测定,并与标准条带(β-actin)进行比较,以其比值作为mRNA表达的评价标准。
1.2.4 Western blotting 法 检 测VEGF、COX-2 及ID-1 的蛋白相对表达量[6-7]PBS 缓冲液冲洗皮肤组织,加入裂解液500 μl,低温15 000 r/min 离心3 min,留取上清液。加入SDS-PAGE 并转膜,封闭后在低温环境加入VEGF、COX-2 及ID-1 的一抗,摇床过夜后加入二抗,随后进行洗膜和显色以检测蛋白表达。以β-actin 为标准蛋白,测定VEGF、COX-2及ID-1 蛋白表达的绝对值及与标准蛋白的比值,以降低研究误差。
1.3 统计学方法
数据分析采用SPSS 26.0 统计软件,计量资料以均数±标准差(±s)表示,多组间的比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料采用例(%)表示,比较采用χ2检验和χ2分割法;相关性分析采用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组VEGF、COX-2 及ID-1 阳性表达的比较
3 组VEGF、COX-2 及ID-1 的阳性表达见图1~3。3 组VEGF、COX-2 及ID-1 的阳性表达比较,差异有统计学意义(P<0.05);进一步两两比较,SCC组与BCC 组高于对照组(P<0.05);SCC 组高于BCC组(P<0.05)。见表2。

图1 3 组VEGF 的表达 (SP×200)

图2 3 组COX-2 的表达 (SP×200)
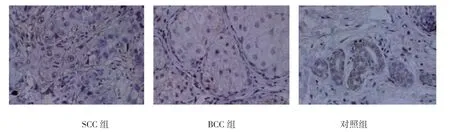
图3 3 组ID-1 的表达 (SP×200)
2.2 3 组VEGF、COX-2 及ID-1 mRNA 及蛋白表达的比较
3 组VEGF、COX-2 及ID-1 mRNA 及蛋白表达的比较,差异有统计学意义(P<0.05);进一步两两比较,SCC 组与BCC 组高于对照组(P<0.05);SCC组高于BCC 组(P<0.05)。见表3、4 和图4、5。
2.3 SCC 组及BCC 组中VEGF、COX-2 及ID-1表达的相关性
对SCC组及BCC组中VEGF、COX-2 及ID-1的表达进行相关性分析,结果表明:VEGF 与COX-2呈正相关(r=0.353,P=0.027),VEGF 与ID-1 呈正相关(r=0.395,P=0.015),COX-2 与ID-1 呈正相关(r=0.437,P=0.007)。

表2 3 组VEGF、COX-2 及ID-1 阳性表达的比较例(%)
表3 3 组VEGF、COX-2 及ID-1 mRNA 表达的比较(±s)

表3 3 组VEGF、COX-2 及ID-1 mRNA 表达的比较(±s)
注:①与对照组比较,P <0.05;②与BCC 组比较,P <0.05。
组别 n VEGF mRNA COX-2 mRNA ID-1 mRNA SCC 组 38 0.93±0.13①② 0.71±0.10①② 0.92±0.12①②BCC 组 38 0.54±0.10① 0.62±0.12① 0.63±0.11①对照组 30 0.23±0.08 0.40±0.09 0.18±0.08 F 值 241.033 8.690 8.648 P 值 0.000 0.009 0.009
表4 3 组VEGF、COX-2 及ID-1 蛋白表达的比较 (±s)

表4 3 组VEGF、COX-2 及ID-1 蛋白表达的比较 (±s)
注:①与对照组比较,P <0.05;②与BCC 组比较,P <0.05。绝对值为蛋白水平,比值为蛋白水平与标准蛋白β-actin 水平的比值。
VEGF COX-2 ID-1绝对值 比值 绝对值 比值 绝对值 比值SCC 组 38 9.26±2.49 6.47±0.24①② 0.78±0.05①② 3.39±0.28①② 0.47±0.06①② 5.59±0.23①② 0.68±0.09①②BCC 组 38 9.33±2.27 4.96±0.22① 0.62±0.08① 2.48±0.27① 0.38±0.04① 4.11±0.21① 0.55±0.10①对照组 30 9.25±2.34 3.57±0.10 0.41±0.06 1.34±0.25 0.24±0.05 2.25±0.19 0.34±0.09 F 值 0.012 462.577 82.393 275.372 139.424 552.684 31.068 P 值 0.978 0.000 0.000 0.000 0.000 0.000 0.000组别 n β-actin(标准值)

图4 3 组VEGF、COX-2 及ID-1 mRNA 的表达
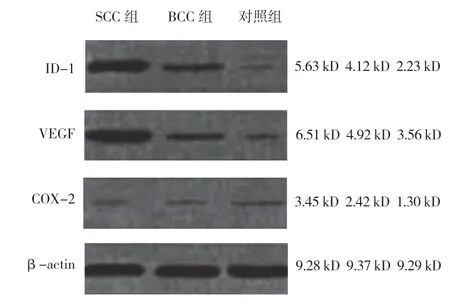
图5 3 组VEGF、COX-2 及ID-1 蛋白的表达
3 讨论
SCC 与BCC 是皮肤科常见的难治性恶性肿瘤,其发病机制复杂,与多基因改变相关,且早期无特异性表现,当疾病确诊时往往已处于恶化的中晚期,不利于及时治疗及预后恢复[8-9]。因此,SCC 与BCC 的早期诊断较困难,需要研究预测其早期特异性改变的指标,以达到早期诊治、改善预后的目的[10-11]。
肿瘤增殖及转移过程的重要促进因素是新生血管的形成。VEGF 具有较好的促血管作用,可促进血管的新生并提升其通透能力,因此通过检测VEGF 水平可以较准确地预测肿瘤血管状况[12-13]。既往研究表明,在肺癌、十二指肠癌等多种恶性肿瘤中,VEGF 均呈高表达,且其成分与肿瘤的侵袭性具有相关关系[14-15]。COX-2 在炎症反应的发生与发展中发挥重要作用,另外,还参与肿瘤进展的多个重要环节,包括新生血管生成、诱导增殖并阻滞凋亡等;因此COX-2 可见于多种肿瘤[16-17]。ID 属于螺旋-环-螺旋(HLH)反式作用因子家族,可通过与碱性HLH 蛋白(bHLH)结合而抑制蛋白的分化转录[18-19]。既往基因组学研究表明,ID-1 可通过体内多种信号传导通路对癌细胞的发生、进展及凋亡过程产生干预,可特异性阻滞癌细胞周期,阻滞细胞增殖并诱导其凋亡,与体内原癌基因的效果类似[20]。
本研究结果表明,3 组VEGF、COX-2 及ID-1 的阳性表达率、mRNA 及蛋白表达的差异有统计学意义;SCC 组与BCC 组均高于对照组;SCC 组均高于BCC 组。以上结果与KARSTEN 等学者[21]的研究结果类似。
本研究对VEGF、COX-2 及ID-1 在SCC、BCC及对照组的表达水平进行检测,结果表明其变化规律类似,具有共同的表达趋势,可能存在相关关系,共同对疾病进行调节。为此本研究进一步对SCC 组及BCC 组中VEGF、COX-2 及ID-1 表达的相关性进行分析,结果表明,VEGF、COX-2 及ID-1 3 者之间的表达均呈正相关。可见VEGF、COX-2 及ID-1 联系密切,采用联合检测的手段有利于SCC、BCC 疾病的精确诊断,尤其对早期诊断具有重要的临床意义[22-23]。
本研究结果提示VEGF、COX-2 及ID-1 的表达存在协同效应。在疾病诊断中可考虑检测VEGF、COX-2 及ID-1 以对肿瘤恶性程度和进展能力进行有效评估,尤其适宜用于早期诊断。治疗中可考虑通过阻滞ID-1 的表达过程和活化VEGF 以抑制肿瘤新生血管的生成,可能对干预肿瘤的细胞周期、阻滞肿瘤的进展具有一定作用[24]。这一点有待于长时程、大样本量的临床研究。
综上所述,皮肤SCC 与BCC 的发生、发展与VEGF、COX-2 及ID-1 的高表达有关,且3 者的表达呈正相关,有利于促进肿瘤新生血管的形成并诱导转移。因此,联合检测VEGF、COX-2 及ID-1 的表达对皮肤SCC 与BCC 具有重要的早期诊断意义,同时阻滞其表达通路有利于抑制疾病的进展,具有较好的临床意义。
