益生菌对促进肠道发育作用的研究进展
2020-11-27关嘉琦李柏良焦雯姝李慧臻岳莹雪史佳鹭霍贵成
关嘉琦,李柏良,焦雯姝,李慧臻,岳莹雪,李 娜,史佳鹭,赵 莉,霍贵成
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
人与动物的肠道是一个营养丰富的环境,由大量复杂的微生物聚集而成,其中包括大量益生菌。益生菌是定植在宿主体内,可改变宿主某一部位菌群组成的一类对宿主有益的活性微生物;其是通过调节宿主黏膜与系统免疫功能或通过调节肠道内菌群平衡,促进营养吸收保持肠道健康的作用,从而产生有利于宿主健康作用的单一微生物或组成明确的混合微生物[1]。近年来,人们对益生菌功能的研究日益深入,有关益生菌对宿主的作用、益生菌调节肠道生理功能、益生菌与肠道黏膜免疫关系、益生菌在调节肠道微生态菌群平衡中的作用等方面已有大量相关综述报道,而关于益生菌通过影响肠道细胞增殖、肠道屏障成熟而促进肠道发育及其作用机制则成为日前研究新热点。研究表明,某些双歧杆菌的胞外蛋白、益生菌代谢产物丁酸及其盐类[2]、益生菌细胞壁中肽聚糖的水解产物胞壁酰二肽(muramyldipeptide,MDP)[3]等可参与维持肠道良好形态、干预肠道细胞增殖分化、调节肠道上皮紧密连接的合成,从而促进肠道成熟、修复应激损伤[4]。越来越多的研究表明,益生菌在动物早期肠道发育、免疫系统分化、上皮细胞增殖等肠道生长发育过程中发挥作用[5]。例如,Suo Cheng等从婴儿粪便中分离得到植物乳杆菌(Lactobacillus plantarum)ZJ316,发现其可以提高断奶仔猪回肠、空肠和十二指肠绒毛高度;停止Lactobacillus plantarum ZJ316处理1 周后,十二指肠绒毛高度和空肠隐窝深度显著增加,这表明Lactobacillus plantarum ZJ316可促进仔猪的肠道生长发育[6]。王世杰等通过动物实验证实,生长发育早期应用副干酪乳杆菌(Lactobacillus paracasei)N1115可促肠上皮细胞增殖分化,使紧密连接结构完整、正常发挥肠道黏膜作用[7]。杨凤娟等发现灌喂罗伊氏乳杆菌(Lactobacillus reuteri)I5007的新生仔猪十二指肠绒毛高度显著提高,肠上皮细胞紧密连接蛋白的表达上调[8]。基因水平的研究表明,一些乳酸菌如植物乳杆菌(Lactobacillus plantarum)MB452,可使编码Occludin和细胞骨架等基因的表达量发生改变[9]。Resta-Lenert等研究发现,嗜酸乳杆菌(Lactobacillus acidophilus)和嗜热链球菌(Streptococcus thermophilus)可提高磷酸肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)信号分子通路、胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)活力,上调Occludin和ZO-1蛋白磷酸化表达量,增强Caco-2、HT-29细胞的屏障功能[10]。由此可见,肠道内益生菌对于动物肠道发育具有积极的调控作用。
1 益生菌对肠道发育的干预机制
肠是成年哺乳动物自我更新最快的组织,在小鼠体内,肠道上皮在3~5 d内即完成自我更新[11]。肠道上皮由隐窝和绒毛组成[12],是构成黏膜层的主要部分。肠腔结构如图1所示[13],隐窝柱状细胞散布在肠隐窝的潘氏细胞之间,位于4位置的标记保留细胞是较不活跃的干细胞。肠道干细胞(intestinal stem cells,ISCs)可自我更新或生成瞬时扩增(transit amplifying,TA)细胞,再增殖分化为不同种类的肠上皮细胞[14]。肠上皮是实现机体对抗原的免疫抵抗、营养物质的消化吸收、完成首过代谢等的场所,其稳态由许多因素共同维持,例如肠内营养、干细胞巢、内分泌系统、微生物代谢产物等协同调节ISCs分化[15]。上皮细胞的分化有利于修复应激造成的损伤、发挥肠道屏障(生物屏障、化学屏障、机械屏障等)作用[16]。核抗原(Ki67)被认为是分裂细胞核的代表物,因此实验中常使用其阳性染色细胞的表达量来指示细胞的分化程度[17]。
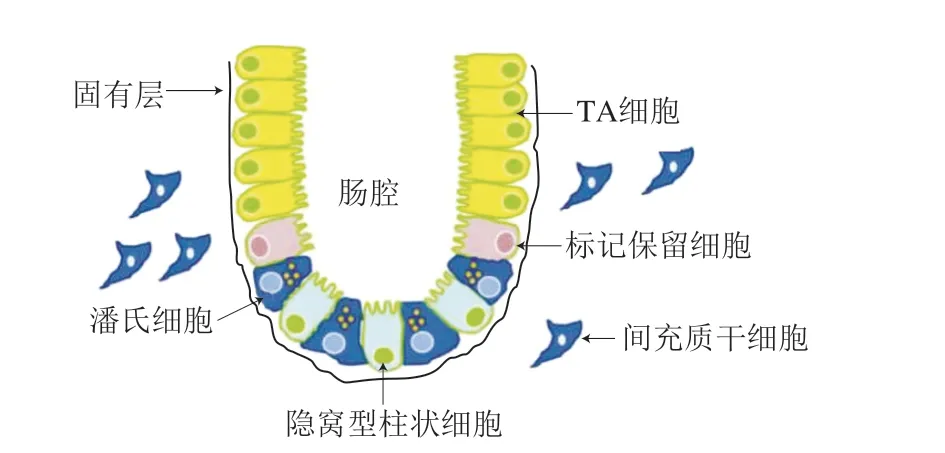
图1 肠腔结构[13]Fig. 1 Intestinal cavity structure[13]
1.1 益生菌对肠细胞增殖分化通路的调控
ISCs处于一个极其复杂的微环境之中,一些经典通路如Wnt通路、Notch通路和骨形态发生蛋白(bone morphogenetic protein,BMP)通路等对ISCs的分化及自我更新发挥协同调控作用[18-20]。BMP信号限制了隐窝的数量[21]。Wnt信号通路在动物间存在遗传学上的高度保守性,不同的动物物种间极为相似。Wnt蛋白是影响ISCs增殖的关键因素,是控制细胞沿绒毛轴迁移的首要力量,由隐窝上皮细胞表达[22]。
有研究证实,益生菌可通过调控Wnt与Notch信号通路实现lgr5+干细胞定向分化(图2)。若同时激活上述两种信号可使干细胞自我增殖;同时被抑制则定向诱导杯状细胞分化。定向诱导肠上皮细胞分化需要激活Notch通路、阻遏Wnt通路,反之则分化为潘氏细胞,而内分泌细胞分化与Wnt通路无显著联系,只需抑制Notch信号通路[23]。当Wnt通路靠近ISCs,与细胞膜表面的卷曲受体蛋白及其辅助受体低密度脂蛋白受体5/6结合后,可使腺瘤性息肉病基因蛋白破坏复合物的聚集结构分散,保护β-联蛋白不因发生磷酸化而被降解。β-联蛋白随后转位进入核内,结合T细胞因子4,使靶基因起始转录,从而促进增殖分化[11,15]。而Xie Shuang等最新研究得到了不同结论,他发现Lactobacillus reuteri 22可提高lgr5+的mRNA表达量并活化上述Wnt/β-联蛋白信号传导途径,增加增殖细胞核抗原的表达,从而促进鸡的小肠上皮细胞增殖。此外,Lactobacillus reuteri 22还抑制了Notch信号通路,诱导ISCs分化为杯状细胞,提高黏蛋白2表达量。这项研究表明,乳杆菌可以调控肉鸡肠上皮细胞的发育,以确保肠道黏膜屏障功能[24]。
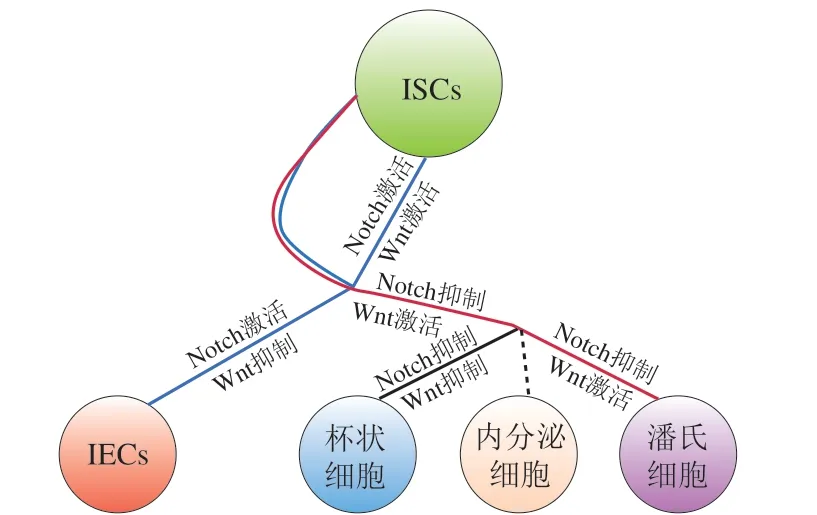
图2 Wnt和Notch途径协同控制ISCs的自我更新和分化模型[23]Fig. 2 Model for cooperative control of ISC self-renewal and differentiation by Wnt and Notch signal pathways[23]
1.2 益生菌对肠道黏膜屏障的调控
肠道发育除表现在肠细胞增殖与分化外,还表现在黏膜屏障的成熟。肠道黏膜屏障功能是一套复杂的机制,通过生物、化学、免疫和机械屏障实现屏障作用。一般认为机械屏障是肠道屏障的主要部分,包括上皮细胞层(即包括上述ISCs、IECs等)、黏液层、固有层等。对肠黏膜屏障功能和完整性的影响是益生菌对宿主发挥益生功能的主要机制,表现在对肠黏膜发育的促进作用、对炎症的调节作用,以及对黏膜细胞的基因表达的调控作用。
益生菌可以通过信号传递改变上皮细胞骨架重构、维持细胞膜渗透性。肠上皮的通透性包括跨上皮与细胞旁途径(即紧密连接处)两个途径。有研究发现给新生小鼠饲喂鼠李糖乳杆菌(Lactobacillus rhamnosus)GG活菌或热灭活的制剂可诱导跨膜蛋白claudin 3表达,从而加速肠屏障成熟,该研究还指出益生菌在维持紧密结合蛋白的表达方面有促进作用,这种作用能够被组胺或非甾族化合物消炎药如阿司匹林等抑制[1]。
另外,作为肠道机械屏障的重要组成部分,黏液层起到半固定保护屏障和润滑流动生物膜作用。黏液素(Muc2、Muc3)的表达会受到乳酸杆菌的调控作用,表现为促进表达上调,这种促进作用与乳酸杆菌定植时间有关。除刺激肠道发育成熟外,还观察到一些益生菌可提高上皮绒毛细胞中富含脯氨酸的蛋白质表达[1]。
根据上述肠道发育特点,实验常从肠道组织形态、肠道细胞增殖分化、肠道上皮紧密连接蛋白的合成等角度来反映肠道状态。例如绒毛边缘可以分泌多种消化酶,同时绒毛高度的增加会促使小肠接触营养物质的面积增大,故绒毛越长的动物其消化吸收能力越强[25]。隐窝深度反映隐窝细胞的增殖率和成熟度,隐窝变浅则分泌功能增强[26]。绒毛长度和隐窝深度的比值(V/C)综合反映小肠的功能状况,V/C值下降表明小肠消化、吸收功能下降[27]。
2 益生菌菌体组分对肠道发育的调控
益生菌因其益生功能而被广泛应用于医疗、保健、食品等领域。尽管益生菌被定义为通过定植在体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物,但益生菌发挥益生作用机理较复杂,可通过菌体本身及其活性代谢物直接对有害物质进行黏附或降解,或者通过其代谢产物调节肠道菌群及其代谢酶活性、调节机体免疫活性及机体部分酶活性等,起间接益生作用。因此,国际上普遍观点认为益生菌无论活菌和死菌都具有益生功能,只是发挥功能的机理、剂量、安全性等有差异。例如灭活的乳酸菌产品含有维生素、游离氨基酸、小分子功能肽等生理活性物质,同样具有良好的益生功能[28]。目前,已经有越来越多实验证明益生菌菌体组分对肠道发育具有调节作用,如一些蛋白类物质以及细胞壁成分等。
2.1 菌毛蛋白对肠道发育的调控
蛋白质表面暴露的聚合物结构称为菌毛[29]。长期以来学者们对细菌菌毛的研究主要集中在各种不同的致病菌株[30],并认为其是宿主发病机制中的关键毒力因素[31]。然而在益生菌中也发现有菌毛的存在[32],它们长约1 μm,直径1~10 nm,从细胞表面发散出来,参与细胞黏附定植以及与宿主细胞之间的信息传递。有研究发现鼠李糖乳杆菌L. rhamnosus GG基因组中包含2 个独立的菌毛位点:SpaCBA和SpaFED基因簇[32-33]。有研究通过免疫电子显微镜证实了pilin亚基SpaC的表达[34],并证明SpaC基因是鼠李糖乳杆菌分泌黏液关键因素[35-36],SpaF也已被证实在黏连蛋白中起作用[37]。另外,鼠李糖乳杆菌L. rhamnosus GG分泌的具有特异性和可溶性的低分子质量蛋白可调节上皮细胞生长和免疫反应[36]。
菌毛不仅作为一种重要的定植因子可促进二级宿主免疫反应[38-40],同时Motherway等最近发现,Bifidobacterium breve UCC2003的Tad菌毛可能通过产生一种特定的细胞外蛋白结构支架,促进新生儿结肠上皮细胞增殖、黏膜的生长,从而促进幼年肠道的成熟[29]。Bifidobacterium breve UCC2003的Tad菌毛纤维由一个或多个不同菌毛蛋白的多个拷贝组成,编码其菌毛蛋白的基因簇如图3所示,其中flp-pilin形成菌毛蛋白轴,该轴上装饰有假菌毛蛋白、TadE和TadF。实验表明Tad菌毛也参与了微生物-宿主的通讯,特别是向宿主上皮传递增殖信号。Motherway等首先通过动物实验发现灌喂109CFU/mL Bifidobacterium breve UCC2003PK1 5 d后,细胞增殖效果显著增加;之后使用功能基因组方法,分别构建了TadE、TadF缺失的Bifidobacterium breve UCC2003基因突变株(UCC2003ΔTadE与UCC2003ΔTadF),分析这些突变株在体内促进上皮细胞增殖,发现Tad菌毛介导的上皮细胞增殖由TadE亚基介导;最后将TadE蛋白纯化,并通过体外实验证实了这些发现[29]。

图3 Bifidobacterium breve UCC2003Tad基因簇[29]Fig. 3 Bifidobacterium breve UCC2003Tad gene cluster[29]
目前认为Tad菌毛这种调节增殖效应的宿主-微生物沟通机制主要与Toll样受体(toll-like receptor,TLR)有关。TLR家族在识别并抑制病原体、在特定的微生物配体或宿主被感染时释放危险信号因子、维持生理条件下的组织稳态方面发挥着重要作用。在上皮细胞中,TLR2、TLR4和TLR5的mRNA和蛋白质的诱导性表达已被证实[41]。所有短双歧杆菌和所有现存双歧杆菌的基因组中均保留有Tad基因簇,这为菌毛介导宿主-微生物信号传导的观点提供了有力支持,也使得从分子水平上对早期微生物-宿主“对话机制”的研究更为深入[29]。
2.2 益生菌细胞壁成分对肠道发育的调控
MDP是益生菌细胞壁中肽聚糖的水解产物。当动物肠道处于稳态时,MDP对ISCs的影响不显著;一旦肠道受损伤,MDP可立即对ISCs发挥保护作用,并且这一保护作用由Lgr5+ISCs模式识别受体核苷酸结合寡聚化结构域蛋白2(nucleotide-binding oligomerization 2,Nod2)介导,并以Nod2依赖性方式保护干细胞免受体内氧化应激,具体表现为促进Lgr5+ISCs增殖、抑制凋亡。Nigro等研究发现细菌肽聚糖MDP在体外可诱导较高的类肠器官表达[42]。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,细菌死亡时通过溶解、破坏细胞实现脱落。LPS通过激活TLR4抑制上皮细胞蛋白激酶(protein kinase,Akt)磷酸化,糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)在其上游负调控因子Akt作用下,磷酸化水平降低,活力提高,使β-联蛋白被磷酸化后降解,最终抑制Lgr5+ISCs或类器官增殖,诱导细胞凋亡[43],具体机制见图4。
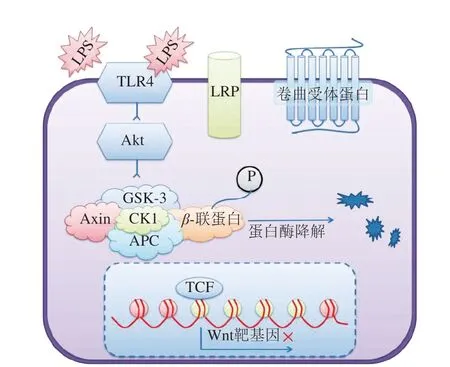
图4 TLR4介导LPS引起的ISCs β-联蛋白降解[15]Fig. 4 TLR4 mediates the LPS-induced β-catenin degradation of intestinal stem cells[15]
ISCs能够表达TLR4和Nod2等模式识别受体并被配体激活,但表现出不同的功效:MDP可激活Nod2保护ISCs,而LPS激活TLR4促进ISCs凋亡[15]。LPS与MDP同时存在于肠道中,各自按照自身的浓度抵消对方的作用[44]。有研究表明共生细菌在正常的稳态条件下可被TLRs识别,并且这种相互作用在维持肠上皮稳态方面起着至关重要的作用[45]。
2.3 外源性表皮生长因子对肠道发育的调控
表皮生长因子(epidermal growth factor,EGF)存在于胃肠道等组织中,是一类可外源表达的蛋白质类增殖因子[46]。有证据表明,小肠内足够量的外源性EGF可提高肠谷氨酰胺酶活力,产生ISCs增殖和分化所需酰胺氮及能量,以促进肠道发育,维持良好形态[47],从而修复损伤。Bedford等通过生物工程方法构建了可外源表达EGF的乳酸乳球菌Lactococcus lactis(EGF-LL),并且发现其发酵上清液能促进新断奶仔猪的生长,包括肠道发育成熟,具体表现为杯状细胞增殖、空肠结构发育成熟、绒毛高度提高、固有层宽度降低[48]。Cheung等用重组方法构建EGF-LL,发现其可在整个肠道中存活,并且在肠道内容物中还检测到重组EGF蛋白;口服重组细菌EGF-LL的早期断奶小鼠的体质量显著提高、肠道中平均绒毛高度和隐窝深度增加,肠中增殖细胞核抗原染色的细胞数量增多,表明肠细胞的增殖得以增强;该研究证明Lactococcus lactis(EGF-LL)对新生断奶小鼠的肠道生长具有有益作用[49]。Kang Ping等研究发现接受外源表达EGF的乳酸乳球菌Lactococcus lactis(EGF-LL)组的猪空肠和十二指肠绒毛高度和肠长度、肠道细胞增殖率均显著高于对照组[50]。
此外,肠道隐窝-绒毛轴上的内源EGF信号通过与细胞膜上的糖蛋白受体特异性结合,使受体磷酸化,提高酪氨酸激酶活力,开启下游一系列信号通路(如PI3K/Akt和Ras/Raf/MEK/ERK等),通过调节下游基因的转录来调控ISCs与TA细胞的增殖和分化[51-52]。
3 益生菌代谢产物丁酸及其盐类促进肠道发育
动物肠道中存在益生菌代谢产物——短链脂肪酸(short-chain fatty acids,SCFAs),如乙酸、丙酸和丁酸等。体内超过95%的丁酸在结肠内产生和吸收[53]。丁酸为肠道上皮细胞提供营养,丁酸盐可以促进结肠黏膜细胞分化[54]。有研究发现添加0.1%丁酸钠到断奶仔猪饲粮中,1 周后仔猪十二指肠和回肠的V/C值显著提高[55]。此外,丁酸还影响肠道屏障,一方面通过影响覆盖于结肠上皮黏液中的黏蛋白和三叶因子来提高肠黏膜的屏障能力;另一方面影响结肠上皮的通透性,增加肠道的屏障能力,减少炎症因子的产生,保护机体免受内源抗原带来的损伤,延缓溃疡性结肠炎或其他炎症[53]。冉舒文等综述了丁酸可以通过激活Caco-2细胞的腺苷酸活化蛋白激酶而促进肠道的紧密连接表达,保证肠道的屏障功能[56]。其次,丁酸也能够诱导活性转谷氨酰胺酶、抗菌肽和热休克蛋白(heat shock proteins,HSPs)的合成,间接促进结肠黏膜的保护作用。已有研究证明,转谷氨酰胺酶可以促进肠黏膜的愈合,抗菌肽(白细胞介素-37)和防御素可保护肠黏膜免受细菌的感染,HSPs可抑制炎症调节剂的生成而预防炎症[57]。丁酸及其盐类对动物肠道生长发育的影响见表1。

表1 丁酸及其盐类对动物肠道生长发育的影响Table 1 Effects of butyric acid and butyrate on intestinal growth and development of animals
上述研究结果说明当丁酸及其盐类作为补充剂对宿主发挥有益作用时,其剂量、摄入时间、摄入方式等需要受到严格控制,才可能促进黏膜的成熟和分化,从而影响胃肠道的形态和功能,这使得以丁酸为主要代谢产物的产丁酸细菌在肠道中的作用受到更多关注。通过对人肠道微生物的广泛调查发现,产丁酸细菌主要分布在梭菌属(Clostridium)、真杆菌属(Eubacterium)以及梭杆菌属(Fusobacterium)等,目前我国已将丁酸梭菌投入商业化应用[53]。李玉鹏等发现与对照组相比,饲喂添加了丁酸梭菌饲粮的仔猪紧密连接蛋白的表达显著提高,平均日增质量提高7.83%[64]。Takahashi等研究表明日粮中添加丁酸梭菌MIYAIRI588能够显著提高肉鸡和断奶仔猪的生长性能,降低坏死性肠炎的发生率和严重程度[65]。
4 肠道菌群定植稳态影响肠道发育
栖息在动物肠道的微生物数量庞大,是体细胞和生殖细胞总数的10 倍[66]。肠道也被认为是机体“遗忘的免疫器官”[67]。结肠存在约1 000~1 150 种细菌,主要以严格厌氧的革兰氏阳性菌为主,且具有宿主特异性[52,68]。健康成人肠道菌主要分为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidete)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria),其中前2 类菌门的数量超过全部肠道菌的90%[69]。儿童肠道内富含双歧杆菌属(Bifidobacterium)和Lecnospiraceae;青少年肠道菌群主要富含双歧杆菌属(Bifidobacterium)、粪肠杆菌属(Faecalibacterium)、Anaerovorax及毛螺菌科(Lachnospiraceae)[70]。
肠道微生物群可以在肠道受应激损伤期间影响肠上皮细胞。一些研究发现,肠道微生物群通过免疫细胞-上皮细胞网络促进肠上皮修复的作用,在这些通路中,TLR和甲酰肽受体起识别细菌配体作用[45]。越来越多的证据表明,早期生命中的微生物群是晚期免疫和代谢疾病风险的关键决定因素[71],同时也是肠道上皮更新的重要驱动因素,影响肠道黏膜形态和平衡[72]。基于无菌动物的微生物移植实验整体反映了肠道微生物通过参与机体的物质代谢网络对宿主的生长和代谢表型进行调节,并直接影响到肠道的生长、发育和代谢调控[69]。肠道微生物群对动物肠道生长发育的影响见表2。
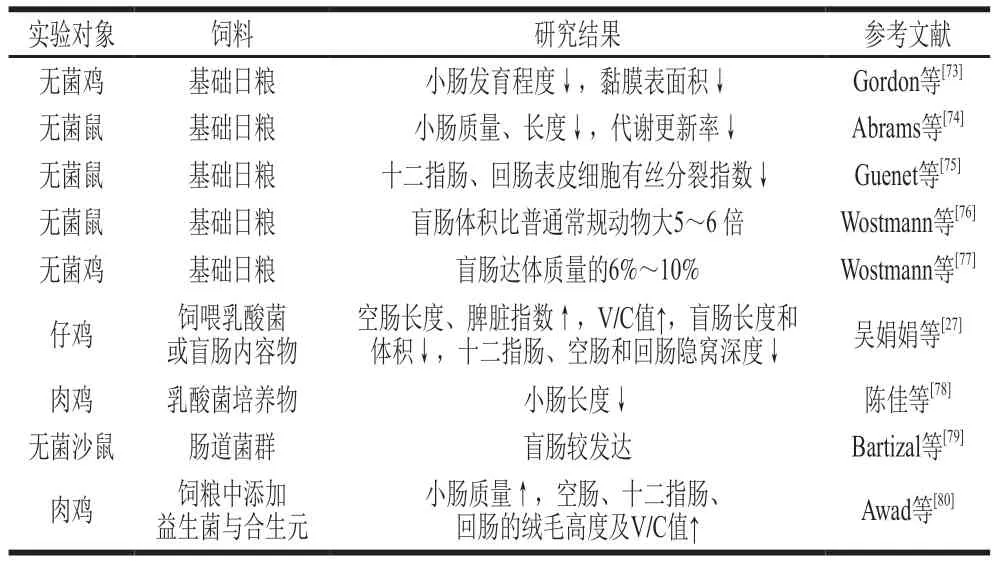
表2 肠道微生物群对动物肠道生长发育的影响Table 2 Effect of gut microbiota on intestinal growth and development of animals
Rask等研究发现,与普通小鼠相比,单一定植菌的小鼠或无菌小鼠可以通过上调小肠黏膜上皮主要组织相关复合体的表达,进而促进小肠黏膜形态结构的完整[81]。张兰威等的结果表明,不同地域母乳中微生物组成存在差异,一些从样品中分离得到的乳杆菌和双歧杆菌可以发挥促进肠道上皮细胞发育、巨噬细胞活性的作用[82]。
肠道微生物群显然对动物早期肠道形态发育、上皮细胞增殖具有重要影响[5],因此,肠道菌群的变化也能在一定程度上反映出肠道状态、代谢能力等。另外,肠道菌群与大脑、肝脏等器官之间通过肠道菌群-肠-脑轴、肠道菌群-肠-肝轴等进行相互调控,故通过对肠道菌群的监测,也可预测其他器官正常或异常发挥作用的趋势。目前对于肠道微生物群与上皮细胞之间双向交流的通路机制也已有研究[83],但对于微生物群与上皮细胞传导信号的全分子序列尚未完全了解。肠道菌群对邻近干细胞的功能调节,包括对代谢、免疫以及神经元和血管发育在内的多种宿主功能的调节,仍有待于进一步深入研究[84-87]。
5 结 语
综上所述,肠道微生物与肠道发育密切相关,肠道内定植的益生菌可通过直接或间接的途径影响动物肠道细胞增殖分化、黏膜屏障的形成,从而实现对肠道发育的干预。然而目前实验常通过建立体外细胞模型、类器官模型以及以转基因小鼠作为实验模型来模拟正常动物肠道组织,临床实验较少,与人体正常肠道环境存在差异。并且尽管人们目前对于益生菌干预肠道细胞增殖分化及黏膜屏障的形成有一定的了解,但其自我更新具体机制仍有待进一步系统探索。并且有必要深入了解益生菌干预靶位点、靶分子和相关的信号传导通路等分子调控机制,筛选出含有起调控作用的菌体蛋白或分泌有效代谢产物的功能菌株或利用生物工程手段定向改造工程菌,通过补充益生菌制剂、菌群移植等方式,有效发挥益生菌促进肠道发育的益生作用,这对于婴幼儿机体成熟、缓解或修复肠道应激损伤等产生重要的影响,对维持机体健康具有重要意义。
