食源性酪氨酸氧化产物诱导小鼠心肌氧化损伤及能量代谢障碍的机制
2020-11-27吕一品李博文葛月婷杨绍军马淑华
吕一品,唐 雪,李博文,葛月婷,杨绍军,张 凯,马淑华
(江南大学食品学院,食品营养与功能食品工程技术研究中心,江苏 无锡 214122)
酪蛋白广泛存在于食品加工体系中,加工过程中极易氧化生成双酪氨酸(dityrosine,DT)、3-硝基酪氨酸(3-nitrotyrosine,3-NT)和3-氯酪氨酸等酪氨酸氧化产物(tyrosine oxidation product,OTP)[1],其中DT常被作为判断食品蛋白质氧化程度的标准[2]。在市售牛奶[3]、喷雾干燥奶粉[4]以及肉类模型系统[5]中均可检测到OTP和DT存在。食源性OTP会造成食品品质和营养价值降低[6],且OTP化学结构稳定,对酸解和蛋白酶水解过程具有抵抗性,可完整地被肠道吸收进入血液循环,在组织细胞中蓄积。研究发现,大鼠长期饲喂含OTP和DT日粮均可造成血液、肝、肾DT累积,自由基含量升高,引起脂代谢紊乱和脂质积累,导致肝肾功能损伤及纤维化病变[7]。Ding Yinyi等结合动物和细胞实验证实OTP、DT导致胰岛素分泌显著降低,引起糖代谢异常和胰腺细胞凋亡,具有较强的促氧化能力,对人体健康具有潜在危害[8]。然而摄入的食源性OTP如何影响机体能量代谢,导致组织器官氧化损伤和功能紊乱,其相关作用机制尚不明确,还需进一步研究。
心脏作为机体最重要的器官之一,为血液流动提供动力,对能量和氧的需求量极高。线粒体作为ATP产生和自由基生成的主要细胞器,其结构改变、数量减少及ATP生成不足是导致心室功能障碍、心脏衰竭等疾病发生的基础[9]。研究发现,蛋白质氧化后不仅影响了心脏对氨基酸的利用,且血液氧化蛋白产物累积与心血管疾病的发生密切相关,可作为判断缺血性心脏病的特异性指标[10]。本课题组前期研究发现OTP可引起大鼠心肌纤维断裂溶解,线粒体肿大、形成空泡、嵴数量减少,出现心肌纤维和线粒体损伤[11]。然而,食品OTP摄入引起心肌损伤及线粒体功能异常的相关机制尚未明确,DT作为OTP的重要组分其氧化损伤机制还有待进一步研究。因此,本研究以生长期小鼠为实验对象,探究食源性OTP和DT对小鼠心肌氧化还原稳态、线粒体功能及能量代谢的影响,进一步明确食源氧化蛋白作用机制,为完善食物蛋白质营养理论、减少现代食品加工对健康的危害提供有价值的理论支撑。
1 材料与方法
1.1 动物、材料与试剂
3 周 龄S P F 级 雄 性C 5 7 B L/6 小 鼠3 0 只 , 使 用许可证号:S Y X K(苏)2 0 1 6-0 0 4 5,动物合格证编号:20170005006323,实验伦理审核编号:JN.No20190330c0900820,购自上海斯莱克实验动物有限责任公司,饲养于江南大学实验动物中心,饲养温度20~26 ℃,相对湿度40%~70%,昼夜循环光照12 h/12 h,自由进食饮水,每周称量并记录体质量。
酪氨酸购自美国Sigma公司;酪氨酸氧化产物根据文献[12]报道的方法制得;双酪氨酸(dityrosine,DT)香港锐东生物科技公司;超氧化物歧化酶(superoxide dismutase,SOD)、锰-超氧化物歧化酶(MnSOD)、总蛋白试剂盒 上海碧云天生物技术公司;总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、游离脂肪酸(free fatty acid,FFA)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)和ATP酶(ATPase)检测试剂盒 南京建成生物工程研究所;乙酰辅酶A、NADH、NAD+、C反应蛋白(C reactive protein,CRP)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、DT酶联免疫吸附反应试剂盒 厦门慧嘉生物科技有限公司;RNA提取试剂盒和引物 上海生工生物工程有限公司;OligdT、dNTP、RNase抑制剂、M-MLV逆转录酶美国Thermo Fisher公司;Quantitect SYBR Green PCR Kits南京诺唯赞生物科技有限公司。
1.2 仪器与设备
Nano Drop分光光度计、M5酶标仪 美国Molecular Devices公司;CFX96 Touch实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;5804R台式高速冷冻离心机 美国Thermo Fisher公司;微量移液器 德国Eppendorf公司;MPI-B型化学发光检测仪 西安瑞迈分析仪器有限责任公司;电子天平 瑞士梅特勒-托利多仪器有限公司;ETC811 PCR扩增仪 东胜兴业科学仪器有限公司。
1.3 方法
1.3.1 实验分组及预处理
C57BL/6小鼠普通饲料适应性预饲养1 周后,随机组别为3 组,每组10 只:对照组(Con)、酪氨酸氧化产物组(OTP)和双酪氨酸组(DT),各组每天分别灌胃420 μg/kgmb的酪氨酸溶液、1 909 μg/kgmb的OTP和420 μg/kgmb的DT溶液,连续35 d。本研究采用生长期小鼠,在其3 周可离乳独立生长时开始适应性培养,之后灌胃35 d至其体成熟。较之前研究[8]缩短了灌胃周期,故提升DT灌胃剂量至420 μg/kgmb,实验所用的OTP中DT质量分数约为22%,为保持两组DT质量分数一致,将OTP灌胃剂量设为1 909 μg/kgmb。实验结束后小鼠禁食12 h,腹腔注射戊巴比妥钠麻醉后摘眼球取血至抗凝管内,3 500 r/min、4 ℃离心10 min,取上层血浆,-80 ℃保存。小鼠断颈处死后,在冰浴上迅速摘取心脏,用预冷的生理盐水漂洗后称质量,按下式计算心脏指数。
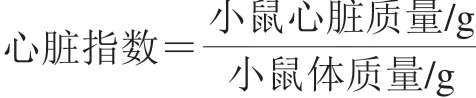
取0.05 g左右心肌组织加入生理盐水匀浆制得体积分数10%组织匀浆,3 500 r/min、4 ℃离心10 min,取上清液,-80 ℃保存。取0.05 g左右心肌组织置于TRIzol试剂中,-80 ℃保存用于总RNA的提取。
1.3.2 指标测定
1.3.2.1 ROS水平测定
新鲜取到的小鼠全血,采用luminol化学发光法测定[13],用Origin 8.0软件对实验峰面积进行积分,以单位体积下相对发光强度表示活性氧(reactive oxygen species,ROS)水平。
1.3.2.2 氧化还原及心肌损伤指标测定
T-AOC、CAT、GSH-Px、MDA、SOD、ATPase、DT、CRP、TNF-α水平的测定均按试剂盒说明书操作。
1.3.2.3 总RNA的提取与反转录
利用T R I z o l 法提取心肌组织中的总R N A,用Nano Drop分光光度计测定RNA的纯度和浓度,对于A260nm/A280nm在1.8~2.0的合格样品进行反转录,所得cDNA储存于-20 ℃备用。
1.3.2.4 实时荧光定量PCR
根据试剂盒说明书,测定抗氧化,线粒体合成及凋亡相关基因的表达量,引物序列如表1所示。通过实时荧光定量PCR进行扩增,测得各模板的Ct值,用2-ΔΔCt法计算,以β-actin为内标,进行相对定量[14]。

表1 实时荧光定量PCR引物序列Table 1 Sequences of primers used for real-time quantitative PCR
1.4 数据统计分析
结果均以平均值±标准差表示,采用SPSS 18.0软件对数据进行处理,运用方差分析、Tukey检验进行组间显著性差异分析,P<0.05表示组间有显著性差异。
2 结果与分析
2.1 酪氨酸氧化产物对小鼠体质量、心脏指数及心肌损伤相关指标的影响

图1 酪氨酸氧化产物对小鼠体质量(A)和心脏指数(B)的影响(n= 10)Fig. 1 Effects of tyrosine oxidation products on body mass (A) and cardiac index (B) in mice (n = 10)
如图1A所示,整个实验期间,3 组体质量在各时间点均无显著性差异(P>0.05),但灌胃DT和OTP 35 d可显著提高小鼠心脏指数(P<0.05)。CRP是冠心病和全身炎症的生物标志物之一[15-16],其水平在组织损伤、感染和其他炎症刺激下升高[17]。TNF-α是一种具有多种生物学效应的细胞因子和免疫调节因子,在抑制心肌收缩性、促进心肌重构、引起内皮心肌细胞凋亡中起重要作用[18]。CK和LDH是心肌能量代谢过程中的重要酶,病理状态下血浆CK和LDH活性的升高[19]。

表2 酪氨酸氧化产物对小鼠血浆心肌损伤指标的影响(n= 10)Table 2 Effects of tyrosine oxidation products on myocardial injury index in plasma of mice (n= 10)

表3 酪氨酸氧化产物对小鼠心肌ROS及氧化产物的影响(n= 10)Table 3 Effects of tyrosine oxidation products on ROS and oxidation products in myocardia of mice (n= 10)
由表2、3可知,小鼠灌胃DT和OTP可显著提高小鼠心肌蛋白质氧化产物DT、AOPP和3-NT以及脂质氧化产物MDA的蓄积,引起血浆TNF-α水平和CK、LDH活力显著提高(P<0.05),表明OTP和DT灌胃引发小鼠心肌组织损伤和炎症反应。
2.2 酪氨酸氧化产物对小鼠心肌氧化还原稳态的影响
ROS是人体能量代谢的副产物,在健康机体内处于动态平衡状态[20]。当机体受到有害因素刺激时,细胞抗氧化能力下降导致ROS的动态平衡被破坏,从而引起机体氧化应激[21]。

表4 酪氨酸氧化产物对小鼠血浆氧化还原指标的影响Table 4 Effects of tyrosine oxidation products on plasma redox index in mice
如表4和图2所示,与Con组相比,DT和OTP灌胃显著提高了小鼠血浆ROS水平,降低了血浆CAT活力以及心肌组织T-AOC和CAT、SOD活力(P<0.05),OTP组血浆T-AOC、SOD活力亦显著降低,表明DT和OTP可降低血浆、组织抗氧化能力,引起氧化损伤。Nrf2通路是细胞内重要的抗氧化调节通路,Pi3k和Gsk3β是Nrf2的上游调控因子,其中Gsk3β抑制Nrf2,而Nqo1是Nrf2下游调控表达的抗氧化酶[14]。实时荧光定量PCR结果显示,DT和OTP灌胃显著下调小鼠心肌抗氧化相关基因(Pi3k、Ampk、Nrf2、Nqo1)mRNA表达水平,而显著上调Gsk-3β表达水平(P<0.05),表明DT和OTP引起心肌组织氧化还原稳态失衡与抑制抗氧化通路关键因子表达有关。

图2 酪氨酸氧化产物对小鼠心肌氧化还原状态的影响Fig. 2 Effects of tyrosine oxidation products on myocardial redox state in mice
2.3 酪氨酸氧化产物对小鼠心肌组织线粒体功能和能量代谢的影响

表5 酪氨酸氧化产物对小鼠心肌能量代谢的影响Table 5 Effects of tyrosine oxidation products on myocardial energy metabolism in mice
FFA是心肌细胞最主要的供能物质,FFA在心肌积聚能增加细胞耗氧量,影响能量代谢,降低心肌收缩力,促进心肌梗死时酶的释放,严重时可引起心律失常[22]。如表5所示,与Con组相比,DT组和OTP组小鼠心肌FFA含量显著提高,而NADH/NAD+比值、乙酰辅酶A含量以及ATPase、LDH活力显著降低。乙酰辅酶A含量、NADH/NAD+比值与线粒体ATP生成密切相关。ATPase作为一种离子泵,是维持细胞内外离子平衡的重要物质,其活性的降低会引发细胞内阳离子超载,产生毒害作用,加重心肌损伤[23]。上述结果表明,DT和OTP抑制了线粒体氧化磷酸化进程,破坏了胞内氧化还原稳态,引起脂质在胞内的累积。

图3 酪氨酸氧化产物对小鼠心肌线粒体生物合成相关基因的影响Fig. 3 Effects of tyrosine oxidation products on mRNA expression levels of myocardial mitochondrial biosynthesis-related genes in mice
此外,如图3所示,DT和OTP灌胃显著下调了小鼠心肌线粒体合成相关基因Pgc1α、Tfam和Pparα的mRNA表达水平(P<0.05,P<0.01,P<0.001),表明DT和OTP引起心肌组织损伤及氧化还原稳态失衡与影响线粒体生物合成有关。
3 讨 论
食源性OTP化学结构稳定,已被证实可抵抗酸解和蛋白酶水解,摄入后可经肠道完整吸收进入血液循环,在肝、肾[24]、胰腺[8]、脑组织[7]中蓄积。研究发现,小鼠长期摄食OTP日粮极易促发胰腺氧化应激反应[8],诱导肝肾纤维化[25]和大脑学习记忆功能减退[7,26]。代谢组学分析结果显示灌胃320 μg/kgmbDT溶液6 周显著降低了小鼠血浆3-羟基丁酸和白蛋白水平,增加血浆、尿液中氧化三甲胺含量,抑制脂肪酸代谢和蛋白质合成,大幅增加了患心血管疾病的风险[27-28],提示食源性OTP对心脏及其功能具有潜在危害。
本研究发现小鼠分别灌胃1 909 μg/kgmbOTP和420 μg/kgmbDT溶液35 d,可引起心脏指数增加,心肌组织DT、AOPP和3-NT大量蓄积,血浆CRP、TNF-α水平和CK、LDH活力显著提高。上述结果表明OTP和DT灌胃可引发小鼠心肌组织损伤及炎症反应,这与张会等报道DT灌胃造成小鼠血浆炎性因子显著提高的实验结果[29]一致。心肌梗死患者心脏存在大量DT蓄积,可作为心肌梗死早期诊断的指标[30]。患有心肌病的糖尿病小鼠主动脉中3-NT含量显著高于正常小鼠[31]。研究证实,酪氨酸氧化产物在组织中大量蓄积会影响正常氨基酸和蛋白质的化学结构及生理功能,导致酶活性的降低及细胞凋亡[32]。
为了进一步探究OTP和DT损伤心肌组织的可能机制,本实验测定了氧化还原相关指标及基因表达水平。结果显示,与Con组相比,OTP和DT灌胃显著提高了小鼠心肌ROS水平,降低了T-AOC水平及抗氧化酶(CAT、SOD和GSH-Px)活力,导致脂质过氧化产物MDA过量累积,引起心肌氧化应激和抗氧化能力降低,这与赵琪等研究结果[33]一致。体内过量的ROS参与蛋白质、核酸等生物大分子氧化,可引起氧化产物蓄积,刺激产生更多ROS,进一步加重氧化应激。氧化应激不仅引起心肌炎症反应和组织损伤,而且进一步导致心肌纤维化[34-36],与心肌缺血再灌注损伤、急性心肌缺血和糖尿病心肌病的发生发展密切相关[37]。此外,实时荧光定量PCR结果显示抗氧化相关基因Pi3k、Ampk、Nrf2、Nqo1mRNA表达水平显著下调,而抑制因子Gsk-3β表达显著上调。Nrf2/ARE通路受损是糖尿病的主要特征之一[38],心力衰竭导致大鼠心肌组织中Pi3k/Akt/Gsk-3β通路上各关键因子显著下调[39],表明OTP和DT引起心肌组织氧化能力降低及氧化损伤与抑制抗氧化信号通路关键因子表达有关。
线粒体是能量代谢的主要部位,也是ROS产生和攻击的主要靶点。氧化应激引起线粒体功能异常主要表现在线粒体DNA及内含物减少,ATP合成减少[40-41]。氧化应激引起的线粒体能量代谢障碍被认为是心功能障碍的主要因素之一[42-43]。本研究结果发现,DT和OTP灌胃导致小鼠心肌组织乙酰辅酶A水平、NADH/NAD+比值显著降低,抑制了ATPase和LDH活性,提示心肌糖酵解途径和线粒体氧化磷酸化过程受阻。同时,心肌脂肪酸利用率下降,导致FFA进一步积累。此外,DT和OTP显著下调了心肌Pgc1α、Pparα、Tfam表达水平,对线粒体的生物合成及功能产生不利影响。可见,DT和OTP导致心肌氧化损伤机制与抑制线粒体能量代谢与生物合成密切相关。
DT是OTP的重要产物,常被作为判断食品蛋白质氧化程度的标准[44]。Ding Yinyi等发现DT具有与T3类似的结构,可竞争性结合胰腺T3受体,抑制T3生理效应的发挥,导致胰腺细胞ATP生成不足,胰岛素分泌降低[45]。通过比较分析OTP组与DT组各项指标,发现DT对心肌氧化应激及能量代谢等各指标的影响与OTP一致,且无显著性差异,提示DT可能是OTP诱导心肌氧化损伤的关键成分,进一步深入研究可为阐明OTP作用机制提供可靠的理论依据。
3 结 论
本实验探究了食源性OTP和DT对小鼠心肌氧化还原稳态,线粒体功能及能量代谢的影响。结果表明OTP和DT均可导致蛋白质及脂质氧化产物的积累,降低抗氧化酶活性,引起心肌组织氧化应激与炎性反应。同时,通过影响线粒体生物合成及抗氧化通路相关基因表达,抑制线粒体的生物合成与能量代谢。DT作为OTP的重要成分,在OTP诱导的心肌损伤过程中起关键性作用。
