用高热量饲料建立大鼠肥胖模型的实验研究
2020-11-27吕晓君徐小玲潘望平李厚钢王平慧何开勇
吕晓君,吴 森,张 菊,徐小玲,潘望平,李厚钢,王平慧,何开勇
(1. 湖北省药品监督检验研究院,武汉 430064;2. 湖北省药品质量检测与控制工程技术研究中心,武汉 430064)
随着人们生活水平的日渐提高,饮食结构和 生活方式在逐渐发生改变,同时肥胖症的发病率日益增加,现已成为世界范围内的一种流行病[1-2]。高脂饮食诱导的食物性肥胖模型是以高热量饲料诱发遗传易感性动物形成肥胖模型,这类模型与人类肥胖的自然过程相近,已成为研究肥胖症的重要模型之一[3-5]。高热量饲料诱导的肥胖大鼠是评价减肥功能性食品的传统模型,这种营养性肥胖造模的成功率相对较高,可有效完成肥胖动物模型的构建,但不同的配方饲料在造模效果方面存在差异。另外,目前国内使用的大鼠品种主要是SD(Sprague-Dawley)和Wistar大鼠,选用哪种品种的大鼠更加适宜并不清楚。本研究参考文献[6-7]报道的制备大鼠肥胖模型的实验方法,优化高热量模型饲料的配方,并在原料选择和加工工艺方面作进一步改良,观察其建立大鼠肥胖模型的效果,以及两个品种大鼠的建模差异;并比较不同的肥胖评价方法和肥胖敏感动物筛选方法,为研究减肥产品功能时制备动物模型提供参考。
1 材料与方法
1.1 饲料
维持饲料和高热量饲料均由武汉市万千佳兴生物科技有限公司提供[SCXK(鄂)2016-0011],饲料配方、能量值及营养成分比例见表1和表2。除粗脂肪外,其他营养成分均达到国家标准。模型饲料的能量值增加,主要是脂肪和碳水化合物的供能比增加。
1.2 实验动物及其饲养管理环境
SPF级雄性SD及Wistar大鼠各120只,购入时体质量为130~140 g,5周龄,由斯贝福(北京)生物技术有限公司提供[SCXK(京)2016-0009],维持饲料适应性喂养7 d。每笼2只大鼠,饲养于屏障环境[SYXK(鄂)2014-0009],自由饮用净化水,光照为12 h明暗交替,温度为20~26℃,相对湿度为40%~70%。
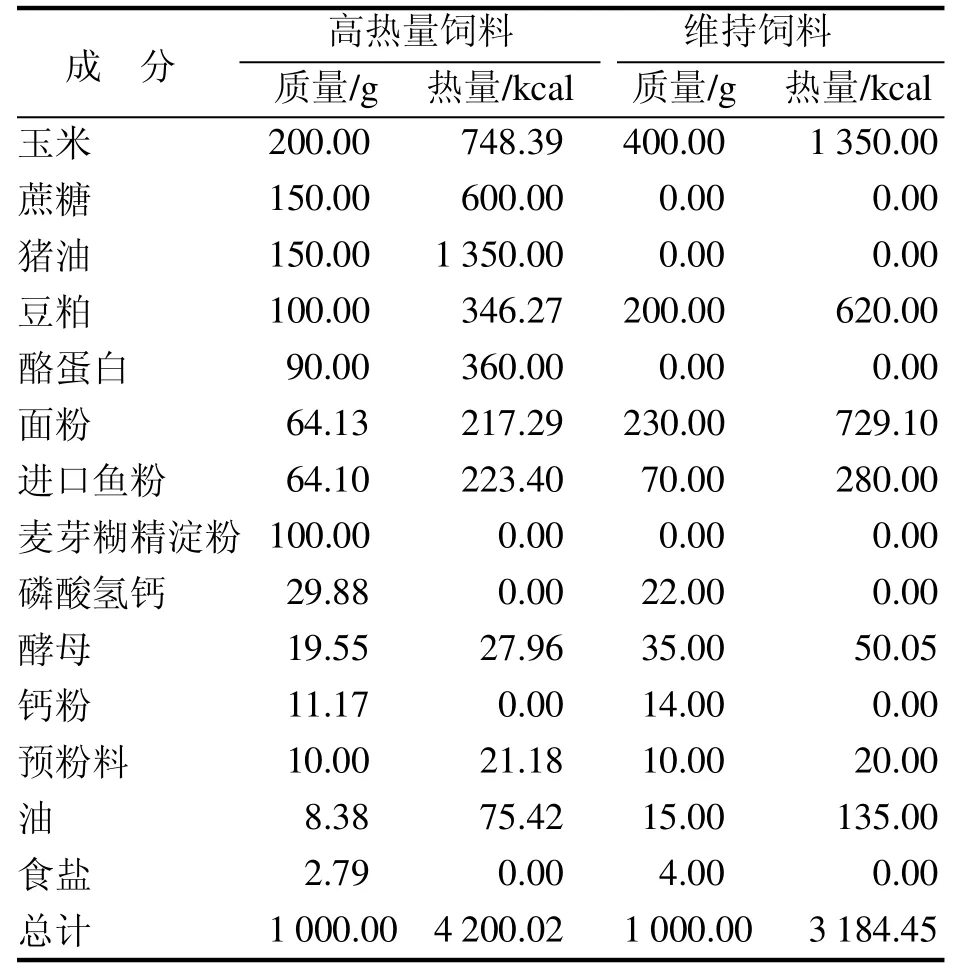
表 1 维持饲料和高热量饲料的原料配方及热量值Table 1 Formula and energy of basic diet and high-calorie diet
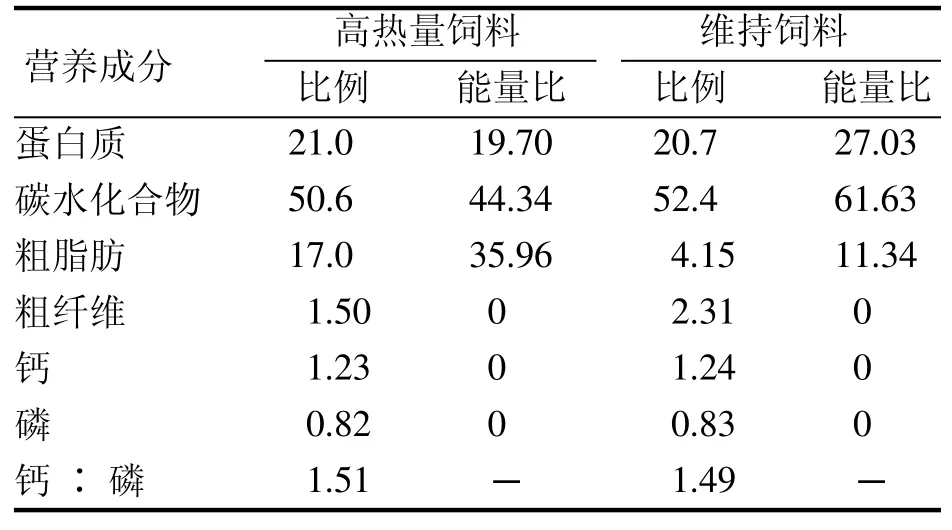
表 2 维持饲料和高热量饲料营养成分比例及供能比Table 2 Nutrient composition ratio and energy ratio of basic diet and high-calorie diet(%)
1.3 试剂和仪器
麻醉剂戊巴比妥钠购自广州化学试剂厂,批号850601;异氟烷购自河北一品制药有限公司,批号C002150101;血液生化试剂盒均为深圳迈瑞生物医疗电子股份有限公司生产,包括葡萄糖(glucose,GLU)(批号141417010)、三酰甘油(triglyceride,TG)(批号141718004)、总胆固醇(t o t a l c h o l e s t e r o l,T C)(批号141618006)、高密度脂蛋白胆固醇(high density l i p t e i n c h o l e s t e r o l,H D L-C)(批号142118004)、低密度脂蛋白胆固醇(low density liptein cholesterol,LDL-C)。ML303电子天平和XS6001S动物秤购自瑞士Mettler-Toledo公司;VP3麻醉剂挥发罐为美国DRE Veterinary公司产品;AU400全自动生化分析仪为日本Olympus公司产品。
1.4 实验分组及处理
实验前测量两品种雄性大鼠的体质量、体长,分别按体质量随机分为2组(空白对照组和模型组),每组60只,使组间体质量和体长均无明显差异。空白对照组给予维持饲料,模型组给予高热量饲料,共6周。喂养2周后,每组选取30只大鼠,禁食16 h,麻醉后采血并处死,解剖取双侧肾周围脂肪、睾丸周围脂肪并称质量,检测血生化指标;剩余30只大鼠继续喂养4周后,同前处理。
1.5 观测指标
1.5.1 一般情况观察 每日观察并记录所有动物的一般表现、行为、毛发、精神、活动、饮食、饮水和大小便等。
1.5.2 体质量和体长、Lee’s指数 每周称大鼠体质量1次,测量体长1次。测量体长时先用异氟烷气体麻醉动物,然后测量动物鼻尖至肛门的长度,计算Lee’s指数。Lee’s指数[8]=体质量(g)1/3×1 0/体长(c m)。
1.5.3 摄食量 每周加入饲料2次,称剩余饲料质量和撒食量各2次,计算周摄食量、周食物利用率、摄入总热量和总食物利用率。摄食量=饲料加入量-剩余量-撒食量,摄入总热量=摄食量×每公斤饲料热量,周食物利用率(%)=周体质量增加值/周饲料摄入量×100%,总食物利用率=实验期间动物体质量总增加值/饲料总摄入量×100%。
1.5.4 体内脂肪质量及脂/体比 解剖后取双侧肾周围脂肪和睾丸周围脂肪,并称质量,然后计算脂肪与体质量之比。动物体质量为禁食后的体质量。脂/体比(%)=(肾周围脂肪质量+睾丸周围脂肪质量)/动物体质量×100%。
1.5.5 血生化指标 制备大鼠血清,检测血糖和血脂水平,包括GLU、TG、TC、HDL-C和LDL-C。
1.6 结果分析及统计处理方法
对上述观测指标及检测项目进行综合分析,评价肥胖模型是否成功。数据以x-±s表示,采用SPSS 17.0统计软件进行t检验,比较空白对照组和模型组的差异、两品种大鼠之间的差异是否有统计学意义;对体质量增加、Lee’s指数和肥胖及肥胖敏感性的相关性进行分析,并比较喂养2周时剔除体质量增加分别排在后1/3、10%、20%的大鼠后体质量增加与肥胖的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
空白对照组和模型组大鼠的一般状况良好,精神、皮毛、饮水和运动等均未见异常;模型组大鼠的食欲降低,摄食量低于空白对照组;模型组大鼠的粪便量少于空白对照组,颜色稍浅,质地较硬。SD和Wistar大鼠之间无明显差异。
2.2 高热量饲料对大鼠体质量、体长和Lee’s指数的影响
结果见图1。实验期间,SD大鼠和Wistar大鼠的体质量、体长均正常增长;其中在第5周和实验结束时,模型组大鼠的体质量比空白对照组明显增加,体质量总增加值也明显大于空白对照组,差异有统计学意义(P<0.05或P<0.01)。SD大鼠在实验结束时,Wistar大鼠在第5周、第6周和实验结束时,模型组大鼠的Lee’s指数比空白对照组明显增加,差异有统计学意义(P<0.05或P<0.01),说明肥胖模型建立成功。SD大鼠和Wistar大鼠在其他时间的体质量、Lee’s指数和整个实验期间的体长,以及空白对照组和模型组之间相比,差异均无统计学意义(P>0.05)。
实验期间,空白对照组Wistar大鼠的体长在第0、2、3、5周时大于SD大鼠,Lee’s指数在第0、5、6周时小于SD大鼠,差异有统计学意义(均P<0.05);空白对照组Wistar大鼠的体质量、体质量总增加值与SD大鼠比较,无明显差异(P>0.05)。在整个实验期间,模型组Wistar大鼠的体质量、体质量总增加值、体长、Lee’s指数与SD大鼠比较,差异均无统计学意义(P>0.0 5)。
2.3 高热量饲料对大鼠摄食量、食物利用率的影响
结果见图2。实验期间,SD大鼠和Wistar大鼠的周摄食量逐渐增加,食物利用率逐渐降低;与空白对照组比较,模型组大鼠的周摄食量和总摄食量减少,周食物利用率和总食物利用率升高,差异有统计学意义(均P<0.01);但空白对照组和模型组大鼠的摄入总热量无明显差异(P>0.05)。结果说明高热量饲料影响动物摄食。
实验期间,空白对照组Wistar大鼠的周食物利用率在第2周和第5周时小于SD大鼠,差异有统计学意义(均P<0.05);空白对照组Wistar大鼠的周摄食量、总摄食量、总食物利用率和摄入总能量与SD大鼠比较,无明显差异(P>0.05)。模型组Wistar大鼠的周摄食量、周食物利用率、总摄食量、总食物利用率和摄入总能量在整个实验期间与SD大鼠比较,均无明显差异(P>0.05)。
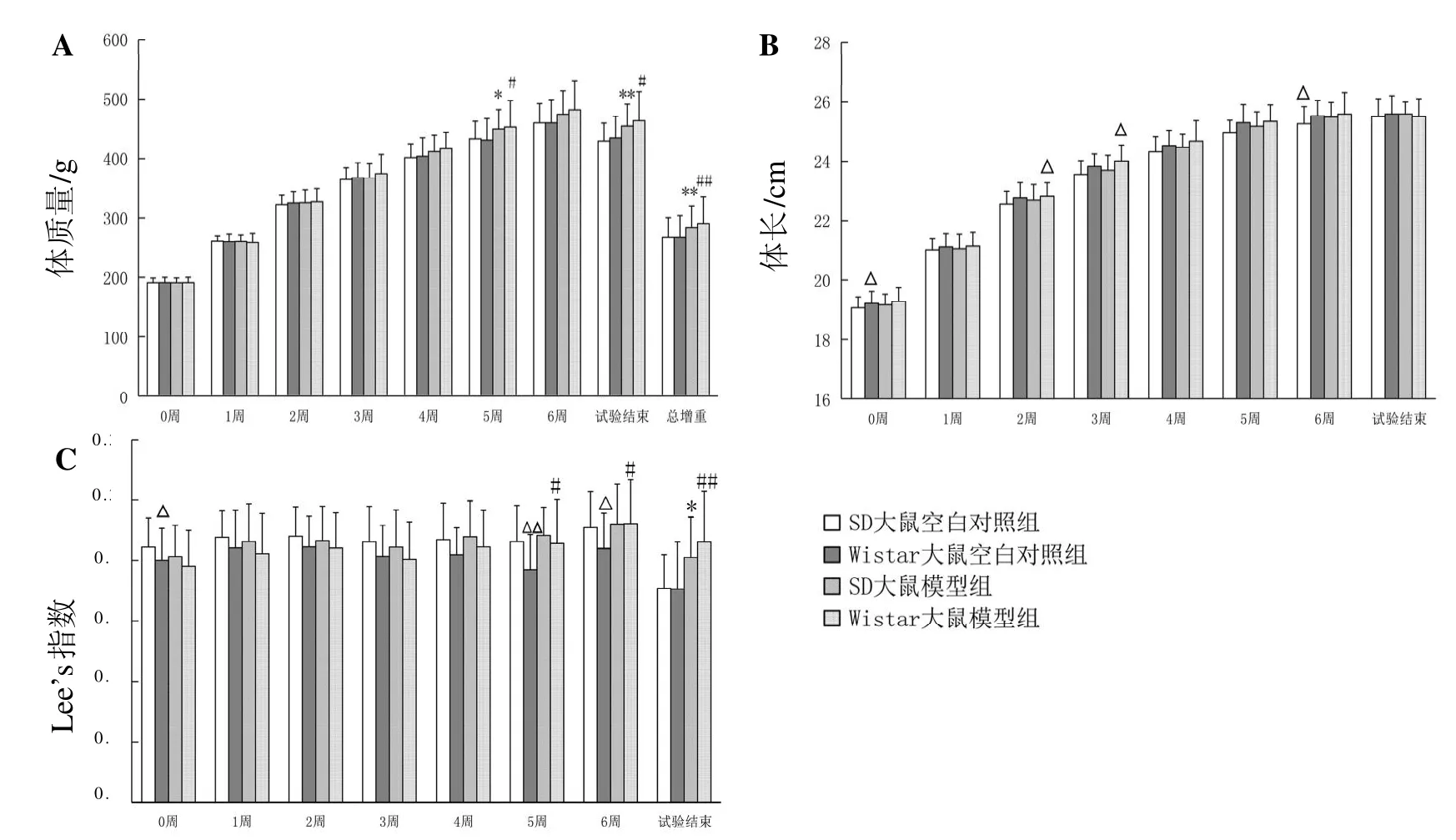
图 1 SD大鼠、Wistar大鼠的体质量(A)、体长(B)及Lee’s指数(C)Figure 1 Body weight (A), body length (B) and Lee's index (C) in SD rats and Wistar rats
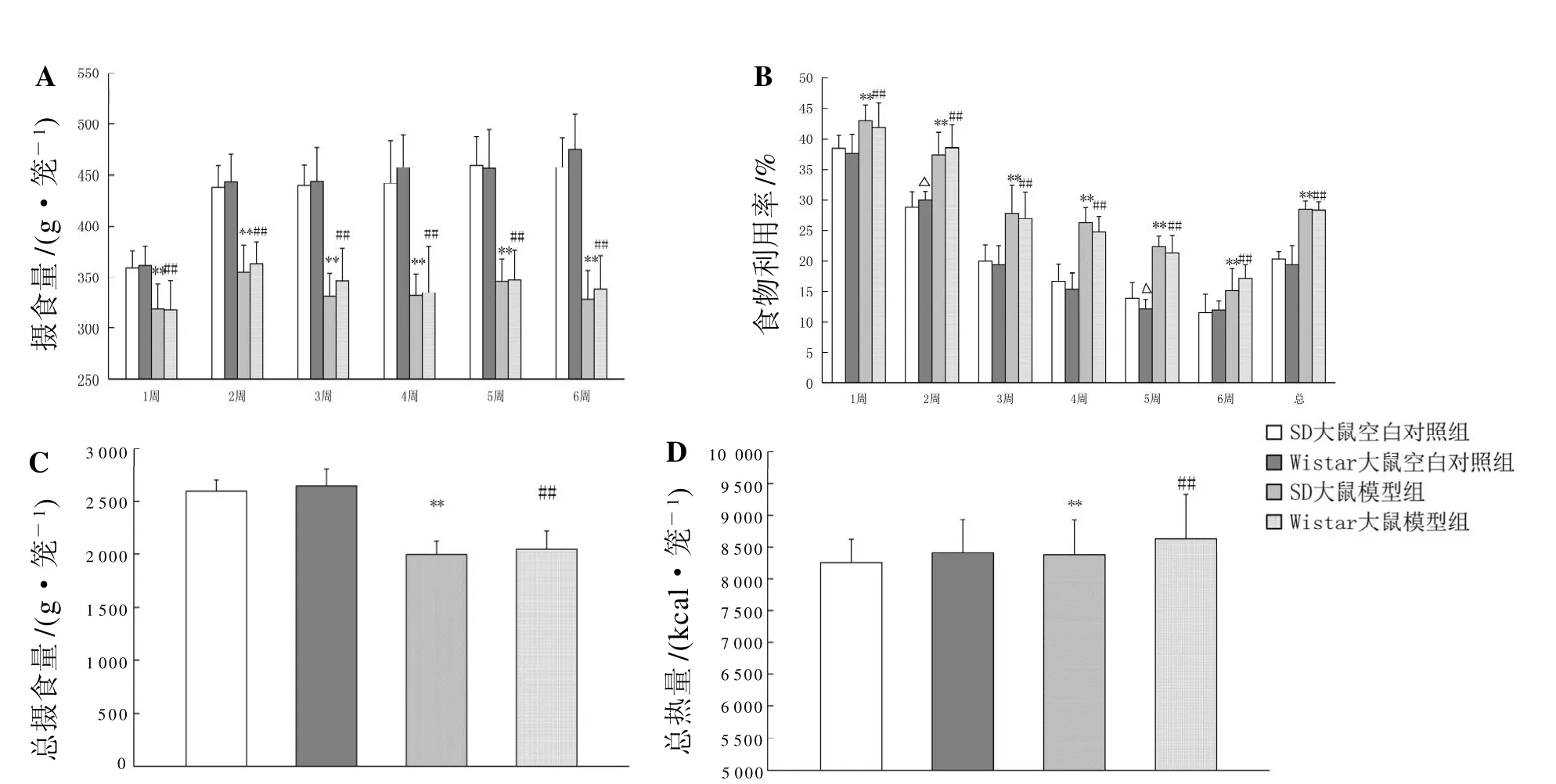
图 2 SD大鼠、Wistar大鼠的周摄食量(A)、周食物利用率(B)、总摄食量(C)及摄入总热量(D)Figure 2 Food intake (A) and food utilization (B) in every week as well as the total food intake (C) and total calorie intake(D) in SD rats and Wistar rats
2.4 高热量饲料对大鼠体内脂肪质量和脂/体比的影响
结果见图3。与空白对照组比较,SD大鼠和Wistar大鼠在喂养2周和喂养6周(实验结束)时模型组的体内脂肪质量(肾周脂肪、睾周脂肪)及脂/体比均明显升高,差异有统计学意义(均P<0.0 1),说明肥胖模型建立成功。
在喂食2周和喂养6周(实验结束)时,SD大鼠空白对照组及模型组的肾脏周围脂肪质量、睾丸周围脂肪质量、体内脂肪质量(肾周+睾周)、脂/体比与Wistar大鼠比较,差异均无统计学意义(P>0.0 5)。
2.5 高热量饲料对大鼠血糖和血脂水平的影响
结果见图4。与空白对照组比较,SD大鼠模型组在喂养2周时GLU水平升高,喂养6周时GLU、TG和LDL-C水平升高,HDL-C水平降低,差异均有统计学意义(均P<0.01);Wistar大鼠模型组在喂养2周时HDL-C水平降低,喂养6周时GLU和TG水平升高,而HDL-C水平降低,差异均有统计学意义(均P<0.01)。结果说明高热量饲料引起血糖和血脂水平升高,肥胖模型建立成功。
Wistar大鼠空白对照组在喂食2周和6周(实验结束)时的血清LD L-C水平与SD大鼠比较,差异有统计学意义(P<0.05);Wistar大鼠空白对照组的GLU、TG、TC和HDL-C水平与SD大鼠比较,无明显差异(P>0.05)。Wistar大鼠模型组的各项生化指标在喂食2周和喂养6周时与SD大鼠比较,差异均无统计学意义(P>0.0 5)。
2.6 体质量增加、Lee’s指数与体内脂肪质量的相关性
结果见表3。在喂食2周和喂食6周(实验结束)时,将大鼠的体内脂肪质量与体质量增加值进行相关性分析,发现无论是所有大鼠(对照组+模型组)还是仅模型组大鼠都呈明显相关性(P<0.01)。而将大鼠的体内脂肪质量与Lee’s指数进行相关性分析,发现Wistar大鼠在喂食2周和6周时呈明显相关,SD大鼠在喂食6周时呈明显相关,而喂食2周时不相关,且体内脂肪质量与体质量增加的相关系数均大于与Lee’s指数的相关系数(P<0.0 5或P<0.0 1)。
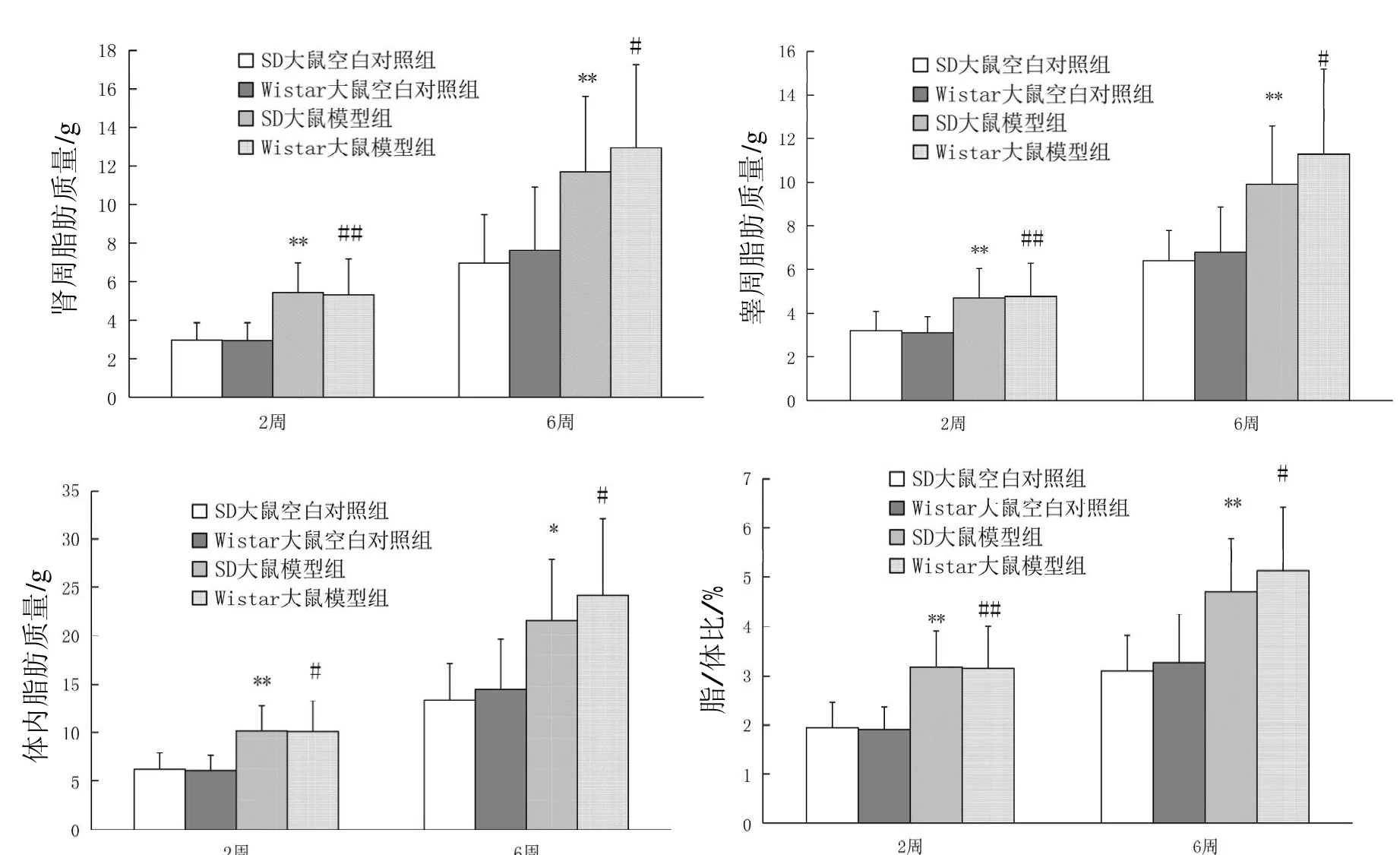
图 3 SD大鼠、Wistar大鼠的脂肪质量及脂/体比Figure 3 Body fat weight and fat/body weight ratio in SD rats and Wistar rats
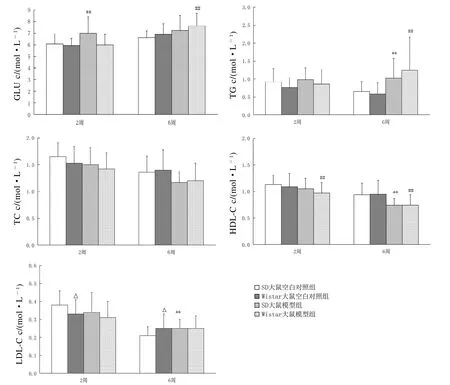
图 4 SD大鼠、Wistar大鼠的血生化指标Figure 4 The biochemical indicators in SD rats and Wistar rats
2.7 体质量增加、Lee’s指数与肥胖敏感相关性
结果见表4。将喂食2周时大鼠的体质量增加与实验结束时大鼠的体内脂肪质量、体质量增加、体质量进行相关性分析,结果发现无论是所有大鼠(对照组+模型组)还是仅模型组大鼠都呈明显相关性。而将喂食2周时大鼠的Lee’s指数与实验结束时大鼠的体内脂肪质量、体质量增加、体质量进行相关性分析,发现SD大鼠和Wistar大鼠的Lee’s指数与体质量、体质量增加呈明显相关,Wi s t a r大鼠的Lee’s指数与体内脂肪质量呈明显相关,SD大鼠的L e e’s指数与体内脂肪质量不相关。而且,除了Wistar大鼠的Lee’s指数与脂肪质量的相关系数(0.738)大于与0~2周体质量增加的相关系数(0.693)外,实验结束时体内脂肪质量、体质量增加、体质量与0~2周体质量增加的相关系数均大于与Lee’s指数的相关系数(P<0.0 5或P<0.0 1)。
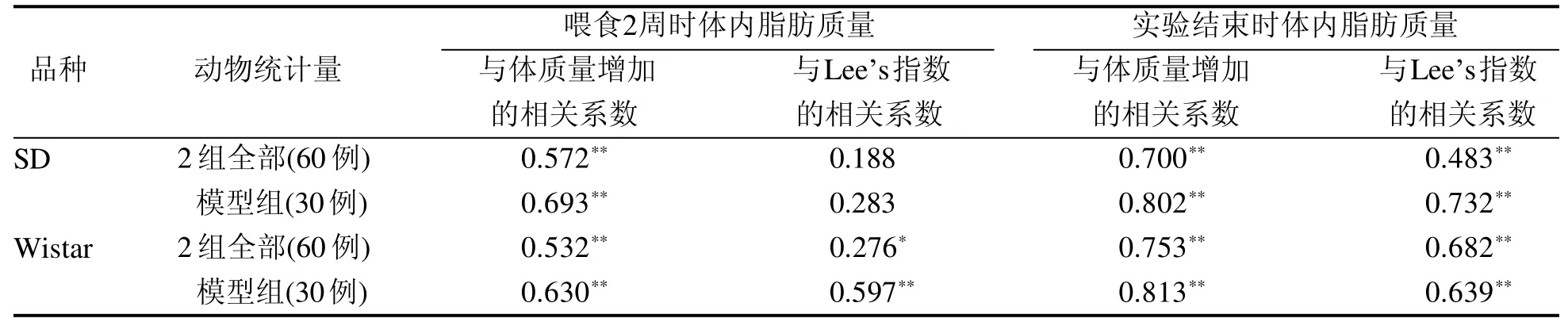
表 3 大鼠体质量增加、Lee’s指数与肥胖的相关性分析Table 3 Analysis of the correlation of weight gain, Lee’s index with obesity in rats
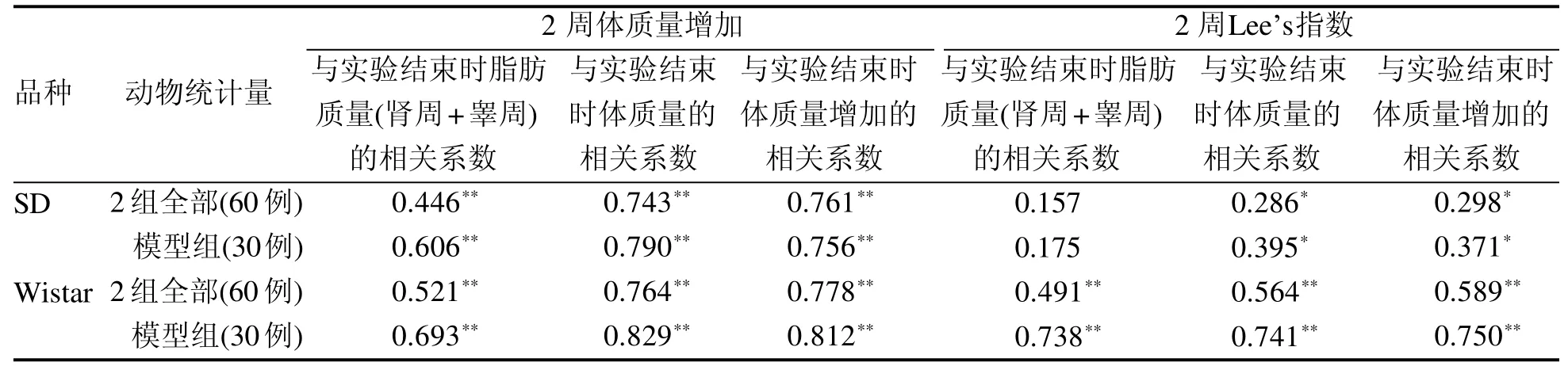
表 4 大鼠体质量增加、Lee’s指数与肥胖敏感的相关性分析Table 4 Analysis of the correlation of weight gain, Lee’s index with obesity sensitivity in rats
2.8 不同的剔除范围大鼠体质量增加与肥胖的相关性
结果见表5。将模型组大鼠喂食2周后的体质量增加值按大小顺序排列,分别剔除排在后1/3、10%、20%的大鼠,然后将剩余大鼠的2周时体质量增加值与肥胖指标(即实验结束时的体内脂肪质量、大鼠体质量、体质量增加值)进行相关性分析,结果显示不同剔除范围的SD大鼠和Wistar大鼠2周时体质量增加与肥胖的相关系数大小排序均为:剔除10%>剔除20%>剔除1/3,即剔除10%或20%比剔除1/3的相关性更好,其中剔除10%的相关系数最高,说明筛选肥胖敏感动物时可选用喂食2周时剔除体质量增加排在后10%的大鼠的方法。
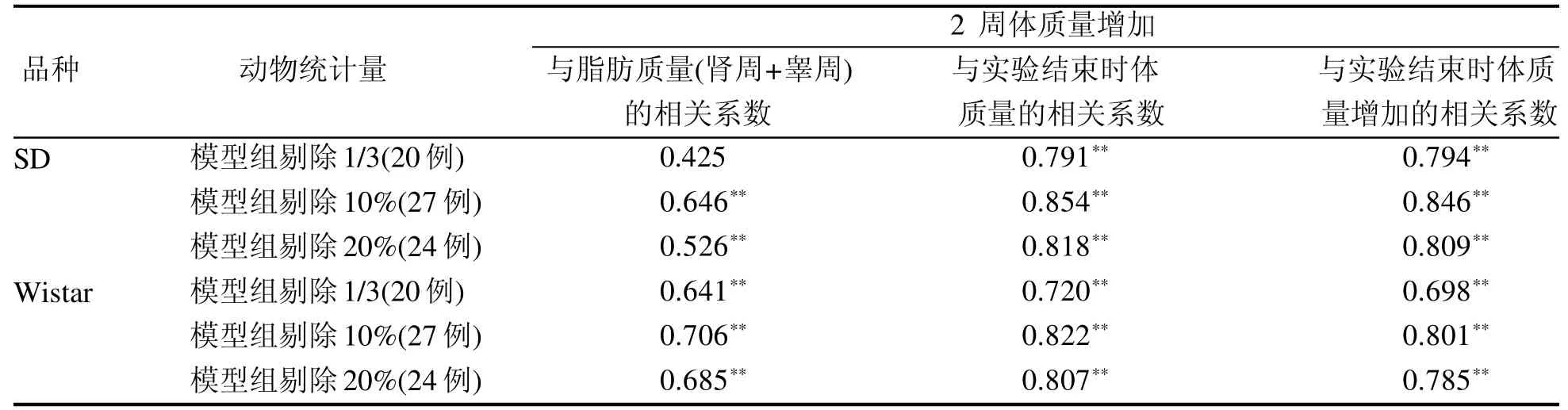
表 5 不同剔除范围的大鼠体质量增加与肥胖相关性分析Table 5 Analysis of the correlation between weight gain and obesity after eliminating different weight gain rats
4 讨论
高脂膳食诱导的肥胖大鼠模型在肥胖研究中应用非常广泛[9],模型饲料的配方是影响致肥胖效果的重要因素。然而,文献报道的构建大鼠肥胖模型所使用的饲料配方成分种类较多,造模效果良莠不齐[10-12]。我国评价减肥功能性保健食品所采用的高热量模型饲料配方为“在维持饲料中添加15.0%蔗糖、15.0%猪油,适量的酪蛋白、磷酸氢钙、石粉等。除了粗脂肪外,模型饲料的水分、粗蛋白、粗脂肪、粗纤维、粗灰分、钙、磷、钙∶磷均要达到维持饲料的国家标准”;由于该配方中猪油含量很高,饲料质地柔软、难以成形,在实验过程中大鼠不易啃食,浪费严重,成模效果不佳。因此,本研究在传统配方中维持猪油和蔗糖的比例不变,添加酪蛋白以维持蛋白质的营养比例,增加麦芽糊精并调整饲料加工工艺,使模型饲料硬度适中、不易碎;用改良的模型饲料喂食大鼠,观察大鼠的进食情况和致肥胖效果。结果表明,SD和Wistar两品种大鼠在喂食6周高热量模型饲料后,体质量增加,体质量增加值增加,体内脂肪质量及脂/体比增加,血糖血脂升高,说明肥胖模型制备成功。在实验过程中,动物出现摄食量比空白对照组减少,这可能是模型饲料的气味和口感偏油腻所致;但模型组的食物利用率明显升高,说明高热量饲料在体内转化为脂肪,致使体质量增加,形成肥胖。因此,可认为改良的模型饲料适合肥胖模型的建立。
在传统的肥胖动物模型中,一般采用同一品种的大鼠经高脂饲料直接诱导而成。然而,国内常用的SD和Wistar大鼠品种间是否存在差异,尚未见报道。本研究比较了两种大鼠在体质量、体长、Le e’s指数、摄食量、食物利用率、体内脂肪质量及脂/体比、血生化指标等的差异,结果发现两品种的模型组差异均无统计学意义,说明在建立肥胖模型的过程中,选择SD或Wistar大鼠均可。但是,两品种的空白对照组大鼠体长、Lee’s指数、食物利用率和LDL-C水平在某些时间点出现差异,可能与维持饲料饲养第0周(试验开始)时SD大鼠和Wistar大鼠的生理指标就存在差异有关,导致生长曲线和生化指标出现差异。
目前,国内外没有判定肥胖动物模型成功的统一标准,大多以超过空白对照组平均体质量百分比、体质量增加值、脂/体比和Lee’s指数等指标来判定建模是否成功[13-15]。动物体内脂肪质量增加可直接说明动物肥胖,因此本研究比较了体质量增加、Lee’s指数与体内脂肪质量的相关性。结果发现,两品种的大鼠在喂食2周(肥胖敏感筛选期)和喂食6周(实验结束)时的体质量增加与体内脂肪质量的相关性高于Lee’s指数与体内脂肪质量的相关性,因此用体质量增加评价肥胖比Lee’s指数更优。
随着肥胖领域的研究不断进展,越来越多的研究倾向于在建立肥胖模型过程中将肥胖抵抗的大鼠从肥胖易感大鼠中剔除,从而使肥胖模型更具有代表性。Levin等[16]首次在诱导肥胖模型中将肥胖易感大鼠和肥胖抵抗大鼠进行了区分。本研究比较了在肥胖敏感筛选期(喂食2周)大鼠体质量增加、Lee’s指数分别与实验结束(喂食6周)时体质量、体质量增加和体内脂肪质量的相关性,结果发现两品种的大鼠在喂食2周时体质量增加明显高于Lee’s指数的相关系数,因此用喂食2周时大鼠体质量增加作为筛选肥胖敏感大鼠的指标。另外,本研究还比较了剔除不同范围体质量增加的大鼠后体质量增加与实验结束(喂食6周)时大鼠体质量、体质量增加、脂肪质量的相关性,结果表明两品种的模型组大鼠在喂食2周时剔除10%或20%比剔除1/3的相关性更好,以剔除10%最优。因此,淘汰动物时数量可减少,以避免实验动物的浪费。
综上所述,两品种大鼠喂食改进的高热量饲料均可成功建立肥胖模型,且SD大鼠和Wistar大鼠在造模效果上无明显差异;选用体质量增加作为肥胖评价和肥胖敏感筛选的指标优于Lee’s指数,且剔除体质量增加排在后10%的大鼠即可与成功建立肥胖模型有较好的相关性。
