斑马鱼作为模式动物在人类眼睛疾病研究中的应用
2020-11-27邸亚男朱丽英
邸亚男,朱丽英,钱 雯,潘 卫,3,4
(1. 北京大学第三医院北方院区检验科,北京 100089;2. 贵州医科大学医学检验学院,贵阳 550025;3. 贵州医科大学附属医院贵州省产前诊断中心,贵阳 550025;4. 贵州医科大学环境污染与疾病监控教育部重点实验室,贵阳 550025)
视力损害是危害人类健康的主要公共卫生问题之一。据统计,至2010年全球范围内大约有2.85亿人伴有不同类型及程度的眼睛疾病,其中约有0.39亿人失明[1]。视力损害的主要病因有屈光不正、白内障、年龄相关性黄斑变性、糖尿病视网膜变性和青光眼[2]。虽然眼睛疾病很少危及生命,但对个人、家庭及社会造成了巨大影响。因此,眼睛疾病的防治非常重要。然而,目前许多眼睛疾病的发病机制不明确,并且缺乏有效的治疗方法。因此,能够有效复制人类眼睛疾病且用于快速高通量药物筛选的模式生物具有十分重要的应用价值。
作为一种新兴模式生物,斑马鱼(Zebrafish,Danio rerio)已经被广泛用于人类血液系统疾病、肌肉系统疾病、中枢神经系统疾病、心脏疾病、肾脏疾病及眼睛疾病等的研究[3]。目前,斑马鱼信息网络(zebrafish information network,ZFIN)已经收录了大量斑马鱼突变品系及转基因品系的相关信息。由于斑马鱼在眼睛形态、解剖结构、基因表达及功能等方面与人类存在着极大的相似性,并且具有发育快、体外受精、胚胎透明、易于观察等优势,因此其在眼睛发育及疾病的研究中具有重要意义。
随着基因编辑技术、表型精细筛选技术、行为学观察技术和基因及其功能鉴定技术的发展,斑马鱼作为模式动物在眼睛疾病中的应用越来越广泛,已被用于眼睛缺损、青光眼、白内障、视杆视锥细胞变性和糖尿病视网膜病变等眼睛疾病的研究[4]。除此之外,斑马鱼模型能够实现高通量和高效率的药物筛选,可为筛选治疗眼睛疾病的药物提供良好的平台[5]。本文对斑马鱼的生物学及基因组学特性、眼睛发育及结构,以及作为研究眼睛疾病模型的优缺点等进行综述。
1 斑马鱼的生物学及基因组学特性
斑马鱼属鲤科热带淡水鱼,原产于印度恒河流域。野生型斑马鱼体梭形,体侧具有5~7条纵向暗蓝与银色相间条纹,为低温低氧鱼,耐寒性和耐热性都很强。斑马鱼为杂食动物,以浮游生物和昆虫为食,人工喂养以蛋黄和轮虫等为食,成鱼可喂丰年虾和红虫等。斑马鱼繁殖周期短,多为7 d左右,若温度适宜,一年四季均产卵。雌雄鱼交配行为受光照刺激,可通过调控光周期或控制雌雄鱼的接触,实现产卵时间控制。每尾雌鱼每次产卵可达200~300枚,为非黏性沉性卵,直径大约0.7 mm,因其密度比水大而沉于缸底。卵细胞体外受精,体外发育且速度快,胚体透明[6]。鱼卵受精后24 h,其主要器官已经基本形成;3 d后幼鱼逐渐从卵壳孵出,并开始游动和觅食;大约3~4个月时,幼鱼达到性成熟,可以繁殖后代[7]。斑马鱼生长发育非常快。成鱼体长约3~5 cm,寿命2~3年。
斑马鱼品系众多,常用的主要是野生型Tuebingen品系、AB品系、WILK品系及多个突变品系和转基因品系[8]。目前主要的斑马鱼保存机构有国际斑马鱼资源中心 (Zebrafish International Resource Center,ZIRC)、中国斑马鱼资源中心(China Zebrafish Resource Center,CZRC)、依托于北京大学和清华大学的国家斑马鱼模式动物北方中心,以及南方医科大学肿瘤研究所-香港科技大学人类疾病斑马鱼模型研究联合实验室等。
斑马鱼有25条染色体,多为中间着丝粒或端着丝粒。斑马鱼的全基因组约有1.5×109bp,碱基数量约为人类基因组的一半[7]。在英国Sanger研究所主持下,2001年开始了斑马鱼基因组测序,现转由Genome Reference Consortium(GRC)主持。GRC在2014年9月发布了斑马鱼基因组最新版本 Zv10(http://www.ncbi.nlm.nih.gov/assembly/GCF_000002035.5/),且会不断更新。基因注释计划提示,斑马鱼约有26 000个蛋白编码基因[9]。人类70%的蛋白编码基因在斑马鱼中有同源基因。但斑马鱼基因组也有一些与脊椎动物不同的特性,如假基因较少、重复序列较多等[7]。由于在辐鳍鱼进化历程中发生了硬骨鱼类特异的全基因组复制事件(teleost-specific genome duplication,TSD),斑马鱼的蛋白编码基因与人类蛋白编码基因并不是一对一的关系,大多数人的基因在斑马基因组中有两个或多个拷贝[10]。例如,在人类基因组中,SRY 相关 HMG盒转录因子11(SRY-related HMG-box transcription factor 11,SOX11)基因仅存在一个拷贝,而在斑马鱼基因组中则存在两个拷贝:SOX11a和SOX11b[11]。因此,为了更好地利用斑马鱼这种模式生物,需要高质量的斑马鱼基因组学信息,并且将其与人类基因组进行差异分析。
2 斑马鱼的眼睛发育、结构及功能
斑马鱼的发育非常迅速。根据斑马鱼在受精后3 d内的发育形态学变化,可以将其发育过程分为8个大的时期,即受精卵期、分裂期、囊胚期、原肠胚期、体节期、咽裂期及孵化期和幼鱼阶段[12]。脊椎动物的眼睛发育具有严格保守性。眼睛发育大致来源于3种胚胎组织。其中,视网膜、色素上皮、视柄及睫状缘来源于神经外胚层;晶状体和角膜来源于皮肤外胚层;巩膜和角膜的连接组织主要来源于神经嵴起源的头部间质[13]。斑马鱼的眼睛发育顺序也类似于大多数脊椎动物。
斑马鱼眼睛发育的基本过程见图1。约在10 hpf (hours post fertilization,受精后小时数)左右,受精卵第一个体节形成,胚胎发育进入体节期。此时期的胚胎中,包括视原基在内的各个器官原基相继形成;该期持续到24 hpf,大部分器官基本成型,但尚未有功能[12]。视原基起源于前脑的神经龙骨突,于神经龙骨前部延长形成“wing-like”结构,“wing-like”结构通过视柄与前脑相连。约15 hpf时,神经视网膜与色素上皮开始出现;约16 hpf时,晶状体基板开始形成;约24 hpf时,“wing-like”结构旋转并内陷形成视杯,玻璃体动脉通过成形的脉络膜裂进入视杯。在30 hpf时,角膜上皮形成于外胚层表面,并覆盖晶体[14];36 hpf时,视杯嵌入脑部,脉络膜裂开始闭合,基质细胞和韧带覆盖脉络膜;48 hpf时,脉络膜裂完全闭合,视神经延伸至视顶盖;50 hpf时,内核层的无长突细胞和水平细胞开始出现;55 hpf时,外核层视杆和视锥细胞外节形成;60 hpf时,双极细胞出现[15];约72 hpf时,斑马鱼幼鱼具有视觉功能,同时眼周围的肌肉发育成熟并具有功能,这是斑马鱼具有视动功能的先决条件[16]。
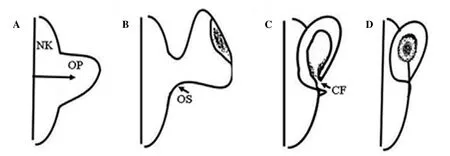
图 1 斑马鱼眼睛发育过程示意图Figure 1 Schematic diagram of eye development in zebrafish
与哺乳动物不同的是,在某种程度上可以说,斑马鱼的视网膜从不会停止发育,成熟斑马鱼的视网膜仍然在增殖。所有类型的视网膜细胞都不断地从睫状缘的周围生发中心产生。另外,视锥细胞也不断地由视锥祖细胞生成。位于内核层的Müller神经胶质细胞可以在视网膜受损伤时,修复产生所有类型的视网膜细胞[17]。另外,啮齿类动物体内存在抑制性因子,而缺乏促生长因子,其视网膜神经节细胞轴突不可再生;与之不同的是,斑马鱼体内存在大量促生长因子,其神经节细胞轴突可再生,从而恢复视功能[18]。
斑马鱼眼睛结构与人类有很大相似性,但也有一定区别(表1,图2),在应用斑马鱼复制人类眼睛疾病时应注意二者的差异。首先,人和斑马鱼的眼睛形状与位置不同。人眼睛为圆形,而斑马鱼眼睛为椭圆形,因而斑马鱼的玻璃体较少。人眼睛位于头面部前方,双眼视觉高度交叉;而斑马鱼眼睛位于头两侧,双眼视觉交叉甚小[19]。其次,人和斑马鱼的视网膜各层厚度不一样。斑马鱼视网膜由6种神经元细胞和Müller神经胶质细胞组成。与人类视网膜相似,斑马鱼视网膜由内向外分为5层(图2A和2B):神经节细胞层、内丛状层(包含双极细胞、无长突细胞和神经节细胞的突触连接[20])、内核层(包含双极细胞、无长突神经细胞、水平细胞胞体和Müller神经胶质细胞胞质[20])、外丛状层(包含感光细胞与双极细胞、水平细胞的突触连接)和外核层(包含感光细胞:视锥和视杆细胞)[14,16,20]。

表 1 人类眼睛和斑马鱼眼睛的差异Table 1 Differences between human eyes and zebrafish eyes
另外,斑马鱼神经节细胞都是有髓鞘的,而人类神经节细胞视网膜部分的突触是脱髓鞘的,只有视神经部分有髓鞘。视网膜在视觉形成过程中发挥着重要作用。外界光线投射到眼球表面,经过屈光介质到达视网膜,并被视网膜上感光细胞捕获,将光信号转化为化学信号,再通过双极细胞传递至视网膜神经节细胞,最后经视神经通路投射到大脑皮层(感光细胞—双极细胞—神经节细胞)。除此之外,该转化后的化学信号还可以通过间接途径,由双极细胞传递给神经节细胞(感光细胞—水平细胞—双极细胞—无突触细胞—神经节细胞)(图2C)[21]。外核层外面有视网膜色素细胞上皮(r e t i n a l p i g m e n t e d epithelium,RPE)层包裹。RPE主要功能是为视网膜提供营养物质、氧化应激调控和维持感光细胞外节的代谢。在发育过程中,RPE的缺陷可导致眼缺损、小眼畸形及无眼等眼睛疾病[13]。
斑马鱼的感光细胞即视锥细胞和视杆细胞的形态学特点与人类相似,由胞体和顶端域构成。顶端域由一个近端内节和一个远端外节构成。其中,外节由膜盘堆积而成,包含能捕获光量子的视蛋白。外节可脱落并更新,脱落的顶端被相邻的RPE吞噬[13,22]。斑马鱼和人类均是昼行性动物,其白天视力主要由视锥细胞控制。与夜行性啮齿类动物如小鼠和大鼠等不同,斑马鱼的视力几乎全部由视锥细胞控制[23]。斑马鱼的视锥细胞分为4种,分别是短单(紫外线敏感)、长单(蓝光敏感)、长双(红光敏感)和短双(绿光敏感)(图2 D)[20]。这4种视锥细胞以“马赛克(mosaic)”模式排列,即成排分布的双锥细胞和单锥细胞交替排列[24]。由于斑马鱼具有4种视锥细胞,所以可产生四色视觉;而人类缺乏紫外线-敏感视锥细胞,只有三色视觉[25-26]。斑马鱼的视杆细胞只有1种,并且以视紫红质为发色团。另外,需要说明的是,虽然斑马鱼的视网膜在5 dpf时形态学发育上已经完善,但至少在15 dpf时才能发挥功能[23]。
眼前段结构(角膜、晶体、虹膜、睫状体和角膜虹膜角)是光线进入眼睛到视网膜的途径,对调节眼内压有重要作用。斑马鱼的眼前段结构与高级脊椎动物相似,但亦存在差异。斑马鱼的虹膜基质缺乏肌细胞,不具有收缩能力,无环状肌。与虹膜前部相连的部位被称为睫状区,而非睫状“体”。睫状上皮功能具有背腹差异,背侧睫状上皮主要是产生房水,而腹侧则是房水排出通路[27]。斑马鱼的房水回流机制与人类亦存在差异。另外,斑马鱼的小梁网基质组成及超微结构也和人类有区别[28]。因此,在利用斑马鱼研究人类眼睛疾病时应注意以上差异。
3 斑马鱼作为眼睛疾病模型的优势
3.1 斑马鱼作为模式生物的一般优势
自从遗传学家George Streisinger将斑马鱼用于人工雌核的发育研究[3]后,斑马鱼作为模式生物逐渐引起了人们的极大关注。斑马鱼作为模式生物具有以下优点:(1)体型小且价廉,适于大规模养殖;(2)产卵量大,发育快,生长周期短,3~5个月性成熟即进入繁殖期;(3)胚胎透明,体外受精和发育,易于观察和操作;(4)斑马鱼基因组与人类基因组相似度很高,且其基因表达序列标签(expressed sequence tags,ESTs)足够多,已有约7万个ESTs被鉴定(http://danio.mgh.harvard.edu/chrMarkers/zfssr.html);(5)斑马鱼可用于大规模药物或化学分子的高通量筛选;(6)品系资源丰富;(7)精子可以冷冻保存[29]。
3.2 斑马鱼作为眼睛疾病模型的独特优势
斑马鱼在眼睛疾病研究中具有独特的优势。例如,其体型相对较小,但眼睛比较大,易于观察和操作;眼睛发育快,72 hpf已具有功能。斑马鱼作为模式生物越来越多地用于眼睛和视力相关疾病的遗传筛选和表型筛选。
传统的遗传筛选方法大致可分为正向遗传学和反向遗传学。正向遗传学一般是通过生物体的自发突变或人工诱变,寻找表型遗传的突变个体,从而找到对应的突变基因,并揭示其功能。通过该方法往往可以找到新基因。目前,利用该技术已经筛选并鉴定了影响眼睛和视力的相关疾病的大量基因[30]。人工诱变的方法有放射线导致基因缺失或突变,以及各种化学诱变剂诱导基因发生点突变。常用的化学诱变剂有乙基亚硝基脲(ethylnitrosourca,ENU)。ENU通过对DNA碱基烷基化,诱导DNA复制时发生错配或碱基置换,产生单个核苷酸突变;其突变效率高,突变具有随机性,无倾向性[31]。另外,用于正向遗传筛选的策略包括反转录病毒或基因诱捕技术介导的大规模插入突变,这种策略也被相继应用到斑马鱼的基因突变研究中。Goss等[32]利用反转录病毒介导的插入突变技术筛选到了40个与视觉系统发育和功能有关的基因,如Cyclin A2、MCM2和NRR-1等。
反向遗传学,即通过基因敲除或转基因技术改变某个特定基因的功能,寻找有关的表型变化。用于斑马鱼反向遗传学研究的有定向诱导基因组突变技术(targeting induced local lesions in g e n o m e s,T I L L I N G)、R N A干扰(R N A interference,RNA i)技术、反义寡核苷酸(morpholino,MO)、锌指核酸酶(zinc finger nucleases,ZFN)技术、类转录激活样效应因子核酸酶(transcription activator-like effector nuclease,TALEN)和成簇的规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及其相关蛋白9(CRISPR-associated protein 9,Cas9)技术[30]。Lee等[33]利用MO技术敲低Bcl6a基因表达,引起斑马鱼眼睛缺损。CRISPR/Cas9作为新兴的基因编辑技术,在反向遗传学及基因治疗方面也具有重大价值;目前该技术的应用已扩展到先天性白内障、先天性青光眼、视网膜色素变性等遗传性眼睛疾病的基因治疗[34]。
事实上,目前有多个实验室和机构在开展斑马鱼模式生物相关的基因突变研究工作(表2),如Sanger研究所资助的ZMP计划(Zebrafish Mutation Project)、欧盟资助的ZF-HEALTH计划(Zebrafish Regulomics for Human Health)、国际斑马鱼诱捕协会的多家实验室通过插入诱变获得的突变库(即zifishbook插入突变数据库)等。另外,有一些网络在线免费工具可以用来搜寻和设计特定基因突变斑马鱼所需要的靶点,如ZIFIT(Zinc Finger Targeter,http://zifit.partners.org/ZiFiT/)可以用来搜寻和设计ZFN、TALEN和CRISPER等基因编辑技术所需的靶点序列,Mojo Hand(http://talendesign.com/mojohand.main.php)可以用来搜寻和设计TALEN所需的靶点序列。

表 2 斑马鱼基因突变研究计划常用的突变技术和数据库及网站链接Table 2 Mutation technologies, databases and website links of zebrafish gene mutation research programs
目前,斑马鱼的表型筛选主要是通过形态学、视觉行为学、成像系统及基因表达进行的。从形态学观察眼睛的大小、形状与位置以及色素表达等是比较简单和直接的方法。斑马鱼可以通过周围光线情况调节其色素表达,若其视觉有问题而不能感受光线变化,则其色素表达量比正常多,利用这种特点可以进行视觉损伤的筛选。另外,目前国际斑马鱼资源中心有大量标记斑马鱼眼睛组织的抗体(http://zfin.org/action/antibody/search),可以用免疫组织化学法来进行相应抗原的检测。斑马鱼行为学观察是筛查其视力损害的有效方法,包括观察视动和眼动行为学变化、惊恐反应、逃避反应、趋光反应和背光反应等[35]。但需要注意的是,行为学观察法具有一定的局限性,例如肌肉损伤影响斑马鱼的运动功能时,可能会错误地认为是视觉损伤。因此,为了确保结果可靠性,可以应用另外的方法来确证,如可以应用视网膜电图进行视网膜功能的检测[36]。
4 斑马鱼模型在眼睛疾病研究中的应用
目前,斑马鱼已经作为模式生物成功地应用于多种眼睛疾病的研究中。Neuhauss等[37]利用视动和眼动视觉行为观察了450尾基因突变斑马鱼,并从色素形成和组织形态等方面鉴定其眼睛损害,最后发现了多种引起视力损害的基因突变,包括晶体异常基因(SANDY)、轴突生长异常基因(GRUMPY、SLEEPY、PINSCHER)和视网膜神经节细胞缺失基因(LAKRITZ)等。Gross等[32]对利用反转录病毒诱导插入突变的250尾斑马鱼进行了眼睛形态学及视觉行为学检测,最后发现了40个引起眼睛发育异常和/或视觉功能损害的突变位点,如与早期眼睛发育形态有关的NDR2,与感光细胞损伤有关的NRF1、IXL和PWI。另外,截至目前,已经利用基因突变成功建立了先天性白内障、青光眼、糖尿病视网膜病、老年黄斑变性及先天性眼球震颤等眼睛疾病的斑马鱼动物模型[38]。例如,叉头转录因子1基因主要表达在眼前段及眼周间质细胞中,与眼前段的发育与形态维持有关,该基因的缺陷可以引起斑马鱼类似青光眼表型的病理改变,如虹膜、小梁网和角膜异常[39]。低密度脂蛋白受体相关蛋白2基因突变可引起斑马鱼眼睛变大、眼压升高及视网膜神经节细胞数量逐渐减少等类似青光眼病变[40]。与人眼睛疾病相关的斑马鱼模型及基因突变和诱导方式总结见表3。
5 总结
视力损害是全球范围内广受关注的公共卫生问题之一,研究其病理机制及治疗方法十分重要。由于斑马鱼的眼睛发育及形态结构等与人类有相似性,并具有易于繁殖、生长发育较快、眼睛较大、易于观察等优势,斑马鱼成为了研究人类视力损伤的一种理想模式生物。同时也应该注意到其与人类眼睛的差异,比如斑马鱼是四色视觉,而人类是三色视觉,从而在利用斑马鱼模型进行人类眼睛疾病相关研究时设计实验更科学,得出结论更严谨。
表 3 与常见眼睛疾病相关的斑马鱼模型Table 3 Zebrafish models related to common eye diseases
