番鸭产蛋前期和产蛋期肝脏组织非靶向代谢组学比较分析
2020-11-26朱文俊杨万里韦聪聪耿照玉陈兴勇
朱文俊 杨万里 韦聪聪 刘 乐 耿照玉,2 陈兴勇,2*
(1.安徽农业大学 动物科技学院,合肥 230036;2.安徽农业大学 地方畜禽遗传资源保护与生物育种安徽省重点实验室,合肥 230036)
番鸭为优良瘦肉型鸭,具有生长快、体重大、耐粗饲和肉质好等特点,但其繁殖性能差,产蛋率低,且产蛋量在个体间存在显著差异[1]。肝脏为机体物质代谢主要器官,在脂质合成、降解和运输过程中起重要作用[2]。不同于哺乳动物,禽类脂质约90%于肝脏中合成。激素刺激肝脏合成低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)等脂类物质,通过血液运输转运到机体各部位。肝脏合成的脂类经受体介导沉积于卵泡中,促进等级前和等级卵泡发育[3]。此外,甘油磷脂、胆固醇、甘油三酯、载脂蛋白B等在产蛋期肝脏中大量合成[4-5],可能与卵黄前体物形成和卵泡发育密切相关。推测,产蛋前后肝脏物质合成差异可能在卵黄前体物合成过程中发挥重要作用。
已有研究表明家禽产蛋前后肝脏组织基因差异表达。Li等[2]比较鸡产蛋前后(20和30周龄)肝脏脂质代谢相关基因表达谱及相关通路差异,发现差异表达基因在氧化还原、甾醇和胆固醇代谢过程、脂质生物合成过程中显著富集,表明产蛋时期肝脏转录组水平大部分变化与脂肪代谢密切相关;Bourin等[6]采用转录组学方法定义肝脏中与卵黄生成有关蛋白酶和抗蛋白酶基因,发现3个蛋白酶和反蛋白酶可能参与蛋黄形成。Li等[7]使用转录组学比较IncRNA在产蛋前期和产蛋期蛋鸡肝脏表达差异,发现一系列与鸡肝脏脂质代谢相关的IncRNA;IncLTR受通过ERβ信号传导的雌激素调控,与鸡屠宰性状和血液甘油三酯含量有关。尽管前人在家禽产蛋前后对肝脏组织进行转录组相关分析,解释产蛋前后基因转录水平表达差异,但受基因表达和翻译水平调控影响,产蛋前后肝脏转录组学研究不能完全解释其参与肝脏代谢物合成的产物类型。
非靶向代谢组学(Nontargeted metabolomics, NTM)通过检测一定质量范围内所有离子,包括结构独特代谢物离子,为生物机体提供一个无偏倚的整体代谢物谱[8-9]。靶向代谢组学只对有限的几个或几类与生物学事件相关的代谢物进行分析和研究,因此无法检测未知代谢物。NTM可有效捕捉机体生命活动过程中的细微变化,目前已成为畜禽育种、食品安全等领域研究的重要工具,包括畜禽经济性状育种价值评估、畜禽产品安全性评价和动物医学模型使用等。Wen等[10]使用UHPLC-MS非靶向代谢组学测定冷藏鸡肉质量,发现随着冷藏时间的延长,大多数氨基酸丰度降低,而组胺、酪胺、色氨酸和N-乙酰半胱氨酸等丰度增加。Yuan等[11]通过UHPLC-MS非靶向代谢组学分析发现鸡十二指肠中几种糖类如纤维二糖,甘露糖和阿洛糖可能与苍白杆菌和红球菌共同降解木质纤维素有关。本研究采用UPLC-MS非靶向代谢组学技术,分析产蛋期与产蛋前期肝脏代谢物谱差异,为肝脏代谢物在卵泡发育中的调控机制提供新的研究视角。
1 材料与方法
1.1 试验材料
产蛋前期(22周,2 152±73 g,TT 对照组)和产蛋期(40周,2 760±94 g,FT试验组)的健康番鸭各12羽地面平养于安徽安庆永强农业开发股份有限公司种鸭场。22周种鸭光照11 h/d,采食量103 g/d;40周龄种鸭光照17 h/d,采食量160 g/d,各饲养阶段的营养水平均按国家研究委员会(NRC)标准进行[12]。屠宰后,快速收集肝右叶样本于液氮中保存,后转移至超低温冰箱中储存备用。
1.2 样品前处理
肝脏组织样本前处理方法按照He等[13]方法制备,并做适当修改。准确称取30 mg肝脏组织样本转移至1.5 mL EP管,加入内标(L-2-氯苯丙氨酸,0.3 mg/mL;Lyso PC 17∶0,0.01 mg/mL)各20 μL,加入甲醇-水溶液(V∶V=4∶1)400 μL。-20 ℃预冷样品2 min后,于全自动样品快速研磨仪中60 Hz研磨2 min。冰水浴中超声10 min后于-20 ℃环境下静置20 min。13 000 rpm、4 ℃离心10 min,取300 μL上清液真空干燥。加入400 μL甲醇-水溶液(V∶V=1∶4),涡旋30 s后超声 2 min 以充分复溶样品。13 000 rpm、4 ℃离心样品10 min,吸取上清液150 μL。使用0.22 μm有机相针孔过滤器过滤上清液并转移至LC进样小瓶,-80 ℃ 保存,直至LC-MS上机分析。质控样本(QC)由所有样本提取液等体积混合制备而成,每个QC体积与样本相同。所有提取试剂使用前均在 -20 ℃ 预冷。
1.3 代谢物检测
代谢物检测方法按照He等[13]方法进行,并做适当修改。ACQUITY UPLC超高效液相系统(Waters公司, USA)串联QE高分辨质谱仪系统(Thermo Fisher公司, USA)用于分析ESI正负离子模式下的代谢谱。所使用色谱柱为ACQUITY UPLC BEH C18(2.1 mm×100 mm, 1.7 μm)。二元梯度洗脱体系由流动相A:水+0.1%甲酸,B:乙腈+0.1%甲酸组成。梯度洗脱程序如下:0 min, 5% B;1 min, 5% B;12 min, 95% B;14 min, 95% B;14.1 min, 5% B;15 min, 5% B。流速:0.35 mL/min,柱温:40 ℃。自动进样器温度:4 ℃,进样体积:10 μL。
样品质谱信号采集分别采用正负离子扫描模式。质谱参数如下:喷雾电压:3 800V(+)/3 800V(-);毛细管柱温度:320 ℃(+)/320 ℃(-);探针加热温度:350 ℃(+)/350 ℃(-);鞘气压:45 Arb(+)/5 Arb(-);辅气压:10 Arb(+)/10 Arb(-);S-lens RF level:50(+)/50(-);质量范围:100-1 200 m/z(+)/100-1 200 m/z(-);一级质谱分辨率:70 000(+)/70 000(-);二级质谱分辨率:17 500(+)/17 500(-);NCE/stepped NCE:10,20,40eV(+)/10,20,40eV(-)。质谱分析过程中,每6个正式样本中插入一个QC样本,以用于评价整个试验过程中系统质谱平台稳定性。
1.4 数据统计分析
UPLC-MS获得原始数据经代谢组学处理软件Progenesis QI软件(V2.3,UK)作基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化。化合物鉴定基于精确质量数、二级碎片以及同位素分布,使用 The Human Metabolome Database(HMDB)、Lipidmaps(V2.3)以及METLIN数据库进行定性。使用包含保留时间、质荷比、峰值强度和样本信息的数据矩阵作统计分析。每个样本、每个代谢物对应峰值强度由该样本总峰值强度校正。将正、负离子数据合并导入R包中作多元统计分析。采用主成分分析(PCA)与正交偏最小二乘方-判别分析(OPLS-DA)对试验组间代谢物变化作可视化分析。OPLS-DA分析中,变量权重值(VIP)用于衡量各代谢物表达模式对各组样本分类判别的影响强度和解释能力。为防止模型过拟合,7次循环交互验证和200次响应排序检验方法用于考察模型质量。筛选VIP>1,P<0.05的差异代谢物。使用KEGG pathway(https:∥www.kegg.jp/)数据库对肝脏样品差异代谢物作通路富集分析。独立样本T检验用于比较对照组和试验组的差异。
2 结果与分析
2.1 肝脏代谢物定性分析
所有肝脏组织样本均在UPLC-MS平台上分析,代谢物在正、负离子模式下得到较好分离(图1)。经The Human Metabolome Database、Lipidmaps(V2.3)以及METLIN数据库定性,共鉴定到4 519种代谢物,其中负离子模式鉴定到1 708种代谢物,正离子模式鉴定到2 811种代谢物。
老陆变化太大了。看上去比你还要老(我老吗?),头发都掉光了,秃脑门儿。上学那会,也算是个帅哥,现在整个一老头模样,简直不敢认了。你知道他是做什么的吗,教育局当处长,你知道他开的什么牌子的车,奥迪Q 5,我操,六七十万吧!
2.2 多元统计分析
主成分分析(PCA)模型中QC样本紧密聚集,表明试验稳定性和重复性较好(图2(a))。R2X为决定PCA模型质量的主要参数,FT/TT组的R2X(cum)=0.507>0.5,表明PCA模型可靠。此外,PCA图也显示FT组和TT组完全分离,2组间差异显著(图2(b))。建立OPLS-DA模型进一步验证代谢谱在FT组与TT组之间的分离。OPLS-DA模型参数R2Y(cum)=0.983,Q2(cum)=0.963均>0.5,表明模型建立较好。OPLS-DA图中,FT组和TT组(图2(c))完全分离,进一步表明不同产蛋时期肝脏代谢物存在显著差异。7次循环交互验证和200次响应排序检验的结果显示,Q2=-0.597<0,表明OPLS-DA模型没有过拟合(图2(d))。上述结果表明,FT组和TT组的肝脏样本在PCA模型和OPLS-DA模型中均差异显著,所获得的数据可用于差异代谢物的筛选。
2.3 差异代谢物丰度变化分析
与TT组相比,在FT组中共筛选出324种差异代谢物,其中168种代谢物丰度显著下调(P<0.05),156种代谢物丰度显著上调(P<0.05)。为更清楚了解代谢物丰度变化,绘制了324种差异代谢物热图(图3)。热图分为2个聚类,每种差异代谢物在FT和TT组之间丰度均存在显著差异(P<0.05)。根据物质信息进一步分类可将差异代谢物归为12种类型:苯环型化合物、脂类及类脂分子、核苷,核苷酸及类似物、有机酸及其衍生物、有机含氧化合物、有机杂环化合物、糖类多酮类化合物、生物碱及其衍生物、含氮有机物、有机硫化合物、有机磷化合物和未分类代谢物。分类信息表明脂类及类脂分子和有机酸及其衍生物这2类代谢物数量占比均较高,在上调差异代谢物中分别占19.87%和21.79%,在下调差异代谢物中分别占41.07%和13.1%(图4)。

图1 正离子(a)和负离子(b)模式下肝脏代谢物基峰强度色谱图Fig.1 Base peak intensity chromatographs of liver metabolites obtained in ES+mode (a) and ES—mode (b)
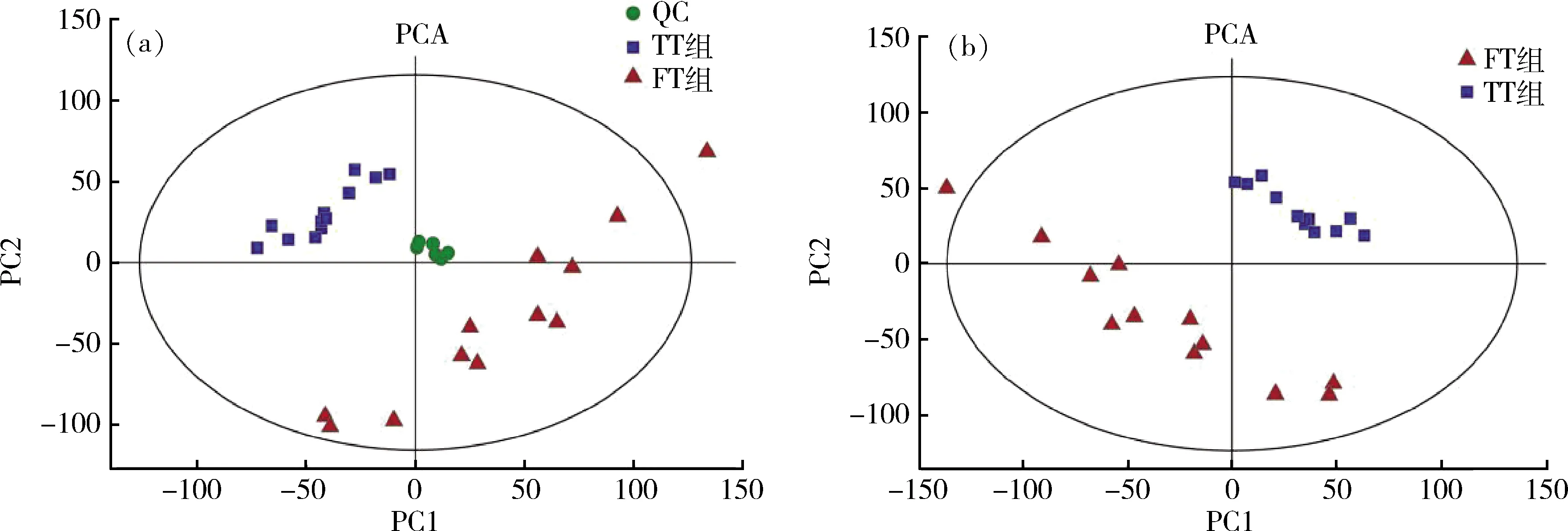
(a)所有样本PCA模型得分图;(b)FT组和TT组PCA模型得分图;(c)FT组和TT组OPLS-DA模型得分图;(d)FT组和TT组排列测试图。(a) PCA score plot for the data from QC samples and all groups; (b) PCA score plot for the data in FT group and TT group; (c) OPLS-DA score plot in FT group and TT group; (d) Permutation test plot in FT group and TT group.图2 多元统计分析Fig.2 Multivariate statistical analysis

变化程度由不同颜色标记,红色或蓝色分别表示代谢物相对增加或减少的水平。每列代表1个单独样品,每行代表1个差异代谢物。TT组为开产前22周龄番鸭,FT组为产蛋期40周龄番鸭。The degree of change is marked by different colors, and red or blue represents the relatively increased or decreased levels of the metabolites, respectively. Each column represents an individual sample, and each row represents a differential metabolite. TT group represents Muscovy duck in pre-laying stage (22 wk), and FT group represents Muscovy duck in laying stage (40 wk).图3 番鸭产蛋前期和产蛋期肝脏差异代谢物热图分析Fig.3 Heat map analysis of hepatic differential metabolites of Muscovy duck in pre-laying and laying stages

图4 番鸭产蛋前期和产蛋期肝脏差异代谢物分类Fig.4 Classification of hepatic differential metabolites of Muscovy duck in pre-laying and laying stages
2.4 差异代谢物通路富集
通路富集分析可获得46种差异代谢物的17个通路存在显著差异(P<0.05)。通路富集表明,氨基酸代谢通路最为丰富,分别为甘氨酸,丝氨酸与苏氨酸代谢、氨基酸生物合成、氨酰-tRNA生物合成、组氨酸代谢、β-丙氨酸代谢、赖氨酸降解、精氨酸生物合成、精氨酸与脯氨酸代谢和半胱氨酸与蛋氨酸代谢。其中甘氨酸,丝氨酸与苏氨酸代谢和氨基酸生物合成富集到的差异代谢物数量最多(图5)。除叶酸一碳库、半胱氨酸与蛋氨酸代谢、嘌呤代谢、赖氨酸降解和谷胱甘肽代谢通路下调外,其他12个通路均表现为显著上调(表1)。

图5 番鸭产蛋前期和产蛋期差异代谢物KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of differential metabolites of Muscovy duck in pre-laying and laying stages
分析差异代谢物富集通路,发现谷胱甘肽、半胱氨酸和胆碱等在产蛋前后肝脏组织中代谢差异显著。谷胱甘肽和半胱氨酸在FT组丰度显著下调,胆碱在FT组丰度显著上调,其log2FC分别为-1.48、-1.86和0.64(图6)。谷胱甘肽参与铁死亡、半胱氨酸和蛋氨酸代谢和谷胱甘肽代谢;半胱氨酸参与甘氨酸,丝氨酸与苏氨酸代谢、氨基酸生物合成、氨酰-tRNA生物合成、泛酸与CoA生物合成、铁死亡、半胱氨酸与蛋氨酸代谢和谷胱甘肽代谢;胆碱参与甘氨酸,丝氨酸与苏氨酸代谢和甘油磷脂代谢(表1)。
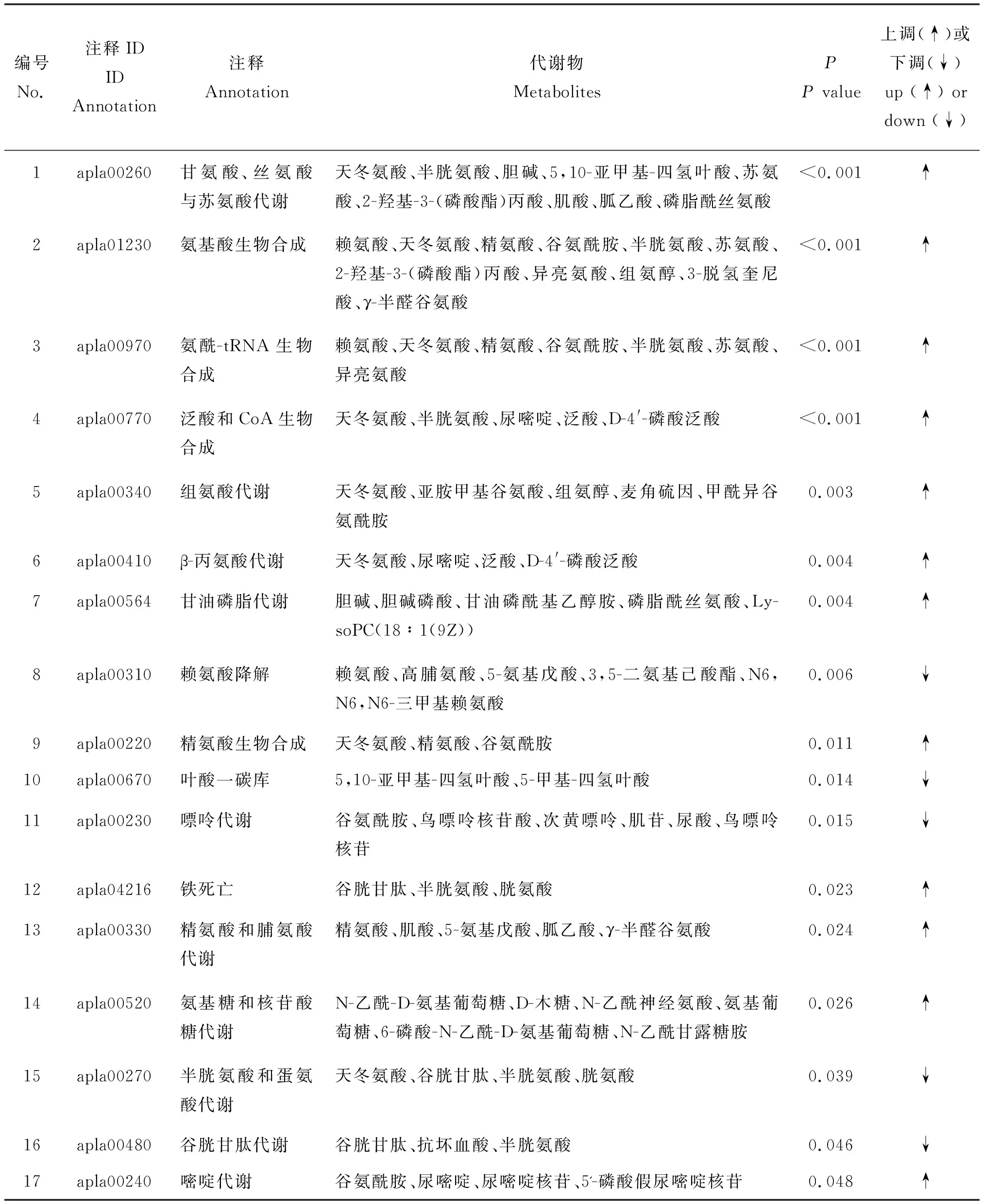
表1 番鸭产蛋前期和产蛋期KEGG通路富集分析Table 1 Enrichment analysis of KEGG pathways of Muscovy duck in pre-laying and laying stages
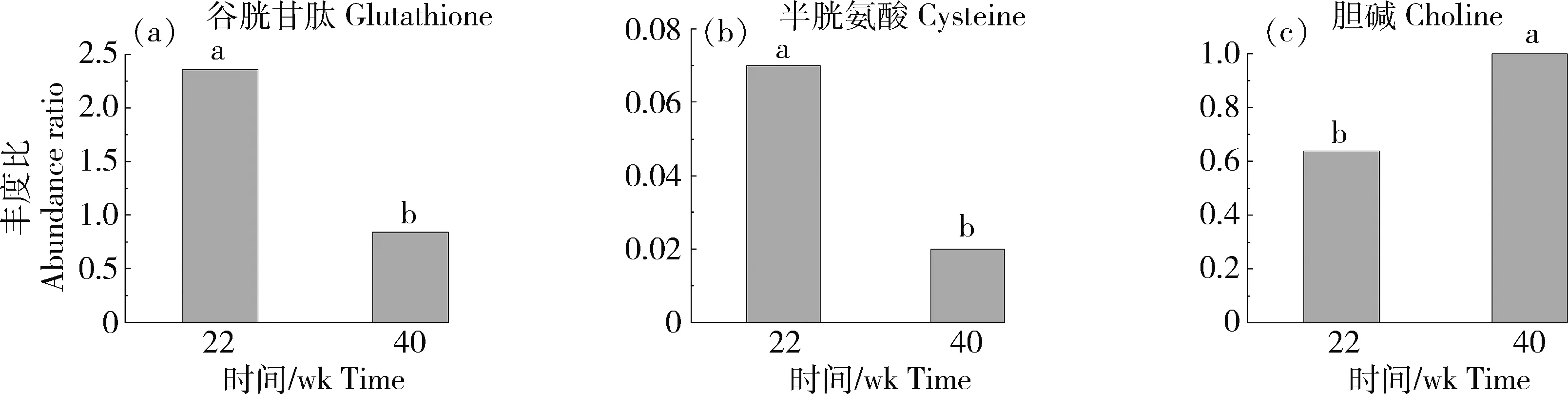
柱上不同字母表示组间差异显著(P<0.05)Columns marked with different letters represent significant difference (P<0.05) within groups.图6 番鸭产蛋前期和产蛋期关键差异代谢物丰度比Fig.6 Abundance ratio of key differential metabolites of Muscovy duck in pre-laying and laying stages
3 讨 论
3.1 番鸭产蛋前后肝脏差异代谢谱分析
甘油磷脂和甘油三酯在分泌早期与载脂蛋白结合,形成富含甘油三酯的脂质蛋白颗粒,在VLDL成熟分泌前进一步引入甘油磷脂[14],组装成VLDL,成为肝脏分泌的主要脂质成分。产蛋期间,在雌激素作用下每克肝脏每小时可转录出1.3×1011mRNA分子,相当于每个肝细胞每分钟转录出11个VTG mRNA分子,并经翻译后生成大量VTG进入血液[15]。VLDL和VTG为2种主要卵黄前体物,在卵黄形成过程中发挥重要作用,分别构成60%和24%卵黄干物质以及共同构成95%以上的卵黄脂质[16-17]。本研究中,脂类及类脂分子和有机酸及其衍生物数量在FT/TT组占比均较高,可能与VLDL和VTG等卵黄前体合成有关。产蛋为一种复杂的生理过程,从差异代谢物类型可知产蛋涉及到糖代谢、核苷酸代谢、脂代谢、维生素代谢和氨基酸代谢等。
3.2 番鸭产蛋前后肝脏差异代谢通路分析
3.2.1氨基酸代谢通路
3.2.2甘油磷脂代谢
甘油磷脂为机体含量最多的一类磷脂,除构成生物膜外,还是胆汁和膜表面活性物质等成分之一,并参与细胞膜对蛋白质识别和信号传导[19]。甘油磷脂合成于细胞质滑面内质网,通过高尔基体加工,在VLDL形成初期以及形成前参与其组装[14,20]。在本研究中,甘油磷脂代谢通路(apla00564)上调,富集到的5种甘油磷脂,除磷脂酰丝氨酸外,胆碱、胆碱磷酸、甘油磷酰基乙醇胺和LysoPC(18∶1(9Z))在FT组丰度显著增加,可能与肝脏代谢生成大量甘油磷脂以满足VLDL组装有关。
3.2.3核苷酸代谢
核苷酸是DNA和RNA的基本组成单位,是体内合成核酸的前体物质。在产蛋期肝脏核苷酸合成增加,GMPS和CMPK1基因显著上调促进嘧啶合成[21],故嘧啶代谢(apla00240)代谢通路显著上调。在本研究中,嘌呤代谢(apla00230)通路显著下调,可能与增加ATP和rRNA合成速率有关[22]。
3.2.4维生素代谢
叶酸为嘌呤和胸腺嘧啶核苷酸合成以及同型半胱氨酸合成蛋氨酸提供一碳单位[23-24]。叶酸不能由动物组织合成,由外源性食物供给并由肠道吸收[25]。本试验番鸭屠宰前未进食,且肝脏代谢需大量四氢叶酸提供一碳单位,导致叶酸一碳库代谢通路(apla00670)富集到的2个差异代谢物5,10-亚甲基-四氢叶酸和5-甲基-四氢叶酸在FT组丰度显著下调。
泛酸(维生素B5)为辅酶A(CoA)前体物,在调节碳水化合物、脂质、蛋白质和核酸代谢等过程中发挥关键作用[26]。Youssef等[27]发现饲喂缺乏泛酸饲料的大鼠肝脏中,过氧化物酶体中脂肪酸β-氧化显著降低。在本研究中泛酸和CoA生物合成通路(apla00770)上调,可能与维持产蛋期间肝脏正常代谢有关。
3.2.5其他代谢
谷胱甘肽代谢通路(apla00480)中,富集到的3种差异代谢物谷胱甘肽、抗坏血酸和半胱氨酸丰度均在FT组显著下降。谷胱甘肽和抗坏血酸具有抗氧化性,可消除细胞内过氧化物和自由基[28]。40周龄为产蛋中期,番鸭可能适应产蛋应激,故谷胱甘肽和抗坏血酸丰度下降。
铁死亡为依赖铁离子及活性氧诱导脂质过氧化导致的调节性细胞坏死,其在形态学、生物学及基因水平上均明显不同于凋亡、坏死、自噬等其他形式细胞坏死[29]。研究表明铁死亡生物学特征为铁和活性氧聚集,激活丝裂原活化蛋白激酶系统,降低胱氨酸摄取和增加谷胱甘肽消耗[30]。在本研究中,铁死亡代谢通路(apla04216)上调,富集到的差异代谢物谷胱甘肽和半胱氨酸在产蛋期丰度显著下降,而胱氨酸丰度显著上调,符合铁死亡生物学特征,可能与肝脏正常的调节性细胞坏死有关,但相关研究仍需继续探究。
产蛋期氨基糖和核苷酸糖代谢通路(apla00520)显著上调,富集到的6种差异代谢物除氨基葡萄糖外,N-乙酰-D-氨基葡萄糖、D-木糖、N-乙酰神经氨酸、6-磷酸-N-乙酰-D-氨基葡萄糖和N-乙酰甘露糖胺丰度在FT组显著增加。有关核苷酸糖代谢通路中的代谢物在卵黄前体物合成中的作用机理尚无研究报道,有待进一步研究。
3.3 番鸭产蛋前后肝脏关键差异代谢物分析
胆碱为蛋鸡日粮必需营养物质,是肝脏中磷脂酰乙醇胺(PE)合成磷脂酰胆碱(PC)反应底物[31]。研究表明饲料中添加胆碱能提高母鸡抗氧化能力、卵黄总脂和PC以及血清VLDL含量,增强肝脏GSH-Px活性和T-AOC,同时降低肝脏总脂、甘油三酯以及PC含量[32-33]。胆碱在产蛋期丰度显著上升,可能与肝脏抗氧化应激能力有关,并增加PC含量。PC为VLDL主要成分,VLDL分泌和脂质从肝脏向血液和周围组织转运均需胆碱和PC。谷胱甘肽为细胞重要抗氧化剂,由谷氨酸、半胱氨酸和甘氨酸经ATP依赖的谷氨酸-半胱氨酸连接酶和谷胱甘肽合成酶两步合成,其合成速率受半胱氨酸限制。半胱氨酸参与多个氨基酸代谢通路、铁死亡、谷胱甘肽代谢和泛酸与CoA生物合成等。有关半胱氨酸在禽类产蛋期作用机理研究报道较少,其在产蛋期丰度显著下调,可能与产蛋应激适应有关。
