不同浓度磷胁迫对大豆幼苗生长及根系DNA甲基化水平的影响
2020-11-26张文献李增强胡亚丽梁志辰罗登杰唐美琼
张文献 李增强 胡亚丽 梁志辰 罗登杰 卢 海 唐美琼 陈 鹏*
(1.广西大学 农学院,南宁 530004;2.广西壮族自治区高校植物遗传育种重点实验室,南宁 530004)
磷是植物生长发育必须的三大营养元素之一,参与植物体内众多化合物的组成及代谢过程,对作物的产量和品质有重要的影响。全世界约有1/2的耕地处于缺磷状态,我国更是有2/3的耕地缺磷[1]。磷肥的过度施用容易导致环境污染,并且磷资源具有有限性和不可再生性。大豆是重要的粮油兼用作物,同时也是喜磷作物。大豆在低磷胁迫下不但吸收不到足够的磷素,甚至还会抑制根瘤的生长,降低固氮量[2],最终严重降低大豆的产量和品质。
目前在大豆响应低磷胁迫方面的研究主要集中在大豆农艺性状的改变和磷效率相关性状的QTL(quantitative trait loci)定位等方面。严重的低磷胁迫会显著抑制大豆的植株生长,包括株高、茎粗和干物质积累量等显著降低[3]。但在低磷胁迫下,大豆根长、根表面积和根体积均比正常供磷时有所增加[4],主要原因可能在于根系是植物吸收土壤水分和养分最直接、最主要的器官,低磷胁迫促使大豆扩大根系的吸收面积,缩短磷离子扩散到根部的距离。因此,通常把根长和根表面积作为筛选磷高效基因型大豆的重要指标[5]。黄兰兰等[6]汇总目前已报道的大豆磷效率相关的96个QTL,并将其提交到大豆的公共遗传图谱Soymap 2中,为大豆磷效率分子标记的辅助选择提供重要依据。姚敏磊等[7]研究发现,大豆在低磷胁迫下的差异表达基因主要涉及光合作用、物质和能量代谢、酶活性调节等生物学过程,并推测光合作用在大豆响应低磷胁迫中起着重要的角色。
DNA甲基化在调控基因表达、维持基因组稳定性、调控植物生长发育、生物和非生物逆境胁迫响应等方面发挥着重要作用[8]。甲基化敏感扩增多态性 (methylation sensitive amplified polymorphism,MSAP) 技术是在扩增片段长度多态性 (amplified fragment length polymorphism,AFLP) 技术的基础上发展起来的,现已广泛运用在植物的基因组DNA甲基化水平研究中[9]。陈智华[10]运用MSAP技术分析了大豆杂交种及其亲本的DNA甲基化差异。徐妍[11]运用MSAP技术分析了灰斑病菌胁迫对大豆DNA甲基化水平的影响,表明灰斑病菌胁迫后,大豆叶片的DNA甲基化率降低,并推测DNA甲基化可能在大豆的抗性反应中起着重要的作用。何庆元等[12]运用MSAP技术分析了硫化氢对盐胁迫下大豆DNA甲基化的影响,表明硫化氢溶液可以恢复盐胁迫所导致的甲基化类型和水平的改变,从而缓解盐胁迫造成的伤害。殷欣[13]利用MSAP技术研究了镉胁迫下大豆的DNA甲基化变化,表明镉胁迫导致大豆DNA甲基化水平升高,并且甲基化水平与处理浓度呈正相关,推测甲基化差异基因广泛参与到植物响应逆境的过程。大豆响应非生物胁迫的相关报道主要集中在大豆农艺性状、多组学以及抗逆性相关基因的研究上,基因组DNA甲基化方面的相关研究却鲜有报道。本研究利用MSAP和qRT-PCR等技术,系统分析不同浓度的磷胁迫对大豆幼苗生长、生理生化、DNA甲基化和相关基因表达水平的影响,旨在明确磷胁迫下大豆幼苗的长势及DNA甲基化水平变化等情况,以期为进一步研究大豆高效吸收和利用磷肥的潜在机制提供重要参考。
1 材料与方法
1.1 试验材料及处理
本试验以大豆‘CP016’为试验材料,先采用砂培法培养长势一致的幼苗用于后续试验,后采用水培法对幼苗进行不同浓度的H3PO4处理。光照培养箱中培养,光/暗周期为9 h/15 h,温度25 ℃,光照度20 000 Lx,湿度60%。首先将种子用3%的H2O2消毒并冲洗后,均匀地种植在含有沙土的塑料盆(27 cm×18 cm×9 cm)中,定期定量地浇以蒸馏水。培养5 d后,选出长势一致的幼苗90株用于本试验,即为5个处理,每个处理6株,3次生物学重复。把幼苗移栽到盛有育苗盘的托盘中处理10 d,定期定量地更换处理液。处理液以改良Hoagland营养液配方为基础,把其中的KH2PO4更换为KCl和H3PO4以分别补充钾和磷。各处理均加74.58 mg/L的KCl以补充钾,之后分别加不同浓度(0,10,100,500,1 000 μmol/L)的H3PO4进行处理,注意使用氢氧化钠调节各组处理液的pH 6.0。根据相关文献[14]中作物的需磷量,本试验中,500 μmol/L的H3PO4处理作为正常供磷水平,0、10、100和1 000 μmol/L的H3PO4分别作为无磷、极低磷、低磷和高磷胁迫处理。
1.2 植物学性状及生理指标的测定
测定各处理组幼苗的株高、茎粗和全鲜重等植物学性状,并利用根系扫描分析仪(EPSON EXPRESSION 10000XL)对根系进行扫描分析,计算根长、根表面积和根体积等。之后将材料保存于-80 ℃冰箱,用于后续试验。分别采用氮蓝四唑法[15]、愈创木酚法[15]和紫外分光光度法[16]测定根系的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性。使用北京索莱宝科技有限公司的淀粉(货号:BC0700)和蔗糖(货号:BC2460)含量检测试剂盒测定根系的淀粉和蔗糖含量。
1.3 甲基化敏感扩增多态性(MSAP)分析
参照Tang等[17]的MSAP方法并略做改进,对部分处理幼苗的根系进行DNA甲基化水平分析。首先采用改良CTAB法[18]提取上述材料的基因组DNA,之后用EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ2个组合分别进行双酶切,连接,预扩增、选择性扩增,聚丙烯酰胺凝胶电泳,银染和显色,最后对MSAP多态性条带进行标记和统计。接头序列、预扩增和选择性扩增引物序列,见表1。
MSAP多态性条带标记方法如下:同一水平线上,EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ酶切都有带,记为Ⅰ型(无甲基化);EcoRⅠ/HpaⅡ酶切有带而EcoRⅠ/MspⅠ酶切无带,记为Ⅱ型(半甲基化);EcoRⅠ/HpaⅡ酶切无带而EcoRⅠ/MspⅠ酶切有带,记为Ⅲ型(全甲基化);EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ酶切都无带,记为Ⅳ型(全甲基化)。DNA甲基化水平统计方法如下:甲基化条带数=Ⅱ型+Ⅲ型+Ⅳ型,甲基化率=(Ⅱ型+Ⅲ型+Ⅳ型)/(Ⅰ型+Ⅱ型+Ⅲ型+Ⅳ)×100%;半甲基化条带数=Ⅱ型,半甲基化率=Ⅱ型/(Ⅰ型+Ⅱ型+Ⅲ型+Ⅳ)×100%;全甲基化条带数=Ⅲ型+Ⅳ型,全甲基化率=(Ⅲ型+Ⅳ型)/(Ⅰ型+Ⅱ型+Ⅲ型+Ⅳ型)×100%。
1.4 qRT-PCR分析
运用改良异硫氰酸胍法分别提取相应材料的RNA[19],利用琼脂糖凝胶电泳和超微量紫外分光光度计检测RNA的质量和浓度,之后使用南京诺唯赞生物科技有限公司反转录试剂盒(货号:R223-01)反转录成cDNA,并以此为模板进行qRT-PCR分析。以β-tubulin为内参基因,采用2-ΔΔCT方法[20]计算基因的相对表达量,qRT-PCR引物序列,见表2。
1.5 数据处理
使用Excel软件进行数据分析及图表的制作,使用IBM SPSS Statistics 22软件进行生物学统计分析。
2 结果与分析
2.1 不同浓度磷胁迫对大豆幼苗植物学性状的影响
大豆幼苗经过不同浓度的磷胁迫处理后,植株外部形态差异明显。其中,无磷(0 μmol/L)和高磷(1 000 μmol/L)胁迫下的幼苗在株高、叶片大小和根系等方面的长势明显变差,其他3个浓度处理下的长势正常。极低磷(10 μmol/L)和低磷胁迫(100 μmol/L)下根系的长势最好,高磷胁迫下最差。
由表3可知,低磷胁迫下的幼苗株高和鲜重最高,其次是正常供磷(500 μmol/L)、极低磷、高磷和无磷处理,除正常供磷和极低磷处理外,其他处理之间均存在显著的差异,说明一定程度的低磷胁迫可以促进大豆幼苗的生长。值得注意的是,幼苗在无磷胁迫下茎最粗,高磷胁迫下茎最细,这可能是磷胁迫导致大豆幼苗发生的适应性变化。在幼苗的根系长势方面,极低磷胁迫下根系的根长、根表面积和根体积值最大,其次是正常供磷、低磷和无磷,4个处理之间总体上无显著的差异。高磷胁迫下根系长势最差,且与其他浓度处理存在显著性差异,说明极低磷和低磷胁迫可以促进大豆幼苗根系的伸长生长,高磷胁迫对根系的抑制大于无磷胁迫。

表1 引物序列Table 1 Lists of primer sequences

表2 实时荧光定量PCR引物序列(5′→3′)Table 2 Primer sequences for qRT-PCR (5′→3′)

表3 不同浓度H3PO4处理对大豆幼苗植物学性状的影响Table 3 Effects of different concentrations of H3PO4 on botanical characteristics of soybean seedlings
2.2 不同浓度磷胁迫对大豆幼苗根系抗氧化酶活性及碳水化合物含量的影响
由图1可知,磷胁迫处理显著改变大豆幼苗根系的抗氧化酶活性和碳水化合物含量。不同浓度磷胁迫下根系的SOD活性呈先升高后降低的趋势,极低磷(10 μmol/L)和低磷(100 μmol/L)胁迫下的活性最高,其次是无磷和正常供磷(500 μmol/L)处理,高磷胁迫(1 000 μmol/L)下活性最低。POD和CAT活性的变化趋势基本相同,都呈先降低后升高的趋势,高磷和正常供磷处理下的活性最高,其次是无磷胁迫,低磷和极低磷胁迫下活性最低。淀粉和蔗糖含量的变化趋势基本相同,都呈先升高后降低的趋势。正常供磷处理(500 μmol/L)下根系的淀粉含量最高,其次是低磷和极低磷胁迫,最后是无磷和高磷胁迫。低磷胁迫下根系的蔗糖含量最高,其次是极低磷和正常供磷处理,无磷和高磷胁迫下含量最低,并且低磷胁迫下的蔗糖含量是高磷胁迫下的3倍左右。
2.3 不同浓度磷胁迫对大豆幼苗根系DNA甲基化水平的影响
由图2可知,大豆幼苗根系在无磷和高磷(1 000 μmol/L)胁迫下均出现甲基化差异片段。由表4和表5可知,随着磷浓度的逐渐增加,大豆幼苗根系的DNA甲基化率和全甲基化率明显升高,半甲基化率逐渐降低。正常供磷(500 μmol/L)条件下,大豆幼苗根系的DNA甲基化率、半甲基化率和全甲基化率分别为48.52%、14.35%和34.18%。无磷胁迫使根系的DNA甲基化率和全甲基化率降低,半甲基化率升高。高磷胁迫使根系的DNA甲基化率和全甲基化率升高,半甲基化率降低,但变化幅度较小。由此说明,磷胁迫改变大豆幼苗根系的DNA甲基化水平,且无磷胁迫比高磷胁迫的变化幅度更大。
2.4 甲基化酶及生理生化相关基因的qRT-PCR分析
由图3可知,Gu/Zn-SOD、Mn-SOD和Fe-SOD基因的表达量都是无磷胁迫下比正常供磷(500 μmol/L)处理的低,且前两者呈显著性降低。POD、POD4、POD10和POD11基因的表达量都在无磷胁迫下显著提高,CAT1基因的表达量稍高。说明磷胁迫改变调控抗氧化酶相关基因的表达水平,从而改变抗氧化酶活性,最终在响应磷胁迫中起到重要作用。颗粒结合型淀粉合成酶GBSS(Granule-bound starch synthase, GBSS)和淀粉合酶(Starch synthase, SS)是淀粉合成中的关键酶,主要分别负责直链淀粉和支链淀粉的合成[21]。GBSS、SS1和SS3基因的表达量都在无磷胁迫下比正常供磷条件下显著提高。蔗糖合酶SuS(sucrose synthase,SUS)是植物进行蔗糖代谢的关键酶之一,对淀粉的合成也具有调节作用[22]。本研究发现SuS、SuS2和SuS5基因的表达量在无磷胁迫下显著降低,这与测得的蔗糖含量变化趋势是一致的。

图1 不同浓度磷胁迫下大豆幼苗根系抗氧化酶活性及碳水化合物含量的变化Fig.1 Changes in antioxidant enzyme activity and carbohydrate content in roots of soybean seedling under different concentrations of phosphorus stress
DRM2和ROS1分别是植物中重要的甲基化酶和去甲基化酶,本研究发现DRM2基因在无磷胁迫下显著升高,ROS1基因在无磷胁迫下显著降低,进一步说明磷胁迫使大豆幼苗DNA甲基化水平的显著变化。
3 讨 论
低磷胁迫可以促进大豆植株的伸长生长[23],但严重缺磷会对植株生长产生显著的抑制[24]。在低磷胁迫下,大豆主要通过刺激根系生长以提高对磷的吸收,以适应低磷环境,磷高效基因型大豆品种更是如此[25]。本研究表明,低磷胁迫促进大豆材料‘CP016’的幼苗生长,极低磷胁迫下幼苗的长势减弱,但仍能显著促进根长、根表面积和根体积等,这些都是磷高效品种筛选的重要指标,说明此品种是潜在的磷高效基因型品种,值得深入研究。
植物遭受非生物逆境胁迫后,会使体内积累大量的活性氧。SOD、POD和CAT等共同组成抗氧化酶系统,以缓解活性氧导致的氧化胁迫,但是严重的非生物胁迫会使这种抗氧化酶系统紊乱,对植物造成严重的损伤[26-27]。本研究中,相较于低磷(100 μmol/L)和极低磷胁迫(10 μmol/L),无磷和高磷(1 000 μmol/L)胁迫下根系的SOD、POD和CAT活性比正常供磷处理下变化更大,这可能是无磷和高磷胁迫下的幼苗生长受到严重抑制的原因之一。碳水化合物是植物光合作用的主要产物,是维持植物生长发育所需的物质和能量主要来源。蔗糖和淀粉在植物生长发育过程中发挥着重要作用[28]。无磷和高磷胁迫下,大豆幼苗的叶片明显变小,光合产物减少,因而蔗糖和淀粉含量大大降低。但是低磷和极低磷胁迫下幼苗的叶片大小、淀粉和蔗糖含量变化较小,甚至低磷胁迫下幼苗根系的蔗糖含量最高。

M,50 bp Marker;1~6,EcoRⅠ/HpaⅡ酶切产物;7~12,EcoRⅠ/MspⅠ酶切产物。1,2,7,8为0 μmol/L的H3PO4处理的样品产物;3,4,9,10为500 μmol/L的H3PO4处理的样品产物;5,6,11,12为1 000 μmol/L的H3PO4处理的样品产物。白色方框,Ⅰ型(无甲基化);黑色方框,Ⅱ型(半甲基化);红色方框,Ⅲ型(全甲基化);蓝色方框,Ⅳ型(全甲基化)。M, 50 bp Maker; Lanes 1-6, digested with EcoRⅠ/HpaⅡ; Lanes 7-12, digested with EcoRⅠ/MspⅠ. The lane 1,2,7,8; 3,4,9,10; 5,6,11,12 represented the concentration treatments of 0, 500 and 1 000 μmol/L H3PO4, respectively. The white blacke, red and blue frames represented the typeⅠ(non methylation), typeⅡ(hemi-methylation), type Ⅲ(full methylation) and type Ⅳ(full methylation), respectively.图2 MSAP聚丙烯酰胺凝胶电泳图Fig.2 MSAP acrylamide gel analysis
DNA甲基化与植物的生长发育密切相关,植物体内的DNA甲基化水平总是处于一个动态平衡的状态,其建立和维持的机制与DNA甲基化酶以及DNA去甲基化酶密切相关[29]。DNA甲基化酶主要有3个家族:甲基转移酶1(MET1)、结构域重排甲基转移酶(DRM)和染色质甲基化酶(CMT)[30]。DNA去甲基化酶主要有4个家族:DME、ROS1、DML2和DML3[31]。当植物遭受生物或非生物逆境胁迫后,DNA甲基化相关酶基因的表达量会发生显著变化,从而导致植物体内的DNA甲基化水平改变,以应对严峻的胁迫环境[32]。本研究发现,在无磷胁迫下DRM2基因的表达量显著上调,ROS1基因表达量显著下调。利用MSAP技术分析发现,无磷胁迫和高磷胁迫分别使DNA甲基化水平降低或提高,表明磷胁迫打破大豆幼苗根系DNA甲基化状态的动态平衡,这与殷欣[13]对大豆DNA甲基化响应镉胁迫的研究结果一致。本研究发现高磷胁迫导致大豆幼苗根系DNA甲基化水平升高,而无磷胁迫导致甲基化水平降低,并且变化幅度更显著,2种胁迫下的半甲基化率变化都较小,这说明了大豆幼苗应对不同胁迫环境DNA甲基化水平变化和响应的复杂性。
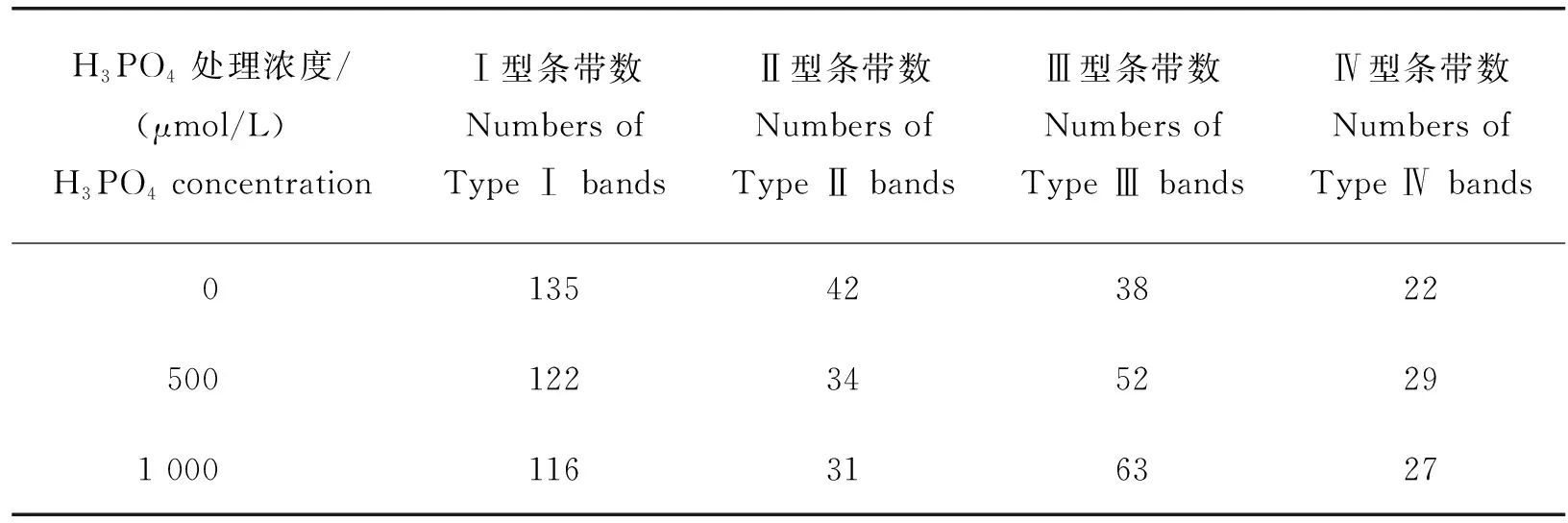
表4 MSAP差异片段统计分析Table 4 Statistical analysis of MSAP differential fragments
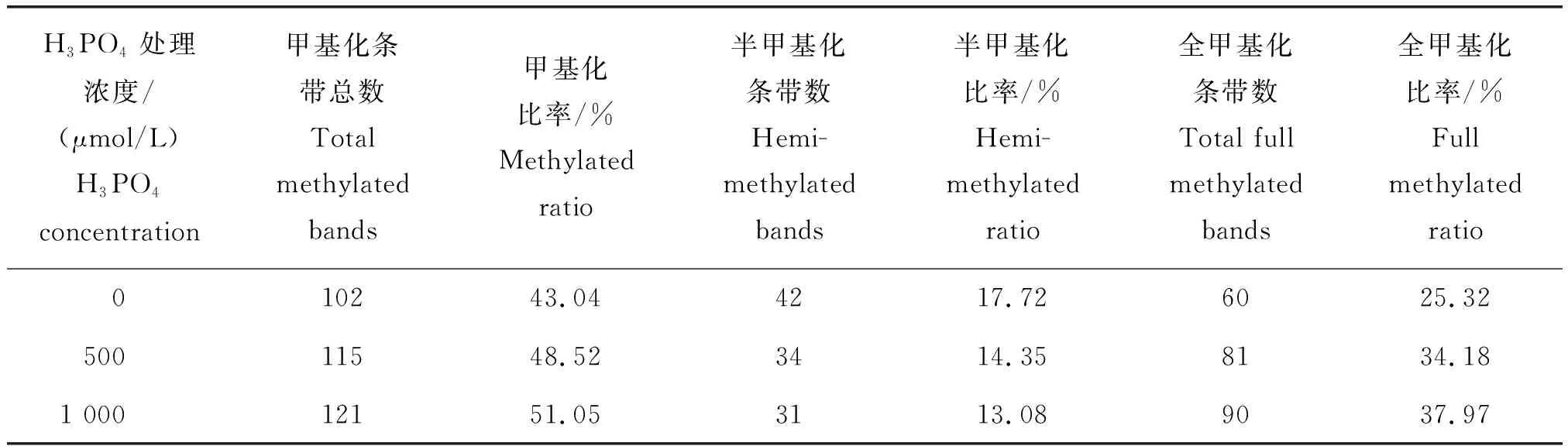
表5 DNA甲基化水平统计分析Table 5 Statistical analysis of DNA methylation level
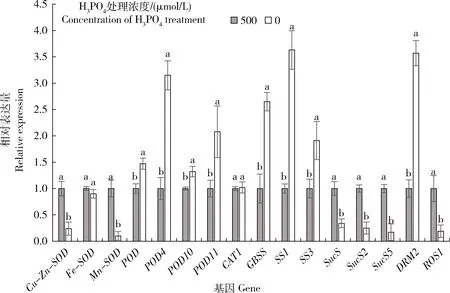
图3 生理生化及甲基化酶相关基因的qRT-PCR分析Fig.3 qRT-PCR analysis of related genes about physiology biochemistry and methylase
本研究系统地比较不同浓度磷胁迫下大豆材料‘CP016’的幼苗长势、抗氧化酶活性、碳水化合物含量、DNA甲基化水平以及相关基因的表达量变化,并得出施磷量为100~500 μmol/L为宜,且在此范围内,适度的低磷胁迫可以促进大豆的生长。
4 结 论
本研究首次利用MSAP技术得出大豆材料‘CP016’幼苗根系在正常供磷条件下,DNA甲基化率、半甲基化率和全甲基化率分别为48.52%、14.35%和34.18%。无磷和高磷胁迫分别使大豆幼苗根系的甲基化率和全甲基化率降低或提高,且无磷胁迫对甲基化水平的影响更大。一定程度的低磷胁迫可以促进大豆幼苗,特别是根系的生长。无磷和高磷胁迫均显著抑制大豆幼苗的生长,可能是由于根系的抗氧化酶系统紊乱,碳水化合物合成减少,DNA甲基化水平变化引起众多相关基因的表达量发生改变所导致的。
