高效液相色谱测定小米中叶酸含量方法优化
2020-11-26满夏夏闫陆飞张益娟孙朝霞韩渊怀侯思宇
满夏夏 高 豪 闫陆飞 张益娟 孙朝霞 韩渊怀 侯思宇
(山西农业大学 农学院, 山西 太谷 030801)
叶酸(Folic acid)是一种水溶性的维生素[1],又称维生素B9或维生素M,对维持人体健康具有重要作用[2],叶酸缺乏会导致诸多健康问题[3-4]。谷子(Setariaitalica)是重要的杂粮作物,籽粒脱壳后称为“小米”[5]。小米作为北方人民的喜爱的食物之一,食用和营养保健价值都非常高。研究表明,小米的叶酸含量显著高于小麦[6]、水稻[7]等主食类作物,筛选和培育高叶酸含量的谷子品种成为改善人体叶酸缺乏的有效途径之一[8]。因此,建立一种稳定可靠提取、测定小米中叶酸含量的方法极为重要。
当前,关于植物叶酸提取的方法主要有单酶法、三酶法、水浴浸提法及超声波提取法等[9-13]。单酶法[14-15]适用于碳水化合物和蛋白较少的组织样品,如菠菜、黄瓜和卷心菜等。三酶法[16]适用于提取富含碳水化合物和蛋白的组织样品。不同食物中使用的三酶法提取因素是不同的,提取水稻[7]和大豆[9]中叶酸时,添加淀粉酶、蛋白酶和叶酸轭合酶能够成功地提取出高质量叶酸;提取小麦[17]和玉米[18]的叶酸时,采用与Zhang等[15]提取菠菜中叶酸相同的方法,仅添加一种叶酸轭合酶就能很好地提取出高质量叶酸。尽管已报道了一些植物叶酸的提取方法,但是针对小米中叶酸提取方法的研究较少。
对于叶酸检测技术,多采用微生物法[19-20]、液相色谱-质谱联用法[21]、高效液相色谱法(HPLC)[10,22]、荧光分光光度计检测法[13,23]和紫外分光光度计检测法[24]等,其中前2种方法使用较普遍。微生物法[22-23]常用于检测大米和婴幼儿配方乳粉中的叶酸,此方法灵敏度高,操作简单,但试验结果重复性较差,易受样品中抗生素及抗叶酸药物的影响。液相色谱-质谱联用法[12]测量精度可达纳克级,操作简便,分离效果较好且结果准确,但易受内源叶酸影响,且仪器运营成本高。HPLC是近年来常用的检测手段,常用于检测某一种叶酸衍生物的含量。对于检测限较低的蔬菜、保健食品等检测效果较好。
本研究拟采用三酶法和HPLC法对影响小米中叶酸提取及测定的各因素进行优化,旨在为规模化定量分析小米及其他谷物的叶酸含量提供研究依据。
1 材料与方法
1.1 材料与试剂
本研究所选用的谷子品种为‘大白谷’,于2017年种植于山西农业大学农学院试验基地(112.615° E, 37.438° N),成熟期收获谷子单穗,干燥通风处贮藏。
叶酸标准品、蛋白酶购于Sigma公司;甲醇、乙腈购于Fisher公司;大鼠血清购于Dlagnovcum公司;α-淀粉酶购于Merck公司;β-巯基乙醇、磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、氢氧化钾、氢氧化钠、抗坏血酸均购于Merck公司。
1.2 三酶法提取小米中叶酸的单因素及响应面优化
小米于60 ℃烘箱去除水分,研成粉末后过100目筛。精准称取样品0.30 g于2 mL离心管中,加入0.05 mol/L的叶酸提取液(含有l%抗坏血酸钠盐和0.1% β-巯基乙醇的磷酸缓冲溶液)。随后加入淀粉酶振荡混匀,室温静置40 min后加入蛋白酶并振荡混匀,37 ℃孵育1 h。取出样品后沸水浴10 min,冰浴10 min,4 ℃条件下14 000 r/min离心20 min。取上清加入适量大鼠血清,振荡混匀并于37 ℃孵育2 h。再次沸水浴10 min后冰浴10 min,离心20 min。转移上清300 μL至棕色液相色谱进样瓶中,待用。
以小米中叶酸质量分数的测定值(Y)为考察指标,设置提取液添加量(A1)、α-淀粉酶添加量(B1)、蛋白酶添加量(C1)和大鼠血清添加量(D1)共4个因素进行单因素试验,各因素设5个水平(表1)。
利用软件Design-Expert 8.0.6中的Box-Behnken中心组合试验设计,在单因素试验的基础上,以Y值为响应值,以A1、B1、C1、D1为响应变量,进行响应面分析。
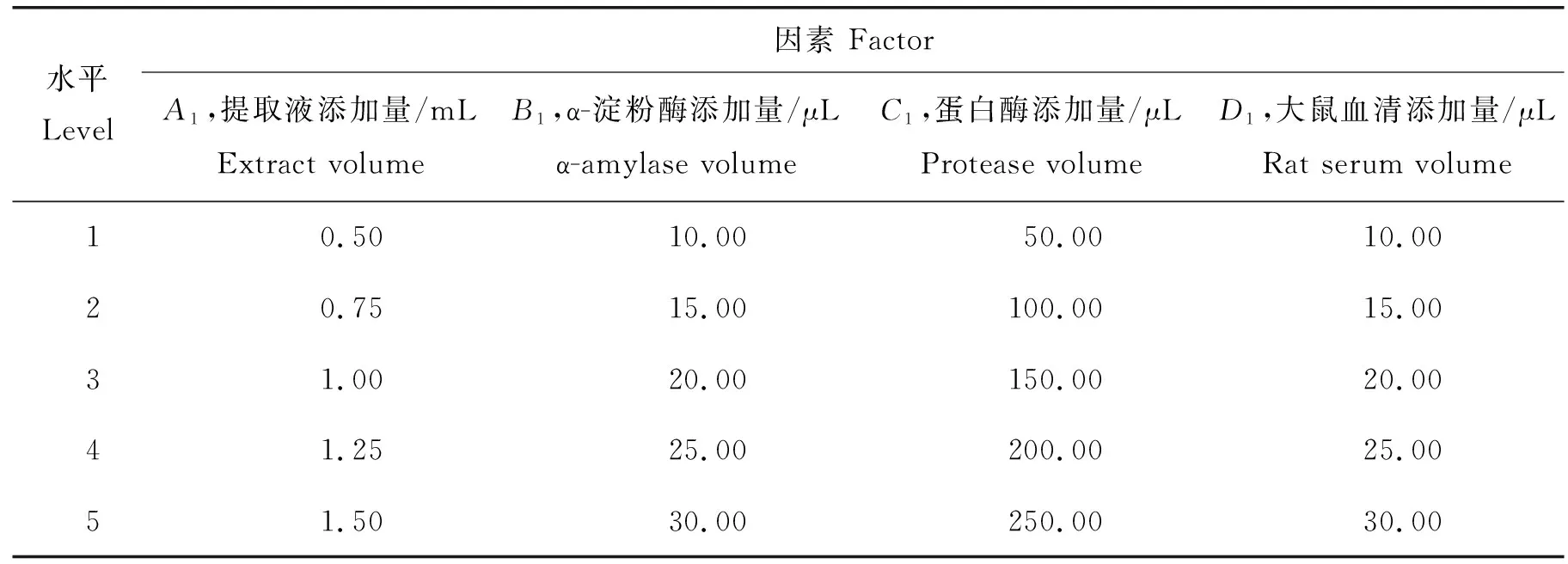
表1 三酶法提取小米中叶酸试验因素与水平Table 1 Experimental factors and level of folic acid extraction from foxtail millet by Trienzyme
1.3 HPLC法测定小米中叶酸含量的单因素及响应面优化
对HPLC法测定小米中叶酸质量分数的影响因素进行优化。以小米中叶酸质量分数的测定值(Y)为考察指标,选用流速(A2)、流动相pH(B2)、检测波长(C2)和柱温(D2)等4个因素进行单因素试验,各因素及水平见表2。
利用Box-Behnken,在单因素试验的基础上,以A2、B2、C2和D2为响应变量,Y为响应值,进行响应面分析。

表2 HPLC法测定小米中叶酸试验因素与水平Table 2 Experimental factors and level of folic acid determination from foxtail millet by HPLC
1.4 叶酸标准品曲线制备
精确称取0.01 g叶酸标准品,在避光条件下,用叶酸提取液溶解,得到质量浓度为2 mg/mL的叶酸标准母液;再分别稀释母液得到质量浓度为1、2、5、10、20、50 μg/mL的标准溶液。取各浓度标准溶液20 μL,进行检测,每个样品3次重复。以峰面积平均值为纵坐标,叶酸质量浓度为横坐标,得到谷子叶酸标准曲线y=0.767 7x-0.039 7(R2=0.999 9)。
2 结果与分析
2.1 不同提取因素对小米中叶酸质量分数测定值的影响
三酶法提取小米中叶酸各因素对叶酸质量分数测定值的影响见图1。叶酸质量分数测定值随提取液添加量的增加呈现先增后减的趋势,当提取液添加量为1 mL时叶酸质量分数测定达到最大值 2.32 μg/g(图1(a))。α-淀粉酶添加量为20 μL时,叶酸质量分数测定值最大为2.28 μg/g(图1(b))。蛋白酶添加量从50 μL增到100 μL时,叶酸质量分数测定值呈现递增的趋势。当蛋白酶添加量为 100 μL 时叶酸质量分数测定值达到最大为 2.08 μg/g (图1(c))。当大鼠血清添加量为25 μL时叶酸质量分数达到最大值2.24 μg/g(图1(d))。因此选取1 mL提取液添加量、20 μL α-淀粉酶添加量、100 μL蛋白酶添加量和25 μL大鼠血清添加量进行响应面优化试验。
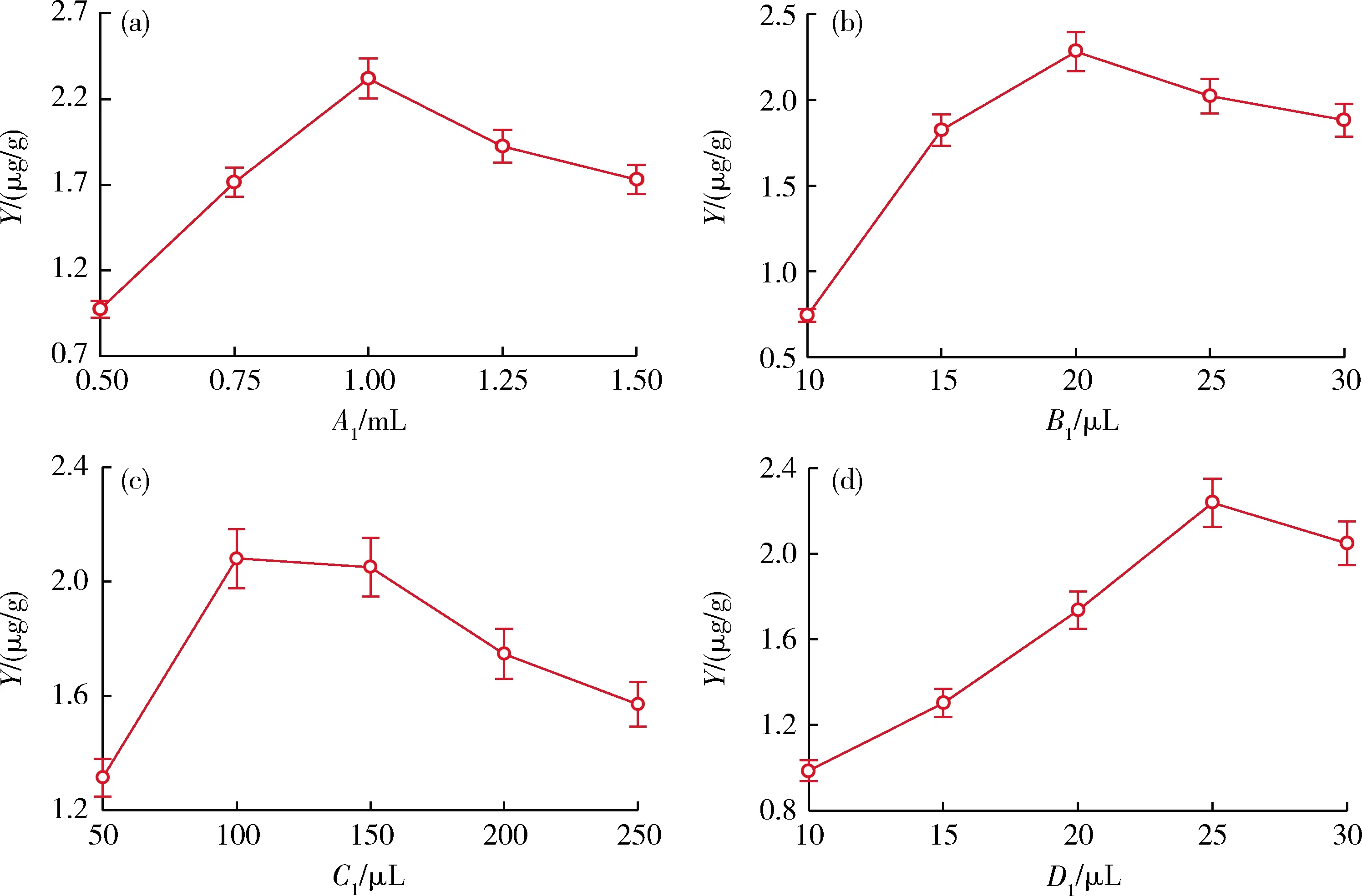
A1为提取液添加量;B1为α-淀粉酶添加量;C1为蛋白酶添加量;D1为大鼠血清添加量;Y为小米中叶酸质量分数测定值,图2同。A1 is extract volum; B1 is α-amylase volum; C1 is protease volum; D1 is rat serum volum; Y is folic acid detection, Fig.2 is the same as this one.图1 各提取因素对小米中叶酸质量分数测定值的影响Fig.1 Effects of different extraction conditions on the determination of folic acid concentration values in foxtail millet
2.2 三酶法提取小米叶酸的响应面分析
2.2.1模型回归系数显著性检验
利用Box-Behnken对得到的各影响因素试验模型,各影响因素经多元回归分析后,得到以小米中叶酸质量分数测定值(Y)为响应变量,以提取液添加量(A1)、α-淀粉酶添加量(B1)、蛋白酶添加量(C1)和大鼠血清添加量(D1)为响应值的二次回归方程为:
Y=2.31+0.29A1+0.16B1-0.067C1-
0.041D1+0.060A1B1-0.3A1C1+
0.31A1D1+0.19B1C1-0.077B1D1-
0.035C1D1-0.78A12-0.43B12-
0.12C12+0.06D12
(1)
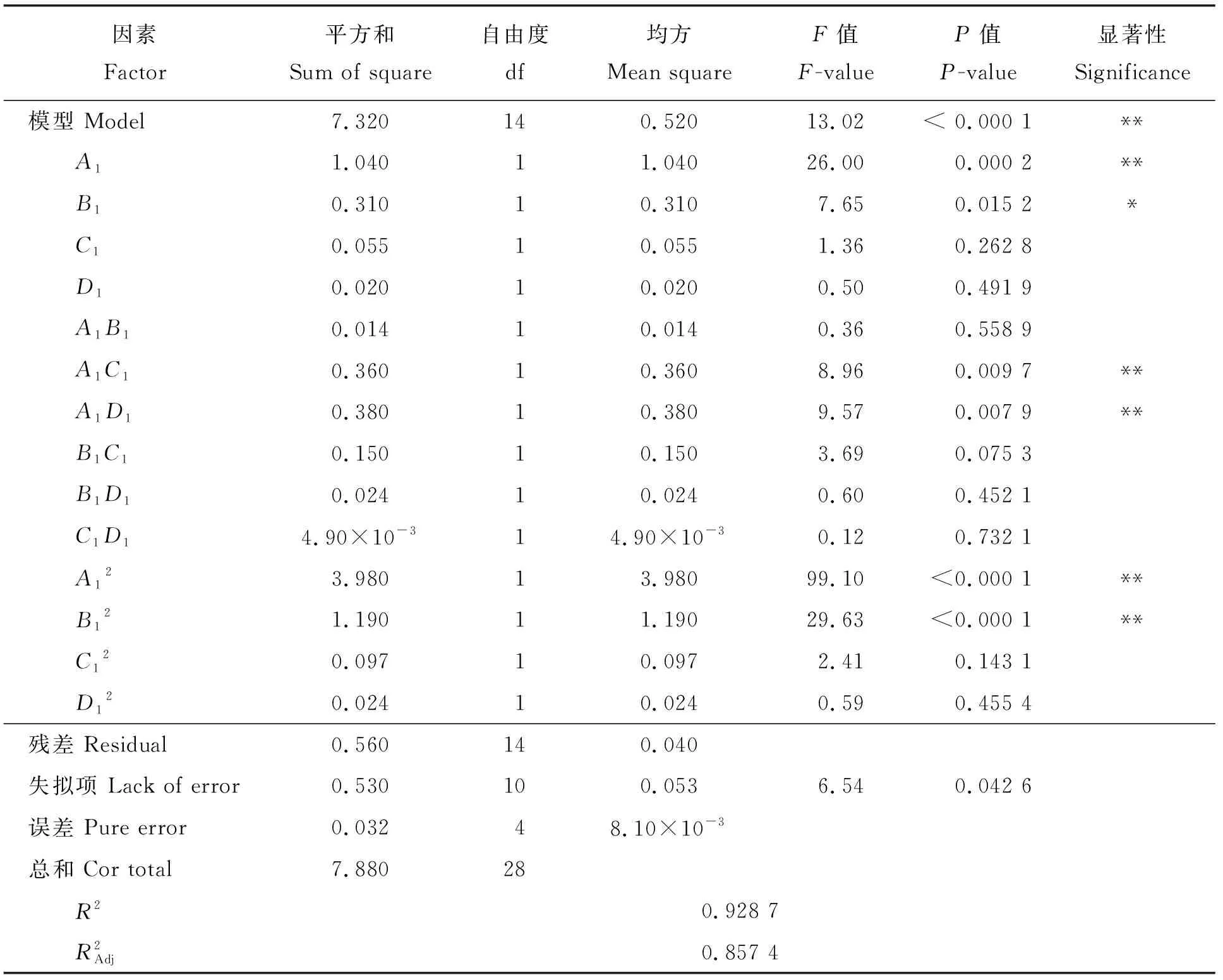
表3 模型回归系数显著性检验结果Table 3 Analysis of variance for the fitted regression model
2.2.2各提取因素响应面交互作用
提取液添加量(A1)、α-淀粉酶添加量(B1)、蛋白酶添加量(C1)和大鼠血清添加量(D1)交互作用对小米中叶酸质量分数测定值(Y)影响见图2。响应面坡度越陡峭,等高线越扁,且排列越密集,说明Y对各因素变化敏感,影响显著。由图2可知,A1C1、A1D1响应面曲线陡峭、相应底部的等高线较为密集,呈马鞍形,说明两因素之间交互作用显著,这与显著性分析结果相符。A1B1响应面对应的等高线接近圆形,表明A1B1交互作用对Y的影响不显著。B1C1、B1D1、C1D1响应面曲面较平缓,表明B1和C1、B1和D1、C1和D1交互作用对Y的影响不显著。
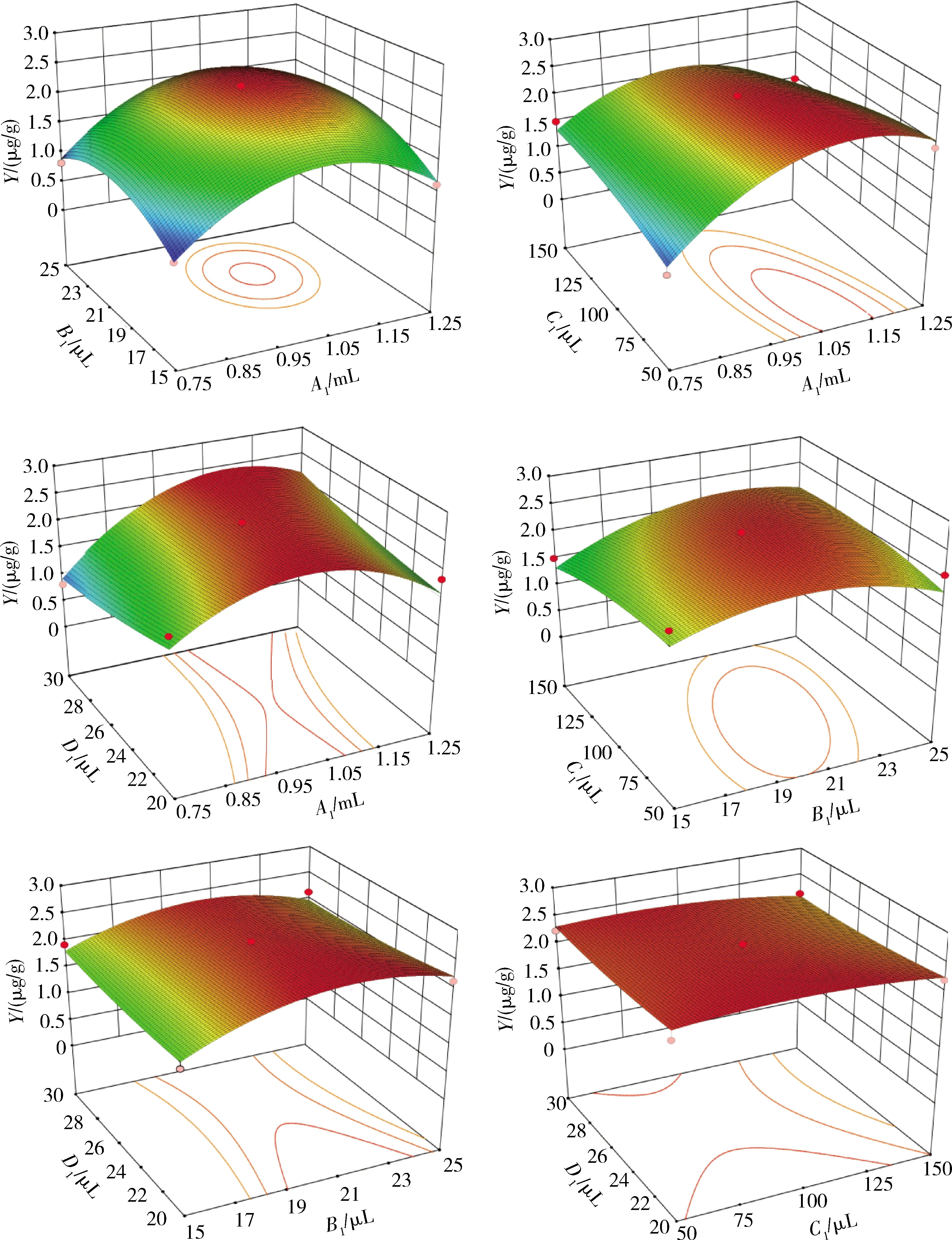
图2 各因素交互作用对叶酸质量分数测定值的影响Fig.2 The effect of various factors on the determination of folic acid concentration values
2.2.3最佳提取因素的确定和验证
通过响应面优化模型对三酶法的最佳提取因素进行预测,得到最佳提取因素为:提取液添加量1.09 mL、α-淀粉酶添加量20.88 μL、蛋白酶添加量140 μL、大鼠血清添加量25.88 μL。在此条件下得到的小米中叶酸质量分数测定值为2.40 μg/g。考虑到实际操作的简便性,将提取因素确定为:提取液添加量1 mL、α-淀粉酶20 μL、蛋白酶 150 μL、大鼠血清25 μL,经多次验证试验后,得到的小米中叶酸质量分数测定值为2.47 μg/g,与理论值基本吻合,证明此试验优化后的各提取因素是可靠的。
2.3 不同测定条件对小米中叶酸质量分数测定值的影响
HPLC法测定条件对小米中叶酸质量分数测定值的影响见图3。流速为1 mL/min时,小米中叶酸质量分数测定值较大为2.19 μg/g(图3(a))。流动相pH为6.5时,小米中叶酸质量分数测定值最大为2.24 μg/g(图3(b))。小米叶酸的最大吸收波长为280 nm(图3(c))。在试验设置水平范围内,柱温为30 ℃时,叶酸质量分数测定值较大为2.25 μg/g(图3(d))。因此,选取流速1 mL/min、流动相pH=6.5、波长280 nm和柱温30 ℃进行响应面优化试验。
A2为流速;B2为流动相pH;C2为检测波长;D2为柱温;Y为小米中叶酸质量分数测定值。图4同。A2 is flow rate; B2 is mobile phase pH; C2 is detction wavelength; D2 is column temperature; Y is determination of folic acid concentration values in foxtail millet. The same as in Fig.4.图3 测定条件对小米中叶酸质量分数测定值的影响Fig.3 Effect of determination conditions on the determination of folic acid concentration values in foxtail millet
2.4 HPLC法测定条件响应面优化
2.4.1模型回归系数显著性检验
根据流速(A2)、流动相pH(B2)、波长(C2)和柱温(D2)4个测定条件对小米中叶酸质量分数测定值(Y)的试验结果进行响应面优化模型试验,得到二次项回归方程为:
Y=2.27+0.27A2+0.31B2-0.26C2+
0.051D2+0.38A2B2+0.14A2C2+
0.053A2D2+0.18B2C2+0.027B2D2+
0.0075C2D2-0.60A22-0.41B22-
0.16C22+0.047D22
(2)
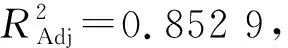
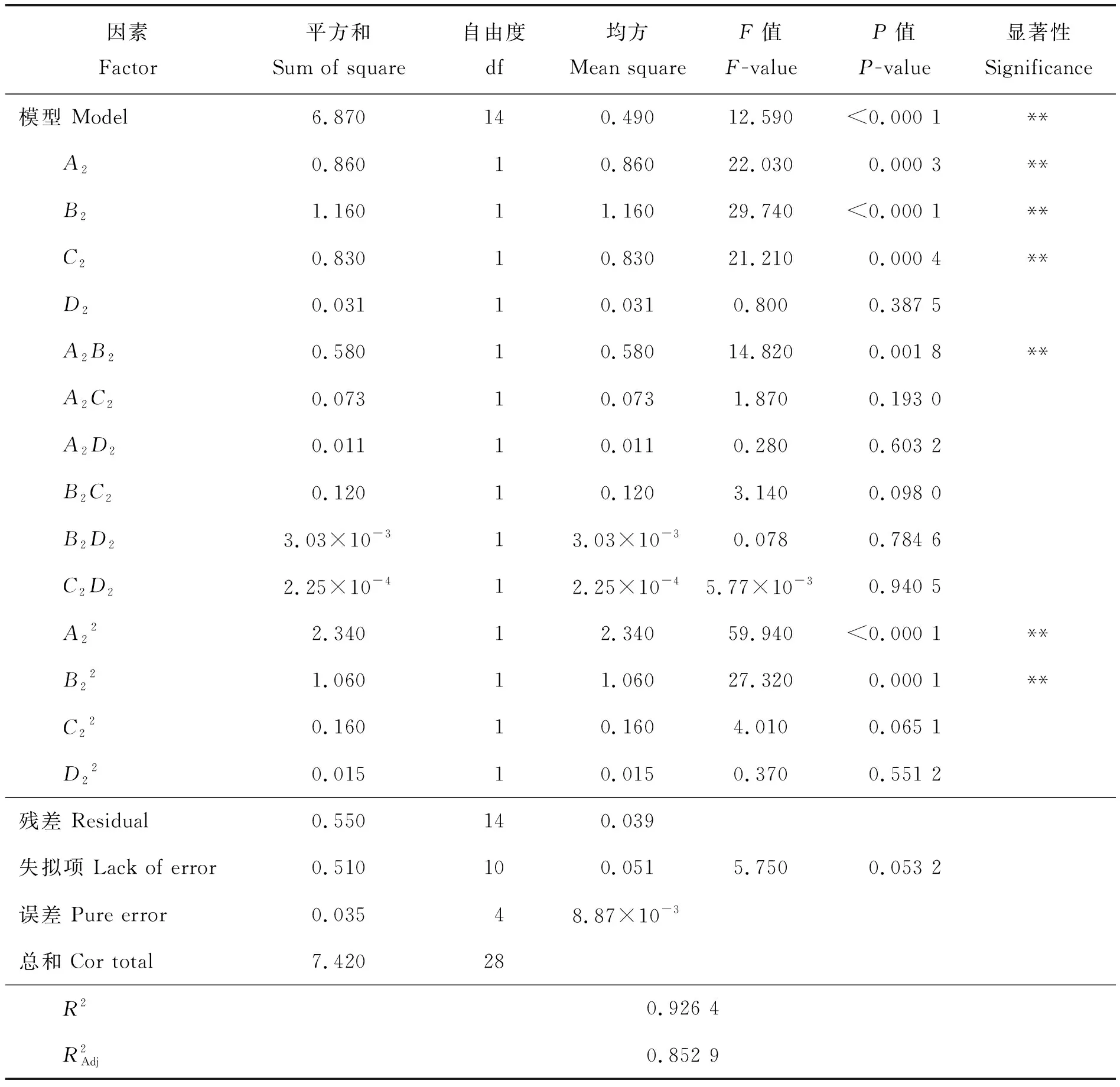
表4 模型回归系数显著性检验结果Table 4 Analysis of variance for the fitted regression model
2.4.2测定条件响应面交互作用
流速(A2)、流动相pH(B2)、波长(C2)和柱温(D2)交互作用对小米中叶酸质量分数测定值(Y)影响的见图4。A2B2响应面曲线陡峭,表明A2和B2之间相互作用显著,且随着A2和B2的增加,小米中叶酸质量分数测定值先增大后减小。当A2为0.9 mL/min左右时Y最大,B2为6.4左右时Y最大。B2比A2对应小米中叶酸质量分数测定值的抛物线更陡,说明小米中叶酸质量分数测定值与B2的相关性较大,A2和B2对Y的影响顺序为:B2>A2。A2C2、A2D2、B2C2、B2D2、C2D2响应面曲面较平缓,表明它们之间交互作用对Y的影响不显著。
2.4.3最佳测定因素的确定和验证
通过响应面优化模型对小米中叶酸测定的最佳条件进行预测,最佳条件应为流速0.92 mL/min、流动相pH=6.41、波长276.08 nm、柱温29.61 ℃。在此条件下预测的小米中叶酸质量分数测定值为2.48 μg/g。考虑到实际操作的简便性,将测定条件调整为:流速1 mL/min、流动相pH=7、检测波长280 nm、柱温30 ℃。经多次验证后,小米中叶酸质量分数测定值为2.51 μg/g,与预测值基本吻合,说明响应面优化法得到的二次回归方程具有较强的实际指导意义。
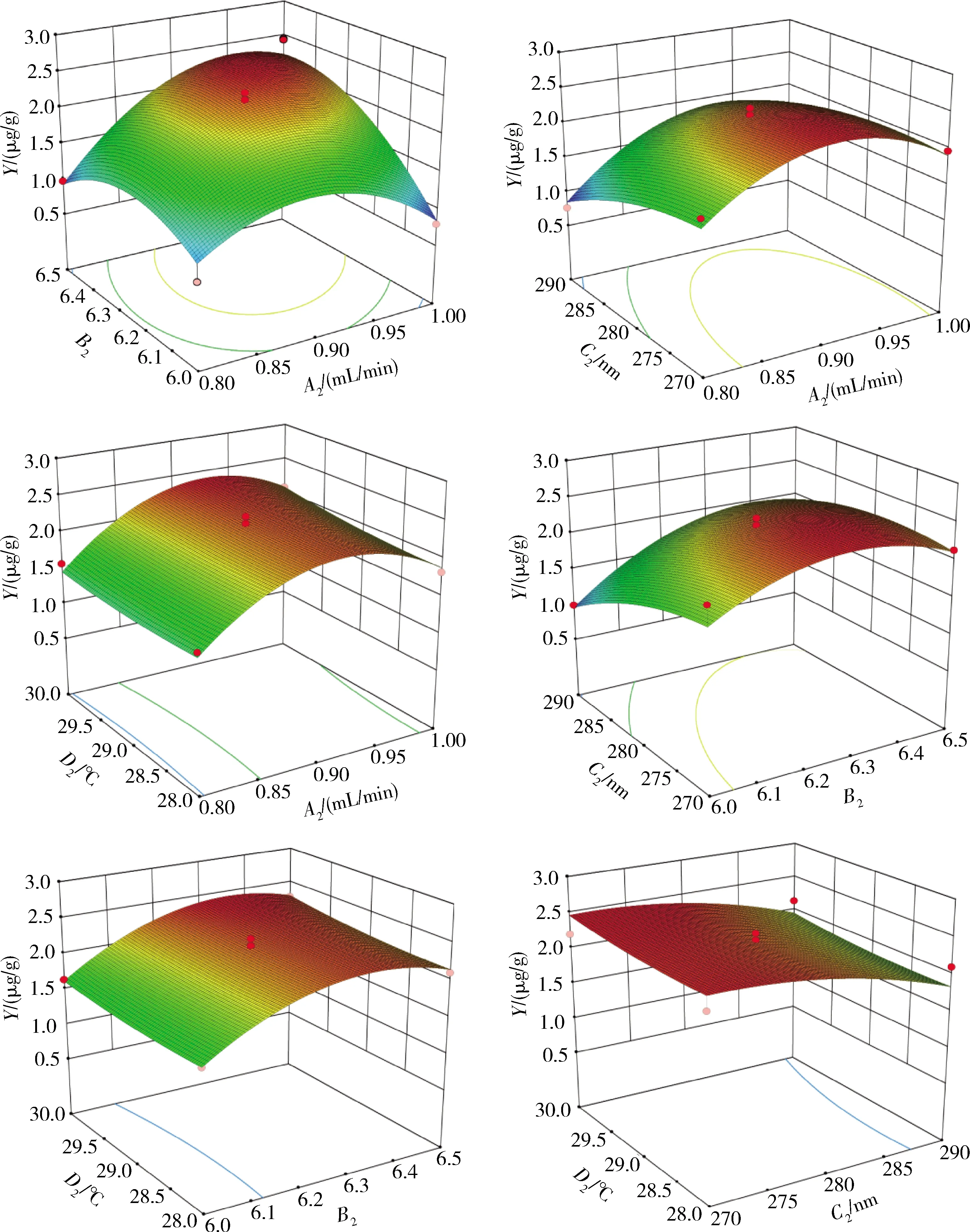
图4 测定条件交互作用对小米中叶酸质量分数测定值的影响Fig.4 Effect of the interaction of determination conditions on the determination of folic acid concentration values in foxtail millet
2.5 HPLC法叶酸测定加标回收率验证
以叶酸质量分数测定值为2.40 μg/g的小米为样品,取质量浓度为2 μg/μL的叶酸标准母液各0.5、1.0、1.5 μL加入样品叶酸提取液中,采用优化后HPLC法测定叶酸质量分数,每个样品3次重复。当加入1、2、3 μg叶酸时,叶酸回收率在分别为96.68%、96.79%和96.78%以上,平均叶酸回收率为97.82%,相对标准偏差RSD为0.79%(表5)。
2.6 HPLC法叶酸测定重复性验证
对质量浓度为50 μg/mL的叶酸标准溶液和小米样品叶酸提取液进行测定,每个样品5次重复。测得叶酸标准溶液和小米样品的叶酸质量分数分别为50.06 μg/g和37.12 μg/g,相对标准偏差RSD值分别为0.27%和0.50%,均小于1%(表6)。表明本试验精密度较好,样品提取重复性结果较好。

表5 叶酸测定加标回收率试验结果Table 5 Recovery rate for determination of folic acid with standard addition
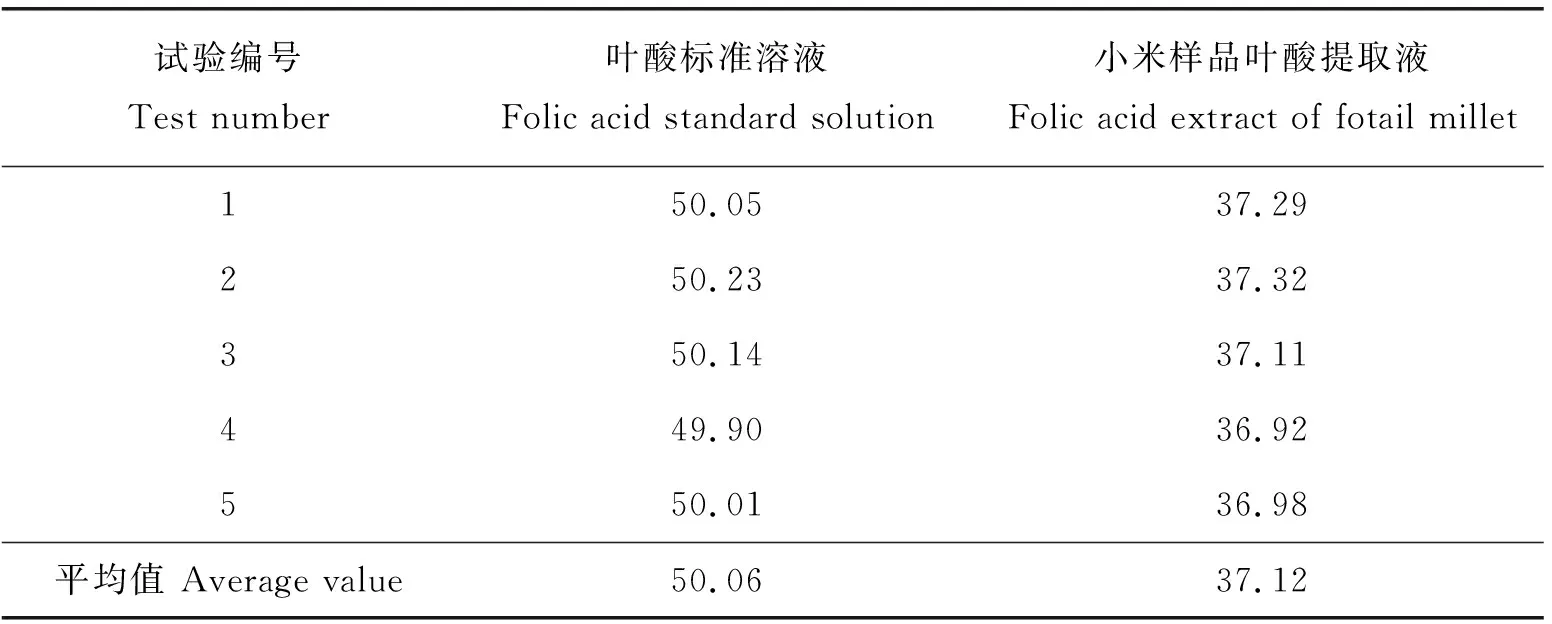
表6 叶酸质量分数测定重复性试验结果
3 讨论与结论
由于叶酸在提取过程中很容易被氧化降解,采用“三酶法”提取小米中叶酸,可以较好的防止叶酸被氧化。已有研究表明提取不同作物、组织的叶酸,提取液、α-淀粉酶、蛋白酶、大鼠血清添加量不同[7,9]。因此本研究针对“小米”中的叶酸提取条件进行优化,结果表明提取液添加量为1 mL,淀粉酶20 μL,蛋白酶150 μL,大鼠血清25 μL时提取效果最佳。图2中A1C1、A1D1响应面曲线陡峭、相应底部的等高线较为密集,说明两因素之间交互作用显著,这与显著性分析结果相符。虽然B1C1的等高线呈椭圆形,但是显著性分析结果却显示并无显著性关系(P=0.075 3),可能原因是α-淀粉酶对试验结果有显著影响,但是蛋白酶使用量对叶酸提取效果并无显著影响。因此在试验中,应综合考虑回归模型显著性检验结果与响应面结果。
目前测定叶酸的方法很多,Puwastiena等[25]对国际上研究食品叶酸测定的26个实验室的叶酸检测方法进行了评价,发现在使用同一种方法检测相同食品的叶酸也存在较大变异系数。因此在食品叶酸分析中,规范叶酸的提取和检测方法是极其重要的。虽然目前用于食品叶酸分析的国家标准(GB 5009211—2014)方法是微生物法,但是罗敏婷等[11]在对比微生物法、高效液相色谱法检测叶酸时发现,微生物法检测结果与样品明示值偏差过大。《中华人民共和国药典》[26]第四部中规定,当待测成分含量为100%时,重复性RSD可接受范围为1%,重现性RSD可接受范围为2%,本研究采用高效液相色谱(HPLC)法测定小米叶酸,平均叶酸回收率为97.82%,相对标准偏差RSD为0.79%。而采用间接荧光法[6]测定小米叶酸含量的相对标准偏差分别为1.68%,可见高效液相色谱法是更适合小米中叶酸测定的方法。
叶酸提取效果是影响叶酸精确定量分析的首要问题,本研究对小米中的叶酸提取条件进行优化,结果表明提取当液添加量为1 mL,淀粉酶20 μL,蛋白酶150 μL,大鼠血清25 μL时提取效果最好。利用HPLC法测定小米中叶酸含量,发现当流速1 mL/min、pH为7、检测波长280 nm、柱温30 ℃的时测定效果最佳。经重复性试验证实,该方法稳定可靠,可用于大规模叶酸含量测定。
