西藏牦牛牛支原体的分离鉴定及其生长特性、耐药性分析
2020-11-26王冬经徐业芬索朗斯珠严明帅赵霞玲牛家强
王冬经 徐业芬 索朗斯珠 严明帅 赵霞玲 朱 勇 牛家强*
(1. 西藏农牧学院 动物科学学院,西藏 林芝 860000;2.西藏农牧学院 西藏高原动物疫病研究自治区高校重点实验室,西藏 林芝 860000;3.西藏农牧科学院 畜牧兽医研究所,拉萨 850000)
牦牛(Yak)是一个古老的物种,因其能够适应高海拔、低含氧量、低气压、昼夜温差大和牧草匮乏等其他牛种难以适应的高寒草地生态环境而得以延续至今,是我国高原地区珍贵的优势畜种资源,也是一个宝贵的遗传基因库[1]。牦牛可提供肉、乳、毛等畜产品,也可使役,其粪便是当地重要的燃料来源,是青藏高原地区不可或缺的重要畜种[2]。我国约有牦牛1 500余万头,主要分布于青海、西藏、甘肃、四川、云南和新疆,其中西藏牦牛约占全国总数的三分之一[3],在农牧业生产中占有极其重要的地位。特殊的高原环境容易导致牦牛患呼吸道疾病,其中巴氏杆菌(Pasteurellosis)和牛支原体(Mycoplasmabovis)引发的感染较为多见。
牛支原体是牛呼吸道疾病综合征(BRDC)病原之一[4],可引起牛肺炎、乳腺炎、关节炎、角膜结膜炎等[5]。早在1961年,Hale等[6]首次从患有乳腺炎病牛乳汁中分离到了该病原体。黎济申等[7]1983年首次从乳房炎病牛乳汁中分离到了牛支原体。石磊等[8]2008年首次报道了湖北省由牛支原体引起的以肺组织肉变、坏死为主要特征的肉牛呼吸道传染病,并命名为“传染性牛支原体肺炎”。自此之后,牛支原体相关疾病先后在重庆、宁夏等地相继报道[9-10],该病的广泛传播与迅速蔓延给我国养牛业造成了巨大的经济损失。
牛支原体病的实验室诊断主要有血清学、病原学、分子生物学方法[11]。流行病学调查及初步诊断常采用血清学方法,但进一步确诊需采用病原分离和分子生物学的方法。目前,ELISA法是血清学方法中最常用的方法之一,被广泛应用于牛支原体感染的流行病学调查,但不同检测试剂盒的特异性和准确性存在一定差异[11];病原分离培养法虽然难度较大,周期较长,但其结果直观可靠、简明直接,是确诊该病最可靠的方法之一[12]。分离中常采用生理生化鉴定和分子生物学鉴定等方法辅助诊断,其中分子生物学方法可准确、快速地对培养物进行鉴定。由于牛支原体与无乳支原体16S rRNA基因高度相似,两者难以区分,因此需采用牛支原体高度保守基因进行鉴别诊断,目前使用较多的诊断基因主要有uvrC、OPPD/F等[13-14]。
2012年李坤等[15]通过酶联免疫吸附试验(ELISA)法检测发现,西藏多地牦牛感染牛支原体,其中以日喀则、昌都、拉萨等地牦牛牛支原体感染最为严重。2017年以来,西藏多地牦牛出现以食欲下降、消瘦、呼吸急促、发热、咳嗽为其特征的疫病,经抗生素治疗,效果不佳,常转化为慢性呼吸道病,疑似牛支原体感染。鉴于此,本团队于2019年采集西藏部分地区有呼吸道症状的牦牛鼻拭子进行牛支原体的分离鉴定,在病原分离纯化的基础上,合成16S rRNA基因引物及uvrC特异性基因引物对分离株进行分子鉴定,并对牛支原体牦牛分离株生长特性及体外药物敏感性进行了分析,旨在从病原角度证实牛支原体在牦牛中的流行,并对当前流行株进行初步研究,为今后牦牛牛支原体病的防控提供科学依据。
1 材料与方法
1.1 病料来源
通过鼻拭子采集具有咳嗽、喘息、呼吸急促、鼻液较多等呼吸道症状的西藏牦牛鼻腔粘液145份,分别置于装有少量PPLO液体培养基(内含有青霉素,可抑制杂菌)的离心管中,快速运送至实验室并进行病原分离培养或冷藏处理。
1.2 主要试剂与仪器
1.2.1主要试剂
PPLO broth、PPLO agar、Yeast Extract、Agar(BD公司,美国);Sodium pyruvate(Sigma公司,中国);苯酚红(国药集团化学试剂有限公司,中国);NaCl、NaOH、冰醋酸、无水乙醇(天津市致远化学试剂有限公司,中国);马血清(Hyclone公司,美国);青霉素钠(山东聖旺药业股份有限公司,中国);2xTaq PCR MasterMix、Marker DL2 000、核酸染料(天根生化科技有限公司,中国);MEM(GIBCO公司,美国);Tris、Agarose M (BBI LIFE SCIENCES公司,中国);EDTA(SANGON BIOTECH公司,中国);生化鉴定管、K-B药敏纸片(杭州微生物试剂有限公司,中国)。PPLO固体培养基和PPLO液体培养基参照文献[8]方法制备,置于4 ℃冰箱,保存备用。
1.2.2主要仪器
纯水仪(ELIX10);ABI PCR仪(Power pac);离心机(1730R);CO2恒温培养箱(GNP-9050);电泳仪(Powerpac);凝胶成像仪(G:BOX);微量移液器(Eppendorf);电子天平(JA2103 N);酶标仪(RT-6100);pH计(PHS-3C)均来自西藏高原动物疫病研究自治区高校重点实验室。
1.3 病原的分离与纯化
病原分离与纯化参照师燕霞等[13]的方法并进行适当调整,具体方法为:向装有鼻拭子的离心管中分别加入6 mL PPLO液体培养基,充分震荡混匀后,2 000 r/min离心6 min,取上清液,用0.45 μm滤器过滤得到约5 mL液体,置于37 ℃,5% CO2恒温培养箱培养3~4 d,培养液由红变黄后,按照 1∶10 的比例传代培养至3~4代后,涂布于PPLO固体培养基,培养4~5 d,挑取单个菌落接种于PPLO液体培养基。如此“固-液”交替进行培养物的纯化。
1.4 生化鉴定
分别按照各生化鉴定管使用说明书进行。
1.5 DNA提取
采用煮沸法提取牛支原体基因组DNA[16]。
1.6 引物设计与合成
参照文献设计牛支原体uvrC特异性基因引物[17]与16S rRNA基因引物[18],并由天一辉远生物有限公司合成。
1.7 PCR扩增与测序
参照白智迪[17]的反应体系及反应条件进行uvrC特异性基因的PCR扩增;参照郭亚男等[18]的反应体系及反应条件进行16S rRNA基因的PCR扩增。
将上述PCR产物进行1%琼脂糖凝胶电泳,并通过凝胶成像系统观察结果。PCR产物经初步鉴定后送至生工生物工程有限公司进行测序。
1.8 序列分析
采用DNA Star软件将分离株uvrC特异性基因序列、16S rRNA基因序列分别与不同参考株进行比对,并采用MAGA 7.0软件分别进行系统进化树构建。参考株信息如表1所示。
1.9 生长曲线的测定
随机选取3 株牛支原体分离株,按照1∶10的比例接种至PPLO液体培养基,置于37 ℃恒温培养3~4 代使之生长稳定,作为待测液。将待测液按照1∶10的比例接种,每个菌株设置3 个重复,从培养0 h开始,每隔6 h测定1次OD630及其pH,至126 h结束。以菌液培养时间为横坐标,以平均OD630、pH为纵坐标,绘制相应菌株的生长曲线。
1.10 药敏试验
本次选用14种药敏纸片进行耐药性试验,分别为强力霉素、四环素、阿奇霉素、红霉素、氟苯尼考、新霉素、链霉素、大观霉素、庆大霉素、卡那霉素、林可霉素、环丙沙星、恩诺沙星和氧氟沙星。药敏试验操作步骤及判定标准严格按照说明书及CLSI判定标准进行[19],菌液接种平板之后,均匀贴上药敏纸片。直径为150 mm的平板贴12张药敏纸片,直径90 mm的平板贴6 张药敏纸片。置于37 ℃培养7 d,测定抑菌圈大小。
2 结果与分析
2.1 病原分离与菌落形态观察
145份鼻腔粘液样品中,10份得到了纯培养物。纯培养物经PPLO固体培养基培养后,在低倍镜下观察到“煎蛋状”菌落形态(图1),初步确定为牛支原体,并分别命名为Tibet-1、Tibet-2、Tibet-3、Tibet-4、Tibet-5、Tibet-6、Tibet-7、Tibet-8、Tibet-9和Tibet-10。
2.2 生化鉴定
生化鉴定结果显示:10株分离株均不发酵葡萄糖和乳糖,不水解明胶和精氨酸,不分解尿素和甘露醇,且胆固醇试验为阳性。
2.3 PCR检测
以10株分离株的DNA为模板,进行PCR扩增,并通过1%琼脂糖凝胶电泳确认。结果表明,uvrC特异性基因引物和16S rRNA引物经PCR扩增分别得到238 bp(图2(a))和1 500 bp(图2(b))的片段,与预期结果相符。

表1 uvrC特异性基因和16S rRNA基因序列参考株信息表Table 1 Information on reference strains of uvrC specific and 16S rRNA gene sequences
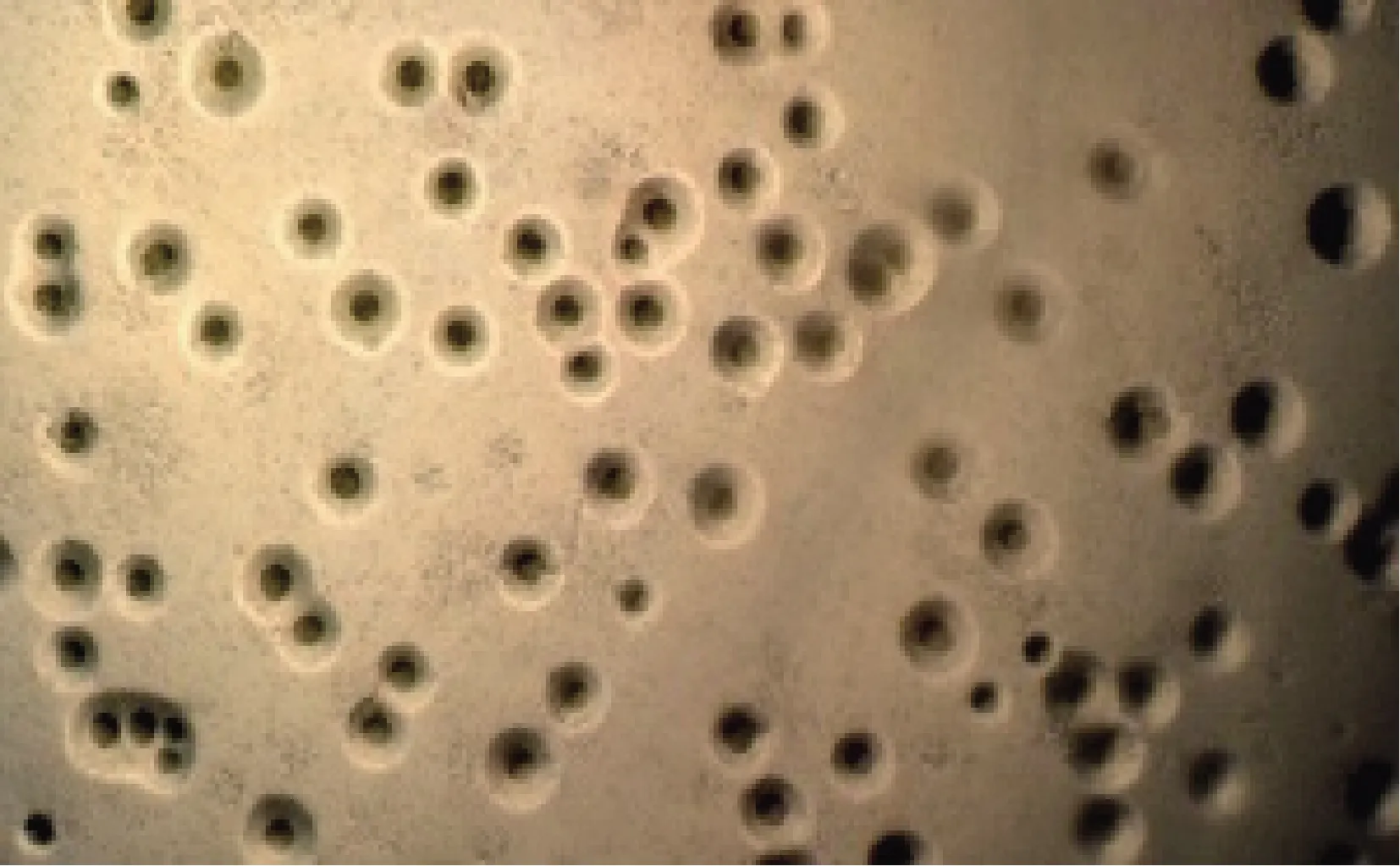
图1 分离株菌落形态(40X)Fig.1 Colony morphology of Mycoplasma bovisisolates (40X)
2.4 序列分析
2.4.1同源性分析
uvrC同源性分析结果显示,10株西藏牦牛牛支原体分离株之间同源性为98.9%~100%;与我国牛支原体地方株同源性为98.4%~100%;与日本株同源性为98.4%~100%;与瑞士株同源性为98.4%~100%;与国际标准株PG45的同源性为98.4%~100%;与无乳支原体标准株PG2(Maga PG2)的同源性为76.6%~80.7%;与丝状支原体丝状亚种SC型PG1标准株(MmmSC PG1)的同源性为56.3%~57.2%。

M:DNA标记DL2 000;N:阴性对照;1~10依次分别为分离株1~10的扩增产物M: Marker; N: negative control; 1-10 is the amplification products of the isolates 1-10 in turn图2 牛支原体分离株uvrC特异性基因(a)和16S rRNA基因(b)PCR扩增Fig.2 Amplification of uvrC specific gene and 16S rRNA from Mycoplasma bovis isolates
16S rRNA基因同源性分析结果显示,10株西藏牦牛牛支原体分离株之间序列同源性为 99.4%~100%;与我国牛支原体地方株的同源性为99.1%~100%;与日本株同源性为99.2%~100%;与匈牙利株的同源性为99.1%~100%;与瑞士株同源性为99.2%~100%;与PG45株同源性为99.1%~99.9%;与PG2株的同源性为 98.2%~98.7%;与PG1、PG3、G5的同源性为80.1%~80.7%。
2.4.2基因进化树分析
牦牛牛支原体uvrC进化树显示,10株西藏牦牛牛支原体分离株uvrC序列相似度较高,且与牛支原体我国地方株、牛支原体日本株、牛支原体瑞士株、国际标准株PG45处于同一分支,而与无乳支原体标准株PG2和丝状支原体丝状亚种SC型标准株PG1处于不同分支(图3(a))。牦牛牛支原体16S rRNA基因进化树分析结果表明,分离株与牛支原体标准株PG45处于同一分支,亲缘关系较近,但与无乳支原体标准株PG2处于不同分支,因此证明上述分离株属于牛支原体。10株牛支原体分离株与13株牛支原体参考株的分布在进化树上聚集为 3大簇:牛支原体分离株Tibet-1、Tibet-2、Tibet-6、Tibet-9和参比株08M、16M、CQ-W70、Ningxia-1、FJ-HJ、HB0801株聚为一簇。其中,Tibet-1和Tibet-9与FJ-HJ亲缘关系最近、Tibet-2与08M亲缘关系最近、Tibet-6与16M亲缘关系最近;牛支原体分离株Tibet-3、Tibet-4、Tibet-5、Tibet-10和参比株Hubei-1、JF4278、KG4397聚为一簇。其中,Tibet-3、Tibet-4、Tibet-5与Hubei-1亲缘关系最近、Tibet-10与JF4278亲缘关系最近;牛支原体分离株Tibet-7、Tibet-8和牛支原体参比株NM2012、MYC2、MYC22聚为一簇。其中,Tibet-7与NM2012亲缘关系最近、Tibet-8与MYC22亲缘关系最近(图3(b))。
本试验从145份样品中得到的10份纯培养物,经菌落形态观察、生化鉴定、PCR鉴定及序列分析,证实其均为牛支原体,其分离率为6.90%(10/145)。

图3 uvrC特异性基因(a)和16S rRNA基因(b)基因进化树Fig.3 Evolutionary tree of amplification of uvrC specific gene (a) and 16S rRNA gene (b)
2.5 生长曲线测定
试验结果显示,10株分离物的OD630及平均pH变化趋势一致,这里仅列出3株分离物的结果。根据3株西藏牦牛牛支原体分离株在PPLO液体培养基中不同时间点的平均OD630及平均pH分别绘制生长曲线如图4(a)、图4(b)所示。分离株在PPLO培养基中生长126 h,其中,培养24 h内为迟缓期,培养42 h开始进入稳定期,78 h后开始进入衰亡期;3个分离株培养物的平均pH随着培养时间延长pH不断降低,其中24~42 h期间pH下降最快,随后下降速度减慢,至78 h后几乎不再变化。

图4 牛支原体分离株不同时间点OD630(a)和pH(b)变化Fig.4 OD630 (a) and pH (b) of Mycoplasma bovis isolates at different time points
2.6 药敏试验
药敏试验结果如表2所示,所有分离株均对一种或多种药物产生了耐药,40%的分离株对林可霉素耐药;30%的分离株对阿奇霉素、环丙沙星耐药;20%的分离株对红霉素、氟苯尼考、大观霉素、氧氟沙星耐药;10%的分离株对四环素、新霉素、链霉素、庆大霉素、恩诺沙星耐药,但10株牛支原体对强力霉素、卡那霉素均表现为敏感或中度敏感。

表2 牛支原体分离株耐药性检测Table 2 Antimicrobial susceptibility test of Mycoplasma bovis isolates
3 讨 论
牛支原体被公认为影响全球养牛业的一种重要病原体,目前已遍布英国、法国、德国、瑞士、澳大利亚、丹麦、墨西哥、西班牙、以色列以及北美各国[20]。近十年来,全球相关研究者对此病原体进行了大量研究,到目前为止还没有有效的商业化疫苗来预防牛支原体病[21],也没有彻底治疗此病的特效药物。临床常用抗生素虽有一定疗效,但随着使用次数和频率的增加,病原对药物的敏感性就会降低甚至产生耐药,带菌牛常常成为主要传染来源,这也是造成牛支原体感染率升高的重要原因。因此,进行牛支原体流行病学调查对于该病的监测和防控具有重要的现实意义。
2015年,李坤等[15,22]报道了2012和2013年间西藏牦牛牛支原体的感染状况,其感染率分别为44.32%和47.44%,但未进行病原的分离鉴定。2017年,本团队成员检测发现,西藏牦牛牛支原体感染率高达46.10%[23]。据资料显示,目前我国西藏、青海、甘肃和四川牦牛群中均存在牛支原体的感染[24],且在西藏林芝地区牦牛、黄牛和犏牛感染率均较高[25]。本研究在前期血清学调查基础上,采集牛支原体血清抗体检测为阳性且具有呼吸急促、咳嗽、食欲不佳和流鼻腔粘液等症状的病牛鼻腔粘液进行病原分离鉴定,并成功分离到10株牛支原体。同时,本研究也证实了病牛可通过鼻腔粘液排出病原体,这将对同群牛和环境造成污染,在西藏牦牛、黄牛混养、散养、半圈养模式下,则更容易造成病原在牛群环境中的扩散和漫延。因此,养殖过程中应注意该病的监测,及时淘汰病牛,不引进阳性牛,尽量避免合群混养,定期进行环境消毒等。
牛支原体无细胞壁结构,其基因组仅为106bp左右,缺少大多数代谢所需的酶,不发酵葡萄糖和乳糖,不能水解明胶和精氨酸,也不能分解尿素和甘露醇,因此体外培养难度大,需在培养基中加入马血清、丙酮酸钠、MEM等物质以满足其对碳源和含氮化合物的营养需求,同时需向培养箱中通入5% CO2。本试验从145份样品中分离到牛支原体10株,分离率仅为6.90%,一方面可能由于此次样品采集的时间为春季,而非秋末冬初或冬末春初呼吸道病多发期;另一方面是由于牛支原体对营养要求苛刻,体外培养周期长、难度大;此外,牛支原体常与多杀巴氏杆菌、溶血曼氏杆菌等混合感染,抗生素往往不能完全抑制杂菌的生长,分离中容易造成污染,降低分离率。
近年来,国内外研究学者围绕牛支原体膜蛋白、亚单位疫苗和灭活苗等进行了大量研究,但由于不同菌株在转录组学、膜蛋白结构组学上的差异,其免疫效果不容乐观。因此,具有强感染力和低毒力菌株的筛选,对研制确实安全有效的牛支原体疫苗极其迫切且意义重大,而牛支原体的分离鉴定是筛选优势菌株及牛支原体疫苗研究的前提和基础。分离株对数生长期、稳定期等测定,对今后开展病原分离培养、最佳传代时间选择、核酸提取及疫苗相关研究具有基础性作用。由于目前世界上仍没有用于预防牛支原体病的高效、稳定、商业化疫苗,抗生素的大量使用依然是目前控制牛支原体病的重要手段。然而,由于滥用抗生素导致的牛支原体耐药性的产生,已成为困扰养牛业的一大难题,正在逐步引起国内外相关人士的重视[26]。本次所有牛支原体分离株均存在不同程度的耐药性,不同分离株对同一类药物的具体药物存在不同的敏感性,这可能与当地用药种类和频率有关。本研究为临床防控提供参考,为今后开展牛支原体致病机理、疫苗等研究奠定基础。临床中推荐选用强力霉素、卡那霉素进行治疗。本研究对西藏牦牛牛支原体病的治疗具有一定指导意义,临床中应制定合理的用药交替方案,同时采取综合性防控措施,避免对抗生素的过度依赖或大剂量使用。
4 结 论
本研究自采集的145份西藏牦牛鼻腔粘液样本中成功分离并鉴定了10株牛支原体,对其进行培养,培养24 h内为迟缓期,42 h开始进入稳定期,78 h 后开始进入衰亡期;体外药物敏感性试验显示,所有分离株均对一种或多种药物产生了耐药,但10株牛支原体对强力霉素、卡那霉素均表现为敏感或中度耐药,为指导临床科学用药和防控提供依据。
