新型冠状病毒疫苗的研究进展
2020-11-26邓强王子晨吴沁郭城陆家海
邓强,王子晨,吴沁,郭城,陆家海*
(1.中山大学公共卫生学院热带病防治研究教育部重点实验室One Health研究中心∥广东省重大传染病预防和控制技术研究中心,广东广州 510080;2.美国加州大学欧文分校公共卫生学院,加州尔湾92697;3.美国哥伦比亚大学公共卫生学院,纽约 10032)
2019年12月31日中国首次报道了由严重急性呼吸系统综合征(severe acute respiratory syndrome,SARS)2型冠状病毒(SARS-CoV-2)引起的新型冠状病毒病(Corona Virus Disease 2019,COVID-19)[1].COVID-19几乎对全球所有的国家都造成破坏性的影响,据中山大学One Health研究中心新发传染病预警系统[2]的实时数据显示,截至2020年9月29日,全球死亡病例超过100万例(国内4 746人,国外100.957 7万人),累计确诊病例超过3 000万例(国内9.106 1万人,国外3 353.030 3万人)[2].该病毒的传播性和致病性强、危害性大,目前暂时没有针对SARS-CoV-2的特异性抗病毒药物或疫苗,全球有78亿人面临SARS-CoV-2感染以及COVID-19发病和死亡的风险,人们期盼开发出有效和安全的COVID-19疫苗(以下简称“新冠疫苗”)来遏制这场COVID-19大流行.在全球范围内,科研人员在争分夺秒地研发新冠疫苗,目前已有180多种新冠疫苗处于不同的开发阶段,其中9种新冠疫苗正在进行Ⅲ期临床试验,Ⅲ期临床试验证明有效和安全的疫苗可能在2021年进入市场[3].本文就疫苗的研发、新冠疫苗Ⅲ期临床试验国内外现状及其面临的挑战进行综述.
1 疫苗的研发
从开始获取病毒到完成疫苗Ⅲ期临床试验的整个过程称为疫苗的研发阶段,包括5部分:实验室研制,临床前研究,Ⅰ、Ⅱ和Ⅲ期临床试验(表1).传统疫苗的研制需要较长时间,通常为12~15年.近年来,随着技术的进步,疫苗研发速度也大为提升,但是一般情况下也需要2~5年的时间[4].

表1 疫苗的研发阶段Table 1 Vaccine development
疫苗的设计是基于对病原体与机体相互作用机制的充分了解,而这个过程需要相当漫长的时间.获得疫苗初产品后,在正式进入临床试验前的一个重要流程是进行临床前研究,它是决定疫苗是否能进行人体试验的关键,主要包括疫苗的生产工艺设计,有效性、稳定性和安全性等方面的考察.其中疫苗生产工艺的设计与评估极其重要,它直接影响到产品的质量与安全性[5].临床前研究阶段主要是通过构建细胞和动物模型进行相关实验,动物模型通常为鼠、兔子和灵长类动物(通常为恒河猴)等[6].通过观察和评价疫苗对动物或细胞的影响,决定其是否能进一步进行人体的接种.在这一阶段之后,申请一种试验性新药(investigational new drug,IND),并进行Ⅰ期临床试验,≤100例成人受试者,试验顺序是先成人后儿童再婴幼儿,以评估其安全性和耐受性,并获得一些免疫原性数据,大约历时2年.SARS疫苗经历了1年4个月才进入临床Ⅰ期临床试验[7].如果前期结果比较理想,并且资金充足,那么候选疫苗将进入Ⅱ期临床试验,也就是扩大样本(300例健康受试者)的随机、双盲和对照试验,以进一步确定剂型、剂量、免疫程序及途径,评估免疫原性和安全性,大约历时2年.中东呼吸综合征(Middle East respiratory syndrome,MERS)疫苗经历了6年才进入Ⅱ期临床试验[8].第二阶段评估过后,即进入Ⅲ期临床试验(一般受试者为数千至几万例),一般采取随机、双盲和对照试验方法,以充分评估其有效性与安全性,大约历时2年.Ⅲ期临床试验进展的快慢受很多因素影响,例如受试者人数、组数和结果等.该阶段也是疫苗获得上市前的最后一轮试验.如果第三阶段的结果满足预期的目标,则向监管机构提交生物制品许可证申请.疫苗允许上市后,还需要通过Ⅳ期临床试验进一步评价其在人群中的实际预防效果及观察不良事件的发生[9].可见,从疫苗的研发到上市是一个复杂而漫长的过程,同时每一阶段的评估都是极其重要的.只有当研发人员评估疫苗失败的风险较低,而且疫苗仍然有市场价值时,疫苗研发才会从前一个步骤推进到下一个步骤.
2 新冠疫苗Ⅲ期临床试验国内外现状
根据世界卫生组织(World Health Organization,WHO)统计数据(https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines),全球有超过180多种候选新冠疫苗目前正在开发中[10].2020年1月初,首个新型冠状病毒的基因序列公布并可用,新冠疫苗开始研发.2020年3月,Moderna[3]研发首个mRNA-1273疫苗进入人体试验(Ⅰ期临床试验).2020年9月,全球已经有9款新冠疫苗进入了Ⅲ期临床试验,即进入了批量生产前的最后一轮大规模人群试验,包括4种腺病毒载体疫苗(Ad26COVS1、ChAdOx1nCOV-19、Gam-COVID-Vac和Ad5-nCoV)、3种灭活疫苗(BBIBP-CorV、PiCoVacc和Vero cell)和2种mRNA疫苗(mRNA-1273和BNT162b1)(表2).现对截至2020年9月29日国内外进入Ⅲ期临床试验的新冠疫苗的相关信息进行回顾.
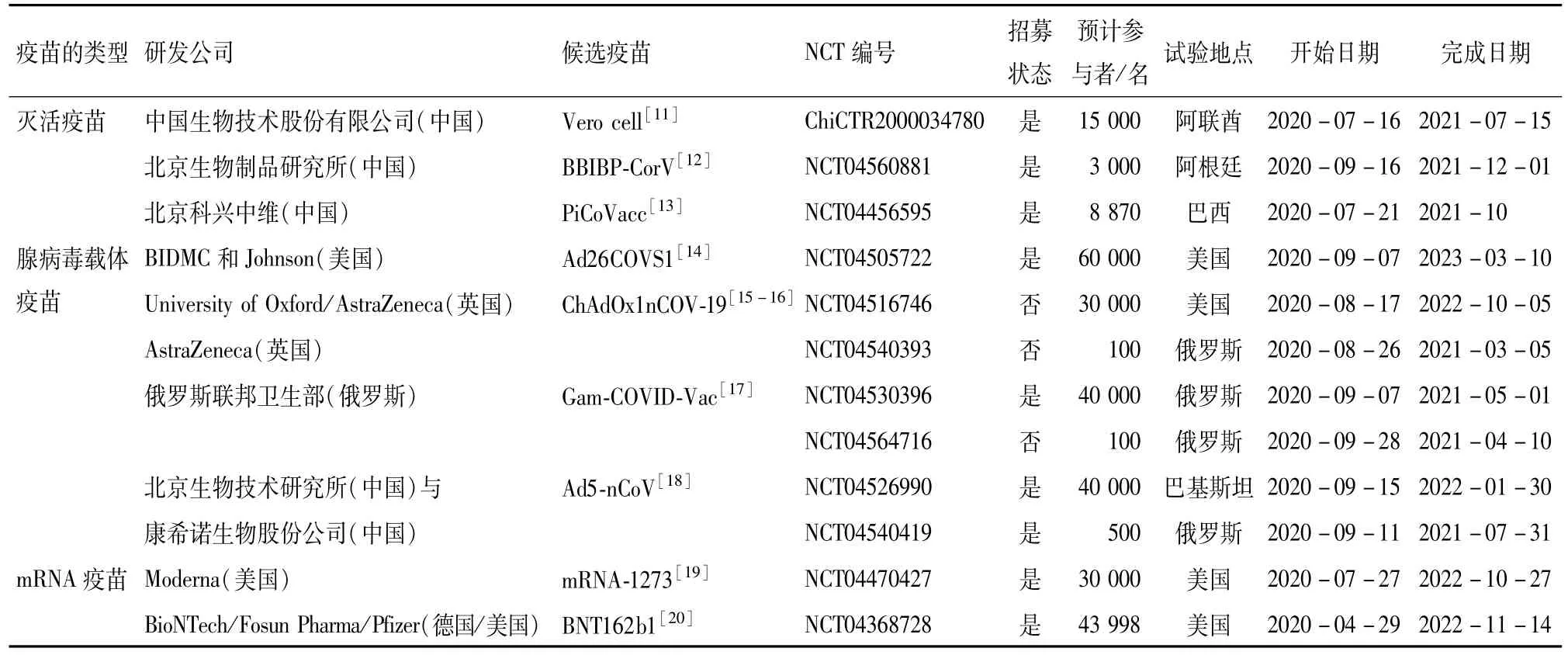
表2 全球共9种新冠疫苗进入了Ⅲ期临床试验(截至日期2020年9月29日)Table 2 A total of 9 COVID-19 vaccines worldwide have entered PhaseⅢclinical trials(2020-09-29)
2.1 新冠疫苗Ⅲ期临床试验国内现状
2.1.1 灭活疫苗
秦川团队研发的灭活疫苗PiCoVacc是全球首个公开动物实验结果的新冠疫苗.灭活疫苗也称全病毒疫苗,是通过β-丙内酯、福尔马林、加热和化学方法等手段处理,进行灭活和纯化制备成的疫苗,灭活疫苗可由整个病毒组成,也可由其裂解片段组成[21].灭活的病毒失去了其致病性,保留了病毒衣壳的主要抗原特性,通过激发动物的体液免疫达到免疫效果.在面对新发传染病时,灭活疫苗研发的工艺路线较为成熟,各个质量控制点和评价方法更为明确,规模化生产工艺对接容易[22].PiCoVacc是一种纯化灭活的SARS-CoV-2病毒候选疫苗,将SARS-CoV-2(HB02菌株)接种于非洲绿猴肾细胞(Vero cell)中,然后培养、收获、灭活、澄清、浓缩、纯化和添加佐剂.该疫苗可在小鼠、大鼠和非人类灵长类动物中诱导SARSCoV-2特异性中和抗体,以抵抗SARS-CoV-2病毒攻击,而未观察到抗体依赖性增强或免疫病理的恶化,研究结果支持针对人类新冠疫苗的临床开发[4].2020年4月16日,中国北京科兴中维公司(Sinovac,简称北京科兴中维)开展了一项随机、双盲和安慰剂对照的Ⅰ/Ⅱ期临床试验,新冠疫苗和安慰剂均由Sinovac制造,在中国江苏招募744名受试者,其中Ⅰ期144名,Ⅱ期600名,评估PiCoVacc疫苗在18至59岁健康成年人中的安全性和免疫原性,于2020年7月10日完成Ⅰ/Ⅱ期临床试验,研究结果表明:与安慰剂相比,无3级不良反应报告,该疫苗的安全性极佳[23].但是对于主要的免疫原性结果,Ⅰ/Ⅱ期研究的中期报告缺乏抗体持续性应答的数据,无法评估新冠疫苗接种后的保护时间.为解决这些存在的重要问题,Sinova公司与巴西布坦坦研究所(Butantan Institute)签署了合作协议,在依法合规的基础上,共同实施Ⅲ期临床试验,这项研究是一项针对18岁以上的成年人(医疗保健机构工作的专业人员)进行的Ⅲ期临床试验,以评估PiCoVacc疫苗对医疗保健专业人员的功效和安全性,预计在巴西招募8 870名受试者,于2020年7月21日接种工作有序进行,目前观察疫苗的安全性良好,没有发生严重不良反应,预计试验于2021年10月结束[24].
BBIBP-CorV是一种β丙内酯灭活的SARSCoV-2病毒候选疫苗,该疫苗可在小鼠、大鼠、豚鼠、兔子和非人类灵长类动物(食蟹猴和恒河猴)中诱导高水平的中和抗体,以提供针对SARSCoV-2的保护,未检测到抗体依赖性的感染增强作用,研究结果支持在临床试验中进一步评估[12].2020年4月28日,北京生物制品研究所开展了Ⅰ/Ⅱ期临床试验,预计在河南商丘招募2 128名受试者,其中Ⅰ期为480名,Ⅱ期为1 648名[25].对不同年龄人群接种不同剂量BBIBPCorV疫苗后,观察和评价该疫苗在相应年龄健康人群中的安全性和免疫原性,预计试验完成时间为2021年11月28日.2020年9月16日,中国生物技术股份有限公司与阿根廷签署了合作协议,在依法合规的基础上,共同实施Ⅲ期临床试验,预计在阿根廷招募3 000名受试者,评估18至85岁的阿根廷健康人群中BBIBP-CorV疫苗的功效、免疫原性和安全性,预计临床试验在2021年12月1日结束[26].
2020年4月11日,武汉生物制品研究所和国药集团共同开展了SARS-CoV-2灭活疫苗(Vero cell)Ⅰ/Ⅱ期临床试验,预计在中国河南招募1 456名受试者,其中Ⅰ期288名,Ⅱ期1 168名,对不同年龄人群接种不同剂量疫苗后,观察和评价疫苗在相应年龄健康人群中的安全性和免疫原性,预计试验完成时间为2021年11月21日[27].目前Ⅰ/Ⅱ期临床试验结果表明,疫苗能在人群中有效地诱导产生中和抗体,中和抗体水平也与其他新冠疫苗研究报道的数据水平相当,证实了该疫苗具有良好的免疫原性[13].2020年7月16日,中国生物技术股份有限公司与阿联酋阿布扎比签署了合作协议,在依法合规的基础上,共同实施Ⅲ期临床试验,预计在阿联酋阿布扎比招募1.5万名受试者(1万名接种实验性疫苗,5 000名注射安慰剂),评估大于18岁的阿联酋阿布扎比健康人群中SARS-CoV-2灭活疫苗的功效、免疫原性和安全性,预计临床试验在2021年7月15日结束[28].
2.1.2 腺病毒载体疫苗
腺病毒载体疫苗是以腺病毒作为载体,用基因工程技术将外源保护性抗原基因插入到病毒基因组内并转染细胞获得重组病毒,获得的重组病毒能在机体内表达目的蛋白,并诱导产生相应抗体,从而达到免疫接种的目的[29].2020年3月16日,军事科学院军事医学研究院(生物工程研究所)中国工程院院士陈薇团队牵头研发的腺病毒载体疫苗Ad5-nCoV进入Ⅰ期临床试验,预计在中国武汉招募108名受试者(18至60岁的健康成年人),按剂量递增接种Ad5-nCoV疫苗,预计临床试验完成时间为2020年12月31日[30].2020年4月12日,陈薇院士团队和康希诺生物股份公司合作开展了Ⅱ期临床试验,旨在评估18岁以上健康成年人接种Ad5-nCoV疫苗后的安全性和免疫原性.500位志愿者分为3组,在湖北省武汉市分别接受低剂量、中剂量的Ad5-nCoV疫苗接种和安慰剂注射,然后进行免疫后不良反应监测、SARS-CoV-2病毒的S蛋白特异性抗体滴度和特异性中和抗体滴度监测[18],预计完成时间为2021年1月31日[31].Ⅱ期临床试验初步报告,在健康成年人中,T细胞反应在Ad5-nCoV疫苗接种后第14天达到峰值,抗体在第28天达到峰值[32].2020年9月15日,陈薇院士团队与巴基斯坦签署了合作协议,共同实施Ⅲ期临床试验,预计在巴基斯坦招募4万名受试者(实验组2万名,安慰剂组2万名)[28],旨在评估Ad5-nCoV疫苗在18岁以上成人中的疗效、安全性和免疫原性,预计临床试验在2022年1月30日结束[33].
2.2 新冠疫苗Ⅲ期国外临床试验现状
2.2.1 mRNA核酸疫苗
全球首个新冠核酸疫苗mRNA-1273由美国国立卫生研究院(NIH)与美国生物科技公司莫德纳(Moderna)合作研发完成.mRNA疫苗是指将编码某种抗原蛋白的外源基因(DNA或RNA)直接转移到动物体内,通过宿主表达系统合成抗原蛋白,诱导宿主对该抗原蛋白产生免疫应答,以达到预防和治疗疾病的目的,包括DNA疫苗和RNA疫苗[34].mRNA-1273是一种基于新型的脂质纳米颗粒(lipid nanoparticle,LNP)封装的mRNA的新冠疫苗,可编码SARS-CoV-2的全长,融合前稳定的刺突蛋白(S)[34].刺突蛋白是病毒感染宿主细胞的关键所在,也是研发SARS冠状病毒疫苗和MERS冠状病毒疫苗时的靶点.Moderna公司的mRNA疫苗研发,跳过了动物实验阶段,直接在原MERS疫苗的研究基础上进行研发.2020年3月16日,NIH开展了针对男性和未怀孕女性的Ⅰ期临床试验,预计在美国佐治亚州、马里兰和华盛顿招募120名受试者,预计临床试验完成时间为2021年11月22日[35].2020年5月29日,Moderna公司开展了Ⅱ期临床试验,预计在美国佐治亚州、堪萨斯州、密苏里州、内布拉斯加州、北卡罗来纳州、南达科他州、德克萨斯州和犹他州招募600名受试者,评估18岁及以上成年人中mRNA-1273疫苗的安全性、反应原性和免疫原性,预计临床试验完成时间为2021年8月[36].Ⅱ期临床试验结果表明:mRNA-1273疫苗可在所有参与者中诱导抗SARS-CoV-2免疫反应,未发现限制试验的安全性问题,研究结果支持该疫苗的进一步开发[34].2020年7月27日,实施Ⅲ期临床试验,预计在美国招募3万名受试者,旨在评估第二次mRNA-1273给药后长达2年预防COVID-19的功效、安全性和免疫原性,预计2022年10月27日结束[37].
BNT162b1是脂质纳米颗粒配制的,核苷修饰的mRNA疫苗,编码SARS-CoV-2的三聚受体结合域(RBD)[20].2020年9月9日,德国生物技术公司(BioNTech)和美国辉瑞公司(Pfizer)开展了Ⅰ/Ⅱ期临床试验,在德国招募120名受试者,预计临床试验完成日期2021年12月[38].Ⅰ/Ⅱ期临床试验结果初步表明,在45位健康的18~55岁成年人中接种BNT162b1疫苗后血清中和抗体滴度为COVID-19恢复期成年人血清的1.9~4.6倍,且中和抗体滴度随疫苗剂量的增加而增加,这些结果支持BNT162b1疫苗的进一步临床评估[20].2020年4月29日,实施了Ⅲ期临床试验,预计在美国、土耳其、巴西和阿根廷招募4.399 8万名受试者,旨在针对健康人群接种疫苗后的安全性、免疫原性和功效进行研究,预计2022年11月14日完成临床试验[4].
2.2.2 腺病毒载体疫苗
牛津大学(University of Oxford)和阿斯利康公司(AstraZeneca)研发的腺病毒载体疫苗ChAdOxnCoV-19,是一种基于非复制、无稳定突变和存在多碱性裂解位点的黑猩猩腺病毒表达的野生型刺突蛋白.于2020年6月24日开展Ⅰ/Ⅱ期临床试验,总共在美国招募2 000名受试者,预计完成后续追踪日期到2021年12月30日.Ⅰ/Ⅱ期临床试验的初步报告,单剂量可引发针对SARS-CoV-2的体液和细胞免疫应答,加强免疫可增强中和抗体的效价,未发现与ChAdOxnCoV-19相关的不良事件[39].2020年8月17日,AstraZeneca开展了Ⅲ期临床试验,在美国招募3万名受试者,旨在确定AZD1222(一种非复制型ChAdOx1载体疫苗)的安全性、功效和免疫原性,预计临床试验于2022年10月5日完成[16].
2020年6月17日,俄罗斯联邦卫生部Gamaleya流行病学和微生物研究所开展了“一项针对Gam-COVID-Vac疫苗的安全性、耐受性和免疫原性的研究(Ⅰ/Ⅱ期临床试验)”,在俄罗斯招募76名受试者,于2020年8月10日完成临床试验[40].研究结果表明:Gam-COVID-Vac疫苗在参与者中引起强烈的体液和细胞免疫应答,具有良好的安全性,但需要进一步研究对预防COVID-19的有效性[17].于2020年9月7日开展了Ⅲ期临床试验,将在俄罗斯招募4万名18岁以上的志愿者,将他们随机分为两组(3∶1),接受Gam-COVID-Vac疫苗的试验组志愿者3万名,接受安慰剂的志愿者1万名,旨在评估新冠疫苗对预防COVID-19的功效、安全性和免疫原性,预计临床试验完成日期为2021年5月1日[41].
2020年7月15日,强生公司(Johnson&Johnson)开展了“一项随机、双盲和安慰剂对照的I/IIa期临床试验,评估腺病毒载体疫苗Ad26COVS1在18至55岁和65岁以上的成年人中的安全性和免疫原性”,预计在美国和比利时招募1 045名参加者,预计完成日期2023年11月20日[42].2020年9月7日开展了Ⅲ期研究,在美国、阿根廷、巴西、智利、哥伦比亚、墨西哥、秘鲁、菲律宾和南非招募6万名参与者,旨在评估Ad26.COV2.S在18岁以上成年人中预防COVID-19的疗效和安全性,预计临床试验完成日期2023年3月10日[43].
3 新冠疫苗预期问题和面临的挑战
3.1 抗体依赖性增强
疫苗的一些毒副作用可能会在Ⅲ期临床试验期间才会出现,常见的一种毒副作用就是抗体依赖性增强(antibody dependent enhancement,ADE).ADE指某些病毒在体内预先存在的非中和性或中和性差的抗体协助下,其复制或感染能力显著增强[44].在体内条件下,中和抗体定义为无需任何其他支持即可防止病毒进入或融合的抗体.中和抗体可以阻断病毒的受体-配体相互作用,从而使病毒从宿主中清除[45].当这些保护性抗体加速疾病的病理状态时,这种现象就称为ADE.抗体的亲和力、浓度、特异性和同种型等几个因素均与ADE有关[46].增加中和抗体的亲和力或浓度可以减轻ADE,而增加非中和抗体的浓度则可以导致ADE;中和抗体的浓度较低或亲和力较低,也会发生ADE[47].目前对SARS-CoV-2病毒尚无明确的认知,因而尚不清楚ADE在SARS-CoV-2中的作用,但其他冠状病毒疫苗ADE已有相关报道.1980年,在猫传染性腹膜炎病毒(feline infections peritonitis virus,FIPV)中报道了ADE,FIPV是一种在野猫和家猫中高度流行的alpha冠状病毒[48];在寨卡病毒感染中,预先存在的登革病毒抗体具有致病性[49];对MERS-CoV感染的兔子进行被动免疫导致炎症反应增强[50-51];呼吸道合胞病毒(RSV)疫苗临床试验期间出现ADE[52].因此,在研发SARS-CoV-2疫苗期间,必须对疫苗的ADE进行适当考虑,从而开发出更安全和有效的疫苗.
3.2 上市后的安全性监测
与疫苗相关的一些严重不良反应事件很少发生或在疫苗上市后才发生.例如1976年研究者发现,每10万名公众接种流感疫苗,就大约存在1例吉兰-巴雷综合征(GBS)[53].为快速检测、报告和解决此类不良反应事件,建立全面的安全监控系统将变得至关重要[54].人类发现SARS-CoV-2病毒至研发新冠疫苗的时间仅仅9个月,接种疫苗后,受试者血清中抗体维持在较高水平,这提示了疫苗可能会有比较长期的保护作用,但每款疫苗接种后的保护时间有多长,还需要做长期、大量的研究工作.目前Ⅲ期临床试验证明安全和有效的新冠疫苗很可能在2021年进入市场.在尚不能证明新冠疫苗有效保护期的情况下,如何进行疫苗上市后监测将成为该阶段的一个难题,针对此难题可以借鉴2009年流感大流行时期,H1N1流感疫苗上市后时所实施的监测模式:(1)通过联邦和私营部门数据库的结合,建立了更广泛用于监控疫苗安全性的系统,主动监测数百万剂疫苗的安全性;(2)政府和非政府专家组成评估小组,每两周至少审查一次数据,以确保使用的疫苗的安全性;(3)整合资源(电子数据系统),便于疾病预防控制中心(CDC)和合作伙伴交流和分析有关疫苗的安全性[55].
4 展望
全球COVID-19疫情仍在继续,快速开发新冠疫苗已成为当务之急.截至2020年9月29日,全球已经有9种新冠疫苗进入Ⅲ期临床试验,4种腺病毒载体疫苗(美国1,英国1,中国1,俄罗斯1)、3种灭活疫苗(中国)和2种核酸疫苗(美国和德国).据中国和美国临床试验数据库资料显示,2020年4月29日,mRNA 核酸疫苗BNT162b1率先于美国、土耳其、巴西和阿根廷开始Ⅲ期临床试验.预计在2021年5月1日腺病毒载体疫苗Gam-COVID-Vac率先在俄罗斯完成Ⅲ期临床试验.目前,我国新冠疫苗研发工作总体上处于领先地位,已有4种新冠疫苗进入Ⅲ期临床研究阶段,分别在阿根廷(BBIBP-CorV)、巴西(Vero cell)、阿联酋(PiCoVacc)和巴基斯坦(Ad5-nCoV)开展Ⅲ期临床试验,并均已开始入组工作,接种工作有序进行,已接种了约6万名受试者安全性良好,当前尚无严重不良反应的报告[56].目前,全球新冠疫苗研发呈现谨慎积极的态势,未来存在许多不确定性因素,仍需高度关注在疫苗研发过程中可能发生的一些毒副作用,从而开发出更安全和有效的疫苗.尽管存在各种困难与挑战,但研发人员正在以前所未有的速度开发对抗COVID-19的疫苗,Ⅲ期临床试验证明安全和有效的疫苗很可能在2021年进入市场.但即使疫苗上市后,还应以实现安全有效的疫苗为目标,针对疫苗安全性建立全面的监测系统,从而快速安全地打赢抗击COVID-19大流行的战役.展望未来,期望能开发出可普遍应用于其他冠状病毒的通用疫苗,从而应对未来可能出现的冠状病毒引起的新发传染病[57].
