髓源性抑制细胞在胃癌发生发展中的作用与应用
2020-11-26屠妍霞
屠妍霞 陈 光
(台州学院医学院,浙江台州,318000)
胃癌是全球发病率第五的恶性肿瘤,为第三大常见死因。研究表明,地域差异对胃癌发病率有较大影响,发展中国家约占70%,东亚约占50%,中国的发病率尤其高,且性别差异导致男性发病率约为女性的2倍[1]。胃癌的分子分型,目前按照“癌症基因组图谱(TCGA)”项目(2014)将胃癌分为四种基因组亚型:染色体不稳定型(CIN);微卫星不稳定型(MSI);基因组稳定型(GS);Epstein Barr病毒相关型(EBVaGC)。继手术、化疗、放疗和分子靶向治疗后,疗效显著持久且副作用较小的免疫治疗成为胃癌最有前景的治疗策略之一。
肿瘤微环境由癌细胞和基质/免疫细胞组成,如癌相关成纤维细胞(CAFs)、内皮细胞、M2型肿瘤相关巨噬细胞(M2-TAMs)、髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)和调节性T 细胞(Regulatory cells,Treg),是妨碍常规治疗的因素之一[2]。由此对MDSCs在胃癌发生发展中的相关作用研究作一综述。
1 MDSCs
髓源性抑制细胞(MDSCs)是由未成熟的、无法分化为粒细胞、巨噬细胞和树突状细胞的髓系祖细胞组成的异质性群体,是一种免疫抑制性先天细胞群[3]。MDSCs通过多种机制抑制肿瘤微环境中的先天免疫和适应性免疫,包括高表达的精氨酸酶1(Arg1)、诱导型一氧化氮合酶(iNOS)和NADPH氧化酶2产生的活性氧和氮物种,血管内皮生长因子(VEGF)的表达以及半胱氨酸的消耗等[3]。
MDSCs激活Treg和M2-TAM并促进其增殖,通过抑制效应性T细胞的增值和功能因子的释放等机制削弱T细胞的抗肿瘤效应和NK细胞的活性[3],介导肿瘤微环境中免疫逃避。
2 MDSCs阻断胃癌肿瘤免疫的机制
2.1 成纤维细胞生长因子受体(FGFR)家族:与胃癌相关的基因FGFR2、CSF1R、EVGFR2等参与组成FGFR家族。FGFR2在胃癌中相对频繁地被放大和过度表达,编码RTK的基因如EGFR、ERBB2、FGFR2和MET的扩增发生在胃癌中。且FGFR2扩增型胃癌与淋巴结浸润和预后不良密切相关[2],但FGFR2扩增促进淋巴结转移的分子机制尚不清楚。癌细胞通过分泌集落刺激因子CSF1来激活M2-TAMs和MDSCA,这两种免疫系统表面都表达有CSF1R(Ⅲ型跨膜酪氨酸激酶)。CSF1信号通过作用于CSF1R诱导其增值分化[2]。
2.2 Arg2相关机制:MDSCs通过抑制T细胞免疫在癌症和病毒感染中发挥负性调节,而部分MDSCs对T细胞的抑制活性是由内源性Arg2介导的[4]。MDSCs中的Arg2通过消耗炎症微环境中T细胞的L-精氨酸有效性来抑制T细胞免疫。
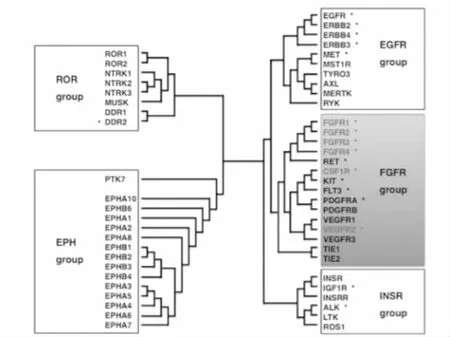
图1 受体酪氨酸激酶(RTK)超家族。显示了54个人类rtk的系统发育树。[2]

图2 Arg2的作用机制[4]
然而,在活体病理情况下的一项研究表明,Arg2缺乏加重了慢性胃炎期间的胃免疫病理变化,这说明Arg2抑制剂对胃肠道癌的有效性存在争议。作者认为,这种作用不是由NOS介导的。尽管作者没有研究MDSCs功能降低对CD8+T细胞反应的影响,但他们报道了组织中主要由CD8+T细胞和NK细胞活化后诱导产生的IFN-γ分泌水平显著增加[5]。因此,如果Arg2-/-介导了MDSCs功能降低和CD8+T细胞反应增强(如文献报道)的过程,那么Arg2敲除的胃癌患者加重的免疫病理损伤则与CD8+T细胞参与的自身免疫性病因密切相关[4]。
2.3 肿瘤相关肥大细胞(TAMCs):肥大细胞通过多种肿瘤细胞衍生的趋化因子进入肿瘤微环境[6],例如SCF、VEDFs、ANGPT1 等。在肿瘤微环境中,TAMCs受到多种因素的影响和激活,同时,TAMC通过其免疫抑制特性动员促进肿瘤生长MDSCs,且肥大细胞可在体外和体内增强MDSCs的功能。胃癌中的肥大细胞为糜酶阳性,提示肥大细胞数量多的患者预后差。幽门螺杆菌性胃炎中肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞均有增长。慢性胃炎患者的肥大细胞密度增加。在胃癌低危区嗜酸性粒细胞密度升高,而在高危区嗜酸性粒细胞浓度降低,作者推测嗜酸性粒细胞可能促进或限制慢性炎症和肿瘤的发生,这取决于周围的免疫环境[7]。
胃肿瘤微环境中肥大细胞和巨噬细胞的存在与微血管密度也有关。在胃癌患者中检测肥大细胞在肿瘤内、边缘、瘤周和非肿瘤组织的微观定位,发现这些患者肿瘤内组织中的肥大细胞浸润率高于边缘组织、瘤周组织和非肿瘤组织[8]。
此外,随着肿瘤从I期进展到IV期,肿瘤内肥大细胞增多,提示这些细胞可能具有促癌作用。据报道,肥大细胞通过肿瘤细胞产生的CXCL12与趋化因子受体CXCR4结合而在胃癌中积聚[9]。
2.4 Hedgehog(Hh)通路
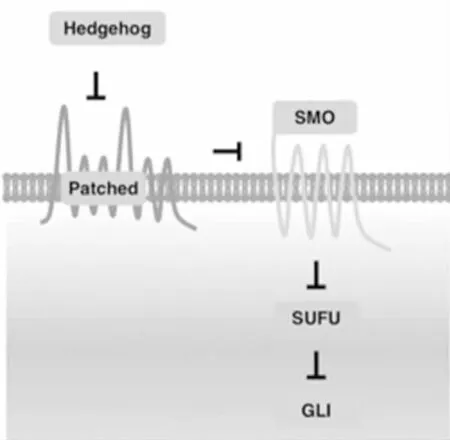
图3 Hedgehog/Gli部分信号级联通路[10]
通常情况下,Ptc抑制SMO蛋白活性,从而抑制下游通路。当Hh与Ptc结合后,Ptc解除对SMO的抑制,促使Gli蛋白、PKA和一些未知因子与微管形成大分子复合物,使得全长Gli蛋白进入核内激活下游靶基因转录。Hedgehog信号通路在人类癌症细胞的遗传改变和TME旁分泌信号刺激时被激活。胃癌发生时,Hedgehog/Gli信号成分发生遗传改变,促进了肿瘤干细胞的侵袭、增殖、生存和自我更新[10]。而TME中旁分泌的Hedgehog信号则通过促进血管生成、纤维化、免疫逃避和神经病理性疼痛发挥作用[10]。研究表明:幽门螺杆菌感染者胃内Sonichedgehog(SHH)的上调可诱导巨噬细胞的募集和上皮细胞的增殖,从而在胃癌发生早期介导慢性胃炎和黏膜萎缩;随后在胃癌患者中,Hedgehog信号激活上皮细胞-间充质细胞转化(EMT)导致调节因子上调并产生间充质表型、化疗耐受和预后不良等后果[11]。
2.5 Breg通过“辅佐”MDSCs促进肿瘤生长和转移:在人细胞系中,从健康供体外周血单个核细胞(PBMCs)中分离纯化的髓样细胞,经MDA-MB-231乳腺癌细胞的CM处理后,在体外能抑制T细胞增殖。然而,供体PBMCs中的髓样细胞在缺乏T、NK和B细胞时,用癌源性CM处理并不能抑制T细胞增殖。结果表明,Bregs通过“辅佐”可以增强MDSCs的免疫抑制功能而促进肿瘤生长。B细胞介导的MDSCs功能增强机制尚不清楚。研究结果证实,Breg除了对T和NK细胞的“辅佐”作用外,还能调节髓样抑制细胞活性,从而在形成整体免疫微环境的过程中发挥作用[12]。
2.6 Wnt经典通路:经典Wnt信号通路的结构性激活是胃肠道肿瘤发生的重要条件。胃癌发生过程中,研究人员发现,Wnt相关蛋白如Wnt-1,-2,和-5a的上调和Wnt抑制剂如Dickkopf相关蛋白1(DKK-1)和Axin的缺失。并且胃癌患者血清中DKK-1水平似乎与TNM分期和预后不良密切相关。但在胃癌的发生发展中是否存在MDSCs数量的累积和Wnts基因的高表达还有待进一步研究。
2.7 PD-L1和PD-L2:程序性死亡配体1(programmed death ligand-1,PD-L1)和程序性死亡配体2(programmed death ligand-2,PD-L2)表达于 MDSCs上的B7家族抑制性配体,通过抑制CD4+和CD8+T细胞的活化和增值,削弱机体免疫应答,介导肿瘤免疫逃逸、促进肿瘤生长[13]。PD-1由细胞毒性T淋巴细胞 (cytotoxic Tlymphocyte,CTLs) 表达,当PD-L1或PD-L2刺激时,会导致CTL凋亡。PDL1和(或)PD-L2在胃癌中表达最高可达50.8%。PD-L1与EB病毒感染、淋巴浸润阳性、肿瘤浸润深度T3/4、淋巴结转移等密切相关[13]。Derks等发现在EBV阳性胃癌以及与微卫星不稳定性相关的胃癌中,由肿瘤或肿瘤浸润性淋巴细胞(Tumor infiltrating lymphocytes,TILs)引起的 PD-L1阳性表达的现象非常常见[13]。
2.8 吲哚胺-2,3-双加氧酶1
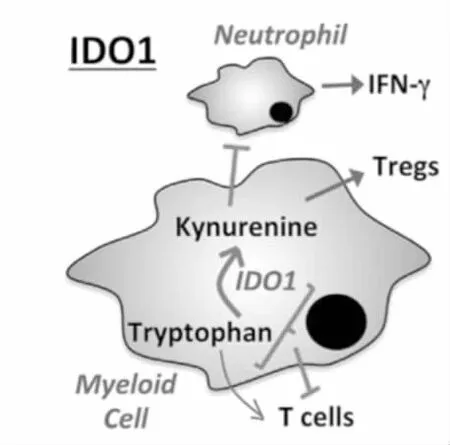
图4 IDO1的作用机制[4]
吲哚胺-2,3-双加氧酶 1(Indoleamine 2,3-dioxygenase 1,IDO1)是一种抑制T细胞免疫的色氨酸分解酶,被证实在胃肠道中起主要的替代作用(T细胞调节除外)。IDO1在调节T细胞免疫中的作用在预防异基因胎儿排斥反应中被首次描述。现已证实IDO1通过将色氨酸分解为酪氨酸来耗尽T细胞的色氨酸库,IDO1由MDSCs表达并调控这些细胞对T细胞的免疫抑制功能[6]。IDO1在肿瘤情况下,可能发挥调节骨髓细胞(如中性粒细胞或MDSCs)的替代功能。为了支持后一种观点,最近的一篇论文表明,在IDO1过度表达B16黑色素瘤模型中,MDSCs增加[14]。
3 靶向MDSCs的抗胃癌治疗
3.1 TKI(FGFR或CSF1R抑制剂):利用小分子FGFR2抑制剂和患者来源的肿瘤异种移植进行的临床前研究表明,FGFR2是一个有前途的治疗靶点[15]。FGFR和CSF1R/VEGFR2的双重抑制有望通过靶向免疫逃避和肿瘤微环境中的血管生成增加抗肿瘤作用。FGFR/CSF1R联合靶向癌细胞和基质/免疫细胞的抑制剂及抗PD-1/CTLA-4单克隆抗体靶向调节性T细胞和去抑制CD8+T细胞可能是一种很有前途的方法。
CSF1R抑制剂(GW2580和 PLX3397)和抗CSF1R单抗(RG7155)已被开发成治疗单核细胞样MDSCs和M2-TAM的CSF1信号传导阻滞的药物。CSF1和FGF信号都参与肿瘤浸润/促进MDSCs和M2-TAMs的积累,CSF1R和FGFRs的双重抑制可能比选择性CSF1R抑制更有效。
3.2 Arg2相关抑制剂:代谢酶Arg2是调节T细胞免疫的一个有吸引力的治疗靶点。通过胃的免疫病理学分析表明,在胃癌患者中使用Arg2抑制剂治疗癌症有争议。相关文献报道,Arg2抑制剂处理肿瘤后,癌组织相邻的正常组织出现红肿,可能与Arg2被抑制后引起的免疫病理相关。因此,必须考虑到Arg2抑制的不良病理结果,这可能是由于肿瘤周围正常组织的炎症加剧,从而加快了癌前病变[4]。
3.3 Hedgehog通路抑制剂:胃癌被预测为SMO抑制剂单一治疗的靶点目前仅基于临床前研究阶段,该研究提示SMO抑制剂对SHH依赖性小鼠肿瘤具有抗肿瘤作用。联合化疗或酪氨酸激酶抑制剂是提高SMO抑制剂在癌症患者中疗效的合理策略。Hedgehog拮抗剂已用于其他类型的癌症,但其在胃癌临床试验中的应用仍处于初级阶段。这些试验从一开始就更侧重于靶向CD44阳性的胃干细胞治疗转移性疾病。
3.4 Wnt或Csf1R信号阻断剂:Wnt或Csf1R信号通路的阻断和联合用药治疗策略为对抗肿瘤微环境中的免疫抑制提供了希望。由于DKK-1通过刺激MDSCs促进免疫抑制肿瘤环境,Gomceli[16]等提出血清DKK-1水平作为一种新的血清学标志物。目前,有2种DKK-1中和抗体(BHQ880和DvvKN-01)对多发性骨髓瘤或NSCLC等晚期肿瘤具有良好的耐受性和临床疗效。一项进展中的Ⅲ期临床试验中,晚期胃癌患者正在接受用紫杉醇与帕博利珠单抗 KEYNOTE-061(NCT02370498)的联合治疗[17]。
3.5 多受体酪氨酸激酶抑制剂:Lenvatinib是一种多受体酪氨酸激酶抑制剂,在肿瘤微环境中通过降低TAM数量与增强CD8+T细胞的功能发挥抗肿瘤活性,且当与PD-1抗体联合使用时抗肿瘤活性效果显著增强[18]。
3.6 PD-1/PD-L1检查点抑制剂:派姆单抗已被美国FDA批准用于 PD-L1阳性即联合阳性分数(combined positive score,CPS)≥≥S分的复发性局部晚期或转移性胃或胃食管结合部腺癌的三线治疗。纳武单抗在韩国等国家被批准可以应用于晚期胃或胃食管连接部肿瘤的三线治疗。抗PD-L1抗体avelumab、durvalumab等单药或联合其他药物治疗胃癌的临床试验已经注册成功并在进行中[19]。
3.7 IDO1抑制剂:研究发现,IDO1抑制剂增加了盲肠胃肠道间质瘤转基因小鼠模型中CD8+T细胞的数量,并降低了肿瘤的生长,CD8+T细胞的减少逆转了肿瘤的生长[4]。有研究表明,IDO1抑制艰难梭菌结肠炎中产生IFN-γ的中性粒细胞,但对盲肠CD4+T细胞数没有明显影响。需要注意的是,艰难梭菌结肠炎是一种急性中性粒细胞性疾病,其中T细胞不会显著影响免疫病理学或生存率。且IDO1调控的盲肠中性粒细胞是IFN-γ的主要来源(>90%)[4]。这些发现揭示了IDO1在急性胃肠道感染中的新作用,它警告IDO1抑制剂的不良副作用。这是特别值得关注的,因为癌症患者更容易死于艰难梭菌感染。
4 小结与展望
随着免疫疗法在晚期胃癌临床前和临床实验中取得的较好成果,进展迅速的免疫检查点抑制剂和联合免疫治疗有望在数年内成为晚期胃癌的主流治疗方法之一。有实验表明HER2阳性表达的胃癌患者对辅助化疗疗效有影响(差于阴性)。在乳腺癌的治疗中,抗CD3和抗HER2/nue特异性抗体活化T细胞(anti-Activated T cells,aATC)能够消除MDSCs。目前最新研究,在胃癌的临床前模拟中,使用对HER2癌蛋白特异的CAR-T细胞进行治疗以及使用双功能 α-HER2(Ag1)/CD3(Ag2)RNA 工程化的CAR-T样人T细胞,诱导显著的肿瘤消退并延长荷瘤小鼠的存活[25]。故笔者考虑,HER2阳性表达的胃癌患者是否可以尝试运用于以MDSCs为靶点的免疫疗法。
