短期异常酸、碱胁迫对中华绒螯蟹生理和生长的影响
2020-11-26张俊彪崔广同蔡春芳任胜杰王承睿李文健葛逸扬丁惠明
张俊彪,崔广同,蔡春芳,任胜杰,倪 沁,王承睿,李文健,葛逸扬,丁惠明,张 铖
(1.苏州大学基础医学与生物科学学院,江苏省水产动物与营养重点实验室,江苏苏州 215123;2.苏州市阳澄湖国家现代农业示范区发展有限公司,江苏苏州 215123)
中华绒螯蟹(Eriocheirsinensis,简称河蟹)是我国重要的淡水养殖品种,脱壳是其实现个体增长的必由途径,也是影响其存活率的重要环节。养殖过程中为促进河蟹顺利脱壳,蟹塘通常栽种大量水草供其藏身栖息。然而,在相对较小且封闭的池塘环境中,水草的光合作用和呼吸作用及微生物发酵常常导致水体pH剧烈变化。在养殖生产中发现,晴天时大多蟹塘pH高于9.4,pH最高的可达10.3以上,也有少量蟹塘因水草衰败腐烂等原因使水体pH降至3.0以下。大量研究表明异常酸、碱环境会造成水生动物鳃组织损伤[1],改变其能量代谢方式[2],并可能影响其正常脱壳[3]和生长[4,5]。河蟹在酸、碱胁迫时也呈现相似的生理响应[2,6],但尚无关于极端异常酸、碱胁迫对河蟹生理和生长影响的研究报道。
本实验通过观察短期极端酸、碱胁迫对河蟹血清生化、抗氧化力、组织损伤、后续脱壳增长率和存活率的影响,旨在揭示短期酸、碱胁迫的危害,继而为优化养殖管理技术提供依据。
1 材料与方法
1.1 实验设计
本研究包含两个实验。实验一重点研究短期酸、碱胁迫对河蟹成蟹生理的影响,实验二重点探究短期酸、碱胁迫对河蟹幼蟹脱壳增长率和存活率的影响。
1.2 短期酸、碱胁迫对河蟹成蟹生理的影响
1.2.1 饲养管理及样品制备
实验在苏州市阳澄湖国家现代农业示范区发展有限公司研究生工作站进行。实验蟹购自本地蟹苗养殖场,在室内水泥池中暂养15 d,期间投喂河蟹商品饲料。每天7∶30和18∶30各饱食投饲一次。暂养结束后禁食24 h,选取225只规格整齐、附肢齐全的河蟹,随机分入9个体积为400 L的圆形塑料缸内饲养,缸内盛有pH分别为3.0(酸胁迫组)、7.5(对照组)和10.3(碱胁迫组)的水250 L,每缸放养25只,三个平行。实验开始时蟹的体均重为(50.4±2.5) g。以PVC网片作为河蟹的攀爬物和隐蔽物。实验期间每3 d吸污1次并换水1/3。养殖用水为经沉淀至少48 h的阳澄湖水。于投饲后0.5 h监测、并调整pH两次。每天收集死蟹并称重、记录。实验期间水温20~24 ℃,24 h持续增氧,水体溶氧不低于6.7 mg/L。
1.2.2 血清生化分析
分别于胁迫前(0 h)和胁迫后6 h、12 h、1 d、3 d和5 d,及恢复2 d、6 d和15 d时采样。采样时,随机从每缸取3只河蟹,用1 mL一次性注射器从第4步足基关节处抽取血淋巴并转入1.5 mL EP管中,4 ℃条件下3 000 r/min离心10 min收集血清。血清乳酸脱氢酶活性(LDH,U/L)及血糖浓度(GLU,mmol/L)、总蛋白浓度(TP,g/L)和尿素浓度(Urea,mmol/L)采用宁波美康生物科技股份有限公司生产的试剂盒检测。血清总超氧化物歧化酶活性(T-SOD,U/mg prot)和总抗氧化力(T-AOC,U/mg prot)采用南京建城生物工程有限公司生产的试剂盒测定。血清生化指标均采用全自动生化分析仪(C8000,Abbott Laboratories,USA)测定。
1.2.3 鳃组织碳酸酐酶(CA)和Na+-K+-ATPase(NAK)活力测定
胁迫5 d时每缸随机取3只河蟹,在冰盘上麻醉后解剖取鳃组织,用4 ℃预冷的PBS冲洗并液氮速冻保存。测定前于冰浴中充分匀浆后,5 000 r/min离心15 min,取上清,用上海优选生物科技有限公司生产的试剂盒测定。
1.2.4 肝胰腺和肌肉糖原含量测定
胁迫5 d和恢复15 d时从每缸分别随机取3只河蟹,冰浴麻醉后解剖取肝胰腺和肌肉组织,用4 ℃预冷的PBS冲洗并液氮速冻,用30% NaOH沸水浴20 min充分水解,采用南京建城生物工程有限公司生产的试剂盒测定其糖原含量。
1.2.5 组织切片
胁迫5 d时从每缸随机取3只河蟹,冰浴麻醉后解剖取肝胰腺和鳃组织,用4 ℃预冷的PBS冲洗后放入4%甲醛溶液固定24 h后,按常规石蜡组织切片制作程序进行脱水、透明、浸蜡、包埋、切片,切片厚度5 μm,经HE染色后分片。用显微成像系统(AXoskop显微镜,Carl Zeiss,Oberkochen,Germany;彩色摄像机,VCKY-F30,Tokyo,Japan)观察并采集组织切片照片。
1.3 短期酸、碱胁迫对河蟹幼蟹生长和脱壳的影响
实验蟹[初重为(0.87±0.21)g]来源、驯化及饲养管理方式同前。选取450只规格整齐、附肢齐全的河蟹随机分养于9个体积为400 L的圆形塑料缸内(盛水约150 L),每缸放养50只。用1 mol/L HCl和NaOH分别将缸内的水于10 h内逐渐调至pH 3.0、pH 7.5和 pH 10.3,每个处理三个平行,随机分配。胁迫5 d后于10 h内将酸、碱性的水逐渐换成pH 7.5的对照用水继续饲养。每天收集死蟹及残饵并称重、记录,收集脱下的头胸甲并测定壳宽、壳长和脱壳日期。期间水温为18~23 ℃。饲养4周后,禁食24 h,称每缸蟹的总重并计数。成活率、平均增重率、脱壳增长率和脱壳周期的计算公式如下:
成活率=Nf/Ni×100%;
脱壳增长率=(La-Lb)/Lb×100%;
个体增重率=(Wf-Wi)/Wi×100%;
脱壳周期=第二次脱壳日期-第一次脱壳日期。
注:Ni为饲养开始时每缸放养的蟹只数;Nf为饲养结束时每缸存活的蟹只数;La为脱壳后头胸甲宽(mm);Lb为脱壳前头胸甲宽(mm);Wf为平均末重(g/crab);Wi为平均初重(g/crab)。
1.4 数据处理
实验数据以平均数±标准差表示。各处理间的差异采用单因子方差分析(one-way ANOVA),差异显著时再进行Duncan’s多重比较;两个处理间进行比较时采用独立样本t-检测,P<0.05为差异显著。数据分析软件为SPSS 22.0。
2 结果
2.1 酸、碱胁迫对河蟹生理的影响
由图1可知,酸、碱胁迫后6 h和12 h血清LDH活力均显著高于对照组,3 d时均显著低于对照组,酸胁迫的变化幅度更大。胁迫5 d时各组间差异不显著,但此时酸胁迫组河蟹全部死亡。恢复期碱胁迫组与对照组差异均不显著。酸胁迫后GLU剧烈升高,于12 h到达峰值,此时GLU比对照组高约14倍,胁迫5 d时GLU也显著高于对照组,其余时刻差异不显著。碱胁迫6 h和12 h时GLU也高于对照组但差异不显著,最高值为对照组的2.7倍,恢复期碱胁迫组与对照组差异不显著。酸胁迫24 h血清尿素含量显著低于对照组,其余时刻及碱胁迫组血清尿素含量和对照组无显著差异。酸胁迫6 h和24 h血清TP显著高于对照组,碱胁迫24 h血清TP也显著高于对照组,恢复6 d时观察到碱胁迫组显著高于对照组,其余时刻差异不显著。
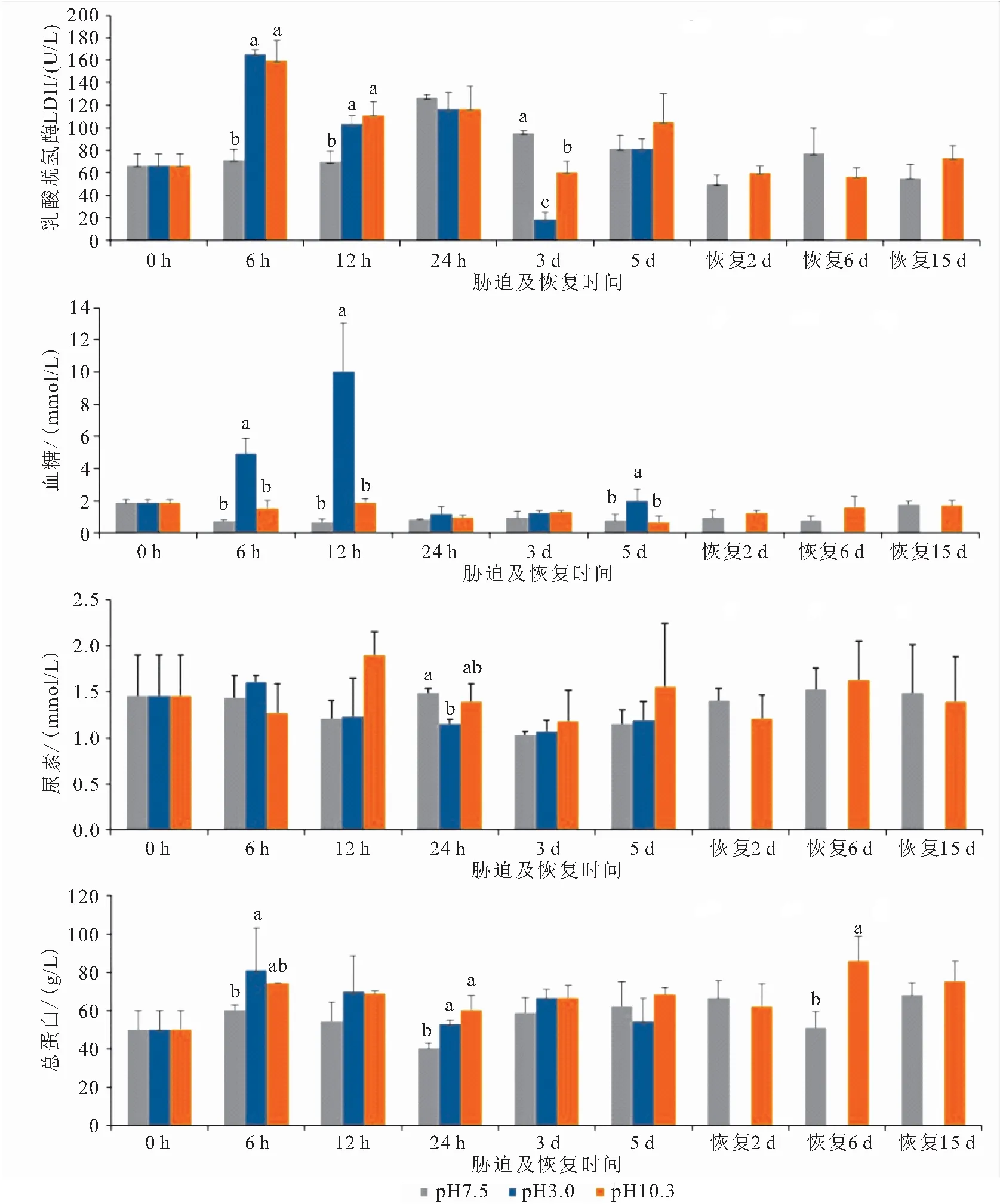
图1 酸、碱胁迫对河蟹LDH活力、GLU、Urea及TP浓度的影响Fig.1 Effects of acid and alkali exposure on serum activity of LDH,GLU,Urea and TP of E.sinensis同一时刻柱上小写字母不同表示处理间差异显著(P<0.05),n=3。图2同。
由图2可知,酸、碱胁迫12 h和24 h血清T-AOC活力显著高于对照组。碱胁迫6 h 和5 d时血清T-AOC显著高于对照组而酸胁迫组低于对照组。恢复期碱胁迫组与对照组差异不显著。酸胁迫3 d时血清T-SOD显著高于碱胁迫组,但酸、碱胁迫后T-SOD与对照组的差异均不显著。
由表1可知,与对照组相比,酸、碱胁迫5 d肝糖原显著下降,而肌糖原变化不显著。恢复15 d后碱胁迫组肝糖原含量仍显著低于对照组。酸胁迫5 d后鳃NAK酶活力显著低于碱胁迫和对照组,碱胁迫和对照组间差异不显著。各处理间CA差异不显著。
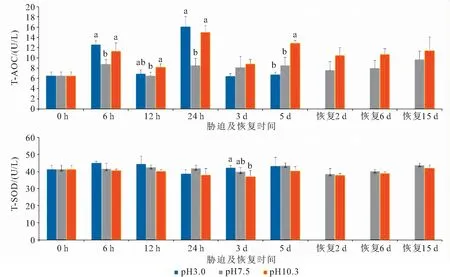
图2 酸、碱胁迫对河蟹血清T-AOC和T-SOD活力的影响Fig.2 Effects of acid and alkali exposure on serum T-AOC and T-SOD of E.sinensis

表1 酸、碱胁迫对河蟹肝胰腺和肌肉糖原含量及CA和NAK活力的影响Tab.1 Effects of acid and alkali exposure on glycogen content of hepatopancreas and muscle and enzyme activity of CA and NAK in gill of E.sinensis
由图3可知,与对照组相比,酸、碱胁迫5 d时均使肝小管基底膜与上皮细胞发生脱离,且酸胁迫时脱离更严重。由图4可知,与对照组相比,酸、碱胁迫5 d时均使鳃小片变形、断裂。
2.2 酸、碱胁迫对河蟹后续生长及脱壳的影响
同对照组相比,酸、碱胁迫5 d均显著降低了河蟹成活率,且酸胁迫组成活率显著低于碱胁迫组(表2)。酸胁迫显著缩短脱壳周期,降低脱壳增长率;相应地,脱壳次数增加,平均增重率显著高于碱胁迫组和对照组。碱胁迫组脱壳增长率和脱壳周期低于对照组但差异不显著。
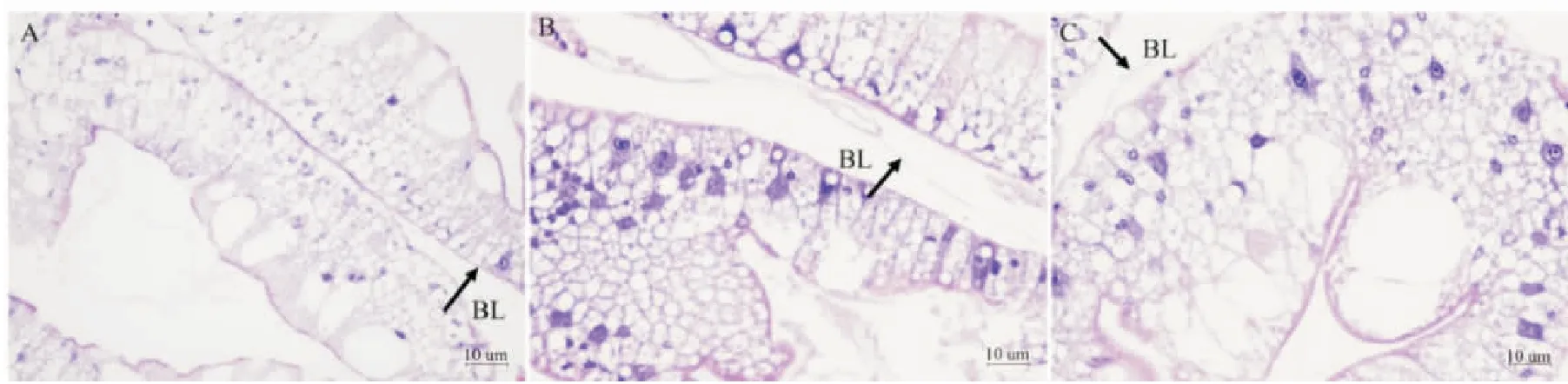
图3 河蟹酸、碱胁迫5 d后肝胰腺形态结构(H.E.)Fig.3 Hepatopancreas morphology of E.sinensis after acid and alkali exposure for 5 days(H.E.)A:pH 7.5(对照),示基底膜紧贴肝小管,未见脱落;B:pH 3.0,基底膜与上皮分离;C:pH 10 .3,基底膜与上皮分离。BL:基底膜。
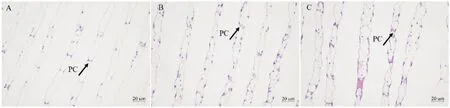
图4 河蟹酸、碱胁迫5 d后鳃小片形态结构(H.E.)Fig.4 Gill lamellae morphology of E.sinensis after acid and alkali exposure for 5 days(H.E.)A:pH 7.5(对照组),示正常鳃小片结构;B:pH 3.0(酸胁迫组),示鳃小片结构变形;C:pH 10.3(碱胁迫组),示鳃小片变形、肿胀;PC:柱状细胞。
表2 5 d酸、碱胁迫对河蟹存活率和脱壳增长率的影响Tab.2 Effects on survival rate and moulting length increase rate of E.sinensis after acid and alkali exposure for 5 days
3 讨论
酸、碱胁迫会导致机体产生过量的氧自由基[7],为了清除自由基以消减氧化损伤,机体会提高T-AOC和T-SOD活力[8]。本研究结果表明,酸、碱胁迫后6 h和24 h血清T-AOC活力显著升高(图2),提示此时机体具有对酸、碱胁迫的正常应答能力。然而,酸胁迫3 d和5 d时T-AOC低于对照组,这可能是由于严重的氧化应激导致代偿功能的丧失[9]。从T-SOD来看,酸胁迫后6 h和12 h 时也有所升高,与T-AOC的结果一致。然而,碱胁迫后T-SOD活力低于对照组,尽管差异不显著。存活率等其它指标表明,碱胁迫引起的应激反应要比酸胁迫弱,损伤小,因此,T-SOD下降不大可能是由于免疫疲劳或者代偿功能丧失。在中国对虾(Fenneropenaeuschinensis)上也观察到碱胁迫后T-SOD下降[10]。甲壳动物应对氧化应激的机制可能与其它动物有所不同,其体内富含虾青素,虾青素是一种高效抗氧化剂[11],碱胁迫可能促进河蟹调用虾青素抗氧化[7]。在养殖生产中发现,pH 10.3和pH 3.0的池塘内河蟹体色均较浅甚至略显红色,可能与甲壳中结合态虾青素释放用于抗氧化有关。
动物在应激时往往有氧呼吸受到抑制,机体为了应对外界刺激,激活无氧呼吸通路关键酶,增强糖酵解产能[8,16]。本研究中血清生化分析结果表明,酸、碱胁迫6 h和12 h后均增加了血清LDH活力和GLU[17]含量(图1),其中酸胁迫12 h时血清GLU是对照组的14倍,同时,胁迫5 d时肝糖原含量显著下降,这一结果与已有报道一致[8]。比较酸、碱胁迫后肝糖原和肌糖原的变化趋势,发现肌糖原与对照组差异不显著,而肝糖原在胁迫时显著下降,表明急性胁迫时河蟹趋向于利用肝糖原而非肌糖原。
酸、碱胁迫增加了血清TP含量,尤其是酸胁迫时,但血清尿素含量未见显著增加。这一现象与贾小燕[18]等在河蟹盐度胁迫时观察到的现象一致,提示应激反应时河蟹可能主要不是依靠分解蛋白供能[19]。TP升高可能主要是为了满足渗透压调节[20]和维持离子跨膜转运[21]以适应异常环境。
蟹塘pH主要受水草盛衰的影响,多年调研中未见蟹塘pH持续处于极端状态。尽管这种极端pH异常的持续时间较短,但研究中仍发现,pH连续5 d为10.3的蟹塘,后续脱壳期草丛中出现了不少脱壳不遂的死蟹,且活蟹体色及肝胰腺颜色普遍较浅。而在水体pH为3.0的苗种池塘中,蟹的体色和鳃均有发红现象。由此推测,短期极端酸、碱胁迫可能会引起组织损伤,这种短期强胁迫很可能是养殖生产实践中河蟹存活率低的重要原因。从组织形态看,酸、碱胁迫5 d后均出现鳃小片损伤变形(图4B和4C),肝胰腺基底层与上皮分离(图3B和3C),证明短期极端酸、碱胁迫均引起了河蟹鳃和肝胰腺组织损伤。从肝胰腺组织切片看,酸胁迫引起的组织损伤明显强于碱胁迫(图3B和3C),与上述抗氧化力和血清生化分析结果相同,也与大多文献报道结果一致[16,22]。
本研究结果表明,酸、碱胁迫会导致河蟹应激脱壳,使脱壳周期缩短,平均个体增重率短期内有所升高。这一现象与日本对虾(Penaeusjaponicus)[23]和斑节对虾(P.monodon)[24]相似。但处于胁迫环境下通常会有更多的能量被用于维持内环境稳定[25],从而导致饲料利用效率低下,生长发育迟缓[22]。本研究结果也表明酸、碱胁迫均显著降低了河蟹成活率和脱壳增长率。蟹塘内水草的有无及其状态被认为是影响河蟹产量和规格的决定因素。本研究结果清楚地表明,短期极端酸、碱胁迫是影响河蟹存活率和脱壳增长率的重要原因。蟹塘中酸胁迫比较少见,但短期pH大于10的池塘比比皆是。为了提高存活率和脱壳增长率,从而提高产量,养殖过程中要注意对pH的管控。
