应用640层动态能谱CT成像对结直肠肿物的初步研究
2020-11-25
辽宁省肿瘤医院医学影像科,沈阳 辽宁 110042
结直肠癌是全球第3大常见癌症,仅2018年就有180万例新诊断患者[1]。结直肠腺瘤是最常见的结直肠良性肿瘤,具有恶变潜能,被认为是一种癌前病变,但是部分结直肠腺瘤表现不典型,并且可能存在假癌性浸润[2],传统CT检查很难区分结直肠腺瘤和腺癌。既往研究大多数以结直肠恶性肿瘤分期为主要研究方向[3-4],很少有鉴别结直肠腺瘤、腺癌以及评估肿瘤病理学分级的报道。结直肠癌的预后不仅取决于早期检测和治疗,而且还与分化程度密切相关,不同分化程度的结直肠癌在流行病学和生物学行为上是不同的,术前准确地评估癌症分级对制定综合治疗方案及患者预后非常重要[5]。在临床应用中,传统CT和结肠镜检是诊断结直肠肿物的主要方法,CT检查无创,无须给予镇痛剂或镇静剂,无严重并发症,可最大限度地降低结肠镜检查的风险。研究表明,多层螺旋CT可有效地检测结肠肿瘤,特别是直径≥1 cm的肿瘤及息肉,可以有效地显示肿瘤的形状、大小和位置,淋巴结转移和远处转移状态,并提供准确的术前TNM分期[6-7]。然而在传统CT成像对结直肠恶性肿瘤分期分级的研究中缺乏定量参数的测量。动态能谱CT成像将CT能谱成像及CT灌注成像联合,在1次扫描1次注药下,可同时得到能谱参数和灌注参数,解决传统CT对结直肠疾病检测的局限性。既往研究报道,能谱CT成像能够通过其虚拟单色图像改善图像质量,并通过其定量材料分解图像提高诊断良恶性肿瘤的准确率[8-10]。本研究的目的是探讨动态能谱CT成像定量参数对结直肠癌分化程度及与结直肠良恶性肿物鉴别的诊断价值。
1 资料和方法
1.1 研究对象
收集2017年12月—2019年5月于辽宁省肿瘤医院接受CT扫描的结直肠肿物患者84例。其中,男性36例,女性48例;年龄23~63岁,平均年龄50.3岁。术后病理学检查结果显示,腺瘤15例,腺癌69例。病理学分级采用世界卫生组织(World Health Organization,WHO)结直肠癌组织学分级标准:1级,高分化腺癌,>95%腺管生成;2级,中分化腺癌,50%~95%腺管生成;3级,低分化腺癌,0%~49%腺管生成、黏液腺癌及印戒细胞癌;4级,未分化癌。将69例结直肠癌患者根据其术后病理学检查结果分为两组:高分化组(n=36)和中低分化组(n=33)。中低分化组包括2例印戒细胞癌,1例绒毛管状腺癌伴低级别上皮内瘤变。所有患者在手术前均未接受放疗、化疗等针对恶性肿瘤的系统性治疗。
1.2 仪器与方法
采用日本Toshiba公司的Aquilion ONE 640层CT一站式动态能谱扫描仪,行腹盆腔CT平扫,确定病变范围,将病灶放置探测器宽度内(动态能谱扫描探测器最大范围16 cm),应用高压注射器经肘静脉注入非离子型对比剂(碘海醇,370 mg/mL)40 mL,流速4.0 mL /s,随后以相同流速注入40 mL 0.9% NaCl溶液。注入对比剂后从第7 s开始扫描,每间隔3 s连续能谱(80+135)kV曝光1次,曝光7次后,再间隔5 s连续曝光3次,平扫管电压135 kV,管电流35 mAs,重建层厚为0.5 mm,扫描范围16 cm。将注射造影剂后24 s定义为动脉期(arterial phase,AP),44 s定义为门静脉期(portal venous phase,PP)。患者行CT检查前8~12 h口服舒泰清(聚乙二醇电解质散剂)清空肠道。在检查前10 min给予肌肉注射山莨菪碱(20 mg),以减少肠运动,减轻肠痉挛并减少肠道伪影。使用人工球囊将1000~1500 mL的气体注入结肠以使结肠完全扩张。
1.3 图像分析
图像传入工作站后在Toshiba能谱处理程序中生成120 kV图像序列和碘图,通过Enhanced image获得强化效果最好的图像,在能谱处理程序的image View中放入生成的碘图和与碘图相匹配的120 kV图像,在120 kV图像上选择肿瘤强化最明显层面放置感兴趣区域(region of interest,ROI),ROI面积为10~15 mm2,通过Sync将ROI同步到相应病灶部位的碘图,得到病灶部位碘值。注意避开肠腔内液体、小气泡、脂肪组织及小血管,连续测量3层,取均值作为碘浓度值(iodine value,IC),并通过动态碘图分析碘在肿瘤内的扩散过程。所有患者扫描参数一致,为了消除患者间的个体差异,采用标准化IC(normalized IC,NIC)=病灶IC/同层臀大肌IC。图像传入工作站后,选择体部容积灌注软件中的单血供最大斜率法进行后处理,选择病灶最大层面的髂外动脉和正常肠壁组织设定ROI,形成两者的时间-密度曲线(time-density curve,TDC),通过计算形成轴位、矢状位及冠状位上的CT灌注伪彩图,并测量动脉血流量(arterial blood flow,AF)、血容量(blood volume,BV)、表面渗透性(surface permeability,PS)。灌注伪彩图AF在轴位伪彩图上进行测量,ROI选择在肿瘤灌注最明显的部位(颜色最明亮),ROI面积10~15 mm2,注意避开血管、肿瘤坏死区及肿瘤边缘部分,连续测量3层,取均值作为AF;同时在BV、PS灌注伪彩图的相应ROI上求得BV、PS值。
1.4 统计学处理
连续性变量用±s表示,首先采用Kolmogorov-Smimov检验行正态性分析,Levene检验进行方差齐性检验。分类变量采用χ2或Fisher精确检验。采用独立样本t检验比较各组动脉期和静脉期中的IC、NIC、AF、BV、PS。阈值由受试者工作特征(receiver operating characteristic,ROC)曲线创建和确定,以区分腺瘤组和腺癌组,高分化腺癌组和中低分化腺癌组。通过ROC曲线的曲线下面积来确定诊断效能。数据分析采用SPSS 17.0软件完成,P<0.05为差异有统计学意义。
2 结 果
2.1 使用动态能谱CT成像定量参数评估腺瘤与腺癌
动脉期腺瘤组的I C和N I C值分别为(59.98±15.14)mg/mL和2.48±0.59,静脉期为(75.38±5.39)mg/mL和3.77±0.22。动脉期腺癌组的I C和N I C值分别为(62.53±15.75)mg/mL和2.62±0.62,静脉期为(60.25±11.80)mg/mL和2.86±0.53。静脉期IC和NIC对鉴别腺瘤和腺癌存在显著差异(P<0.001)。在腺瘤组中AF、BV、PS值分别为(219.88±75.47)mL/(min·100 g)、(34.78±26.80)m L/100 g、(66.87±19.90)mL/(min·100 g),在腺癌组中A F、BV、PS值分别为(124.15±40.77)mL/(min·100 g)、(12.15±7.48)m L/100 g、(77.78±31.01)mL/(min·100 g)。腺瘤组和腺癌组之间的AF、BV和PS差异均有统计学意义(P<0.001,表1)。
2.2 动态能谱CT成像定量参数评估高分化腺癌与中低分化腺癌
动脉期及静脉期的IC和NIC在鉴别高分化腺癌和中低分化腺癌中差异均无统计学意义(P>0.05)。腺癌高分化组的AF、BV和PS值为(87.20±9.38)mL/(min·100 g)、(5.95±2.41)mL/100 g和(55.62±8.07)m L/(min·100 g),中低分化腺癌组的A F、B V和P S值为(158.02±26.11)mL/(min·100 g)、(17.83±5.84)mL/100 g和(79.15±21.73)mL/(min·100 g)。高分化腺癌和中低分化腺癌之间的AF、BV和PS差异均有统计学意义(P<0.001,表2)。
表1 腺瘤组与腺癌组一般临床资料和定量参数的比较 (±s)
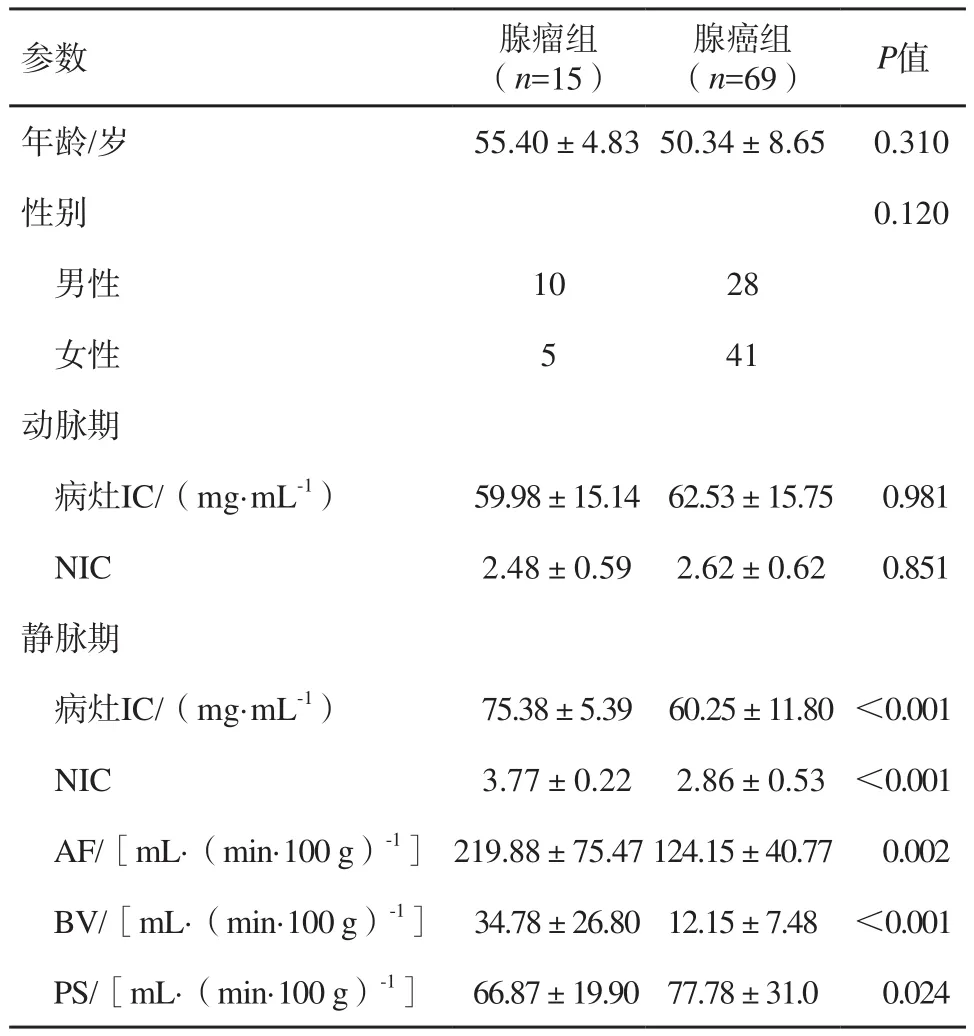
表1 腺瘤组与腺癌组一般临床资料和定量参数的比较 (±s)
参数 腺瘤组(n=15)腺癌组(n=69) P值年龄/岁 55.40±4.8350.34±8.650.310性别 0.120男性 1028女性 541动脉期病灶IC/(mg·mL-1) 59.98±15.1462.53±15.750.981 NIC 2.48±0.592.62±0.620.851静脉期病灶IC/(mg·mL-1) 75.38±5.3960.25±11.80 <0.001 NIC 3.77±0.222.86±0.53 <0.001 AF/[mL·(min·100 g)-1]219.88±75.47124.15±40.770.002 BV/[mL·(min·100 g)-1] 34.78±26.8012.15±7.48 <0.001 PS/[mL·(min·100 g)-1] 66.87±19.9077.78±31.00.024
表2 腺癌高分化组与中低分化组一般临床资料和定量参数的比较 (±s)

表2 腺癌高分化组与中低分化组一般临床资料和定量参数的比较 (±s)
参数 高分化组(n=36)中低分化组(n=33) P值年龄/岁 49.75±10.8251.00±5.490.041性别 0.127男性 1116女性 2517动脉期病灶IC/(mg·mL-1) 63.27±16.2161.73±15.430.843 NIC 2.61±0.612.63±0.650.220静脉期病灶IC/(mg·mL-1) 60.44±11.3960.05±12.400.269 NIC 2.83±0.492.89±0.580.129 AF/[mL·(min·100 g)-1] 87.20±9.38158.02±26.11 <0.001 BV/[mL·(100 g)-1] 5.95±2.4117.83±5.84 <0.001 PS/[mL·(min·100 g)-1] 55.62±8.0779.15±21.73 <0.001
2.3 使用动态能谱CT不同指标区分腺瘤与腺癌、高分化腺癌与中低分化腺癌的曲线下面积(area under curve,AUC)、阈值、灵敏度和特异度
使用IC、NIC、AF、BV、PS评估腺瘤与腺癌的AUC分别为0.701、0.800、0.900、0.870和0.596(表3,图1)。将静脉期NIC=3.52作为阈值区分腺瘤与腺癌的灵敏度为72.0%,特异度为91.9%。将AF=175.13 mL/(min·100 g)作为阈值鉴别腺瘤和腺癌的灵敏度为80.0%,特异度为86.4%(表3,图1)。使用NIC和AF作为阈值鉴别腺瘤与腺癌具有较高的诊断价值。使用IC、NIC、AF、BV、PS评估高分化腺癌与中低分化腺癌的AUC值分别为0.614、0.591、0.750、0.856和0.784(表4,图2)。将静脉期NIC=2.80作为阈值区分高分化腺癌与中低分化腺癌的灵敏度为63.6%,特异度为69.3%。以BV=7.76 mL/100 g鉴别高分化腺癌与中低分化腺癌的灵敏度为90.9%,特异度为77.7%,具有良好的诊断效能。
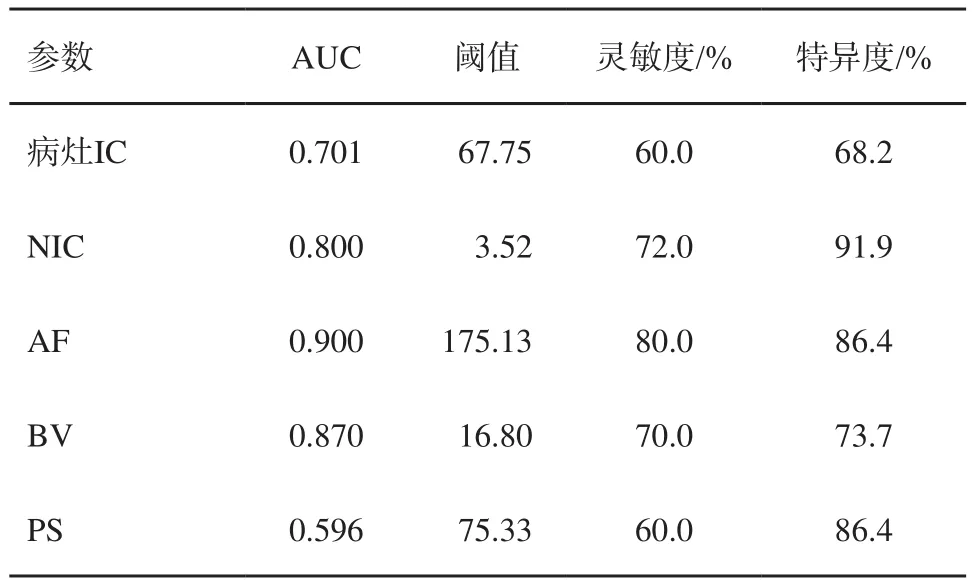
表3 使用动态能谱CT不同指标区分腺瘤与腺癌的AUC、阈值、灵敏度和特异度
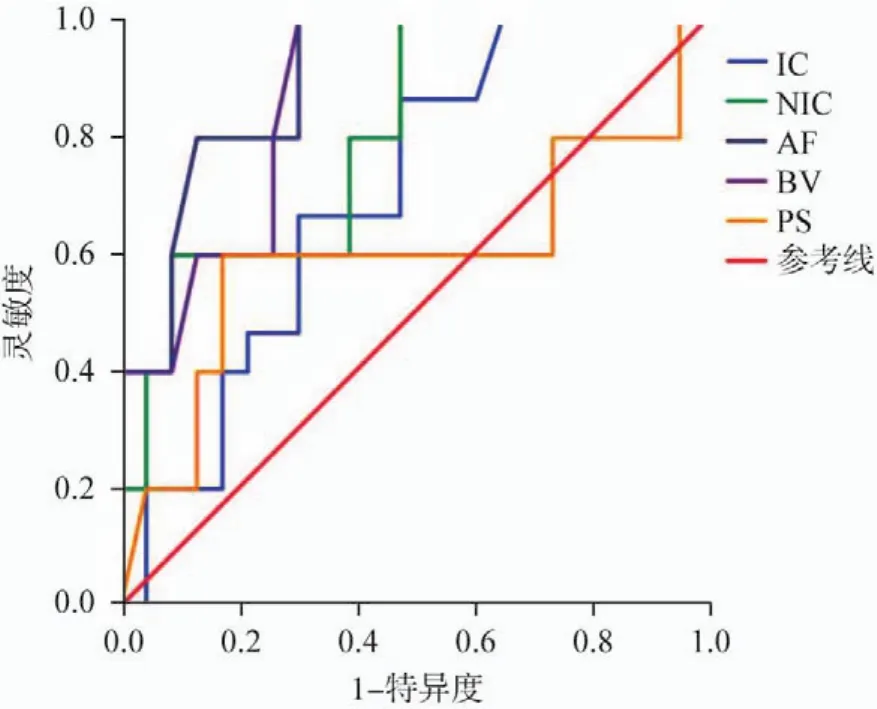
图1 使用动态能谱CT不同指标区分腺瘤与腺癌的ROC曲线

表4 使用动态能谱CT不同指标区分高分化腺癌与中低分化腺癌的AUC、阈值、灵敏度和特异度
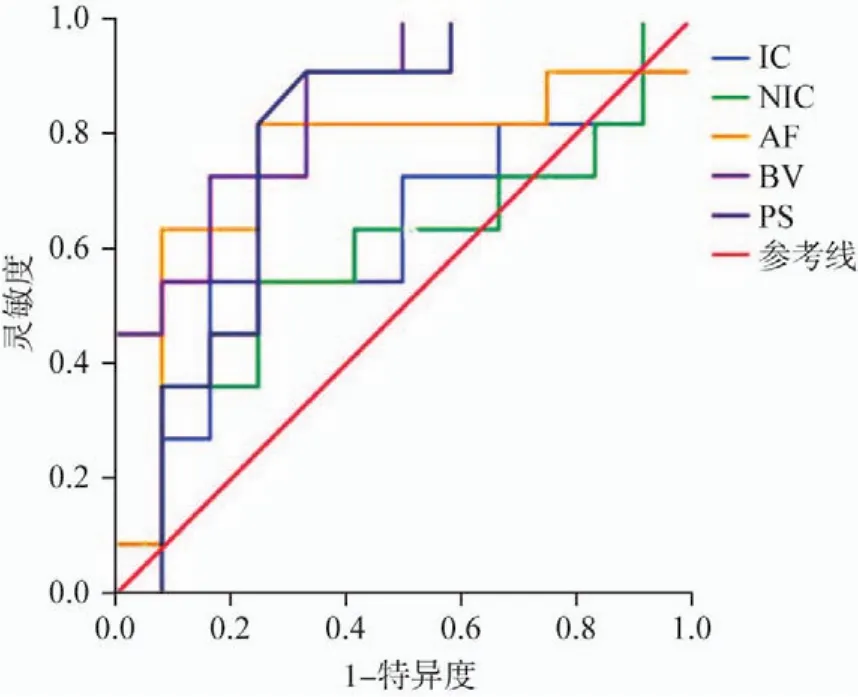
图2 使用动态能谱CT不同指标区分高分化腺癌与中低分化腺癌的ROC曲线

图3 乙状结肠高分化腺癌CT动态碘图
3 讨 论
CT能谱成像和CT灌注成像是CT功能成像的两种方式,以往的研究中一次扫描只能实现能谱成像或灌注成像其中一种成像方式。动态能谱成像使用特有的16 cm容积能谱能实现电影能谱功能,在一次扫描一次注药下,即可进行全身各器官全时相实时动态电影模式的能谱采集,在常规能谱成像下引入全新的时间轴的概念,获得比常规能谱信息更多的电影能谱信息,真实地反映病理生理学变化,得到精准的诊断结果。动态能谱成像在一次采集中同时采集两个不同光子光谱的数据集,可同时得到碘图和灌注参数。这些参数可以用于评估结直肠癌的血流动力学特征,为临床医师提供更多的诊断信息。
结直肠腺瘤是腺癌重要的癌前病变,病理学上异型增生、腺瘤、腺癌的演变过程约为10年[11]。目前关于结直肠腺瘤的研究多基于形态学表现,临床工作中,腺瘤与腺癌形态学表现存在重叠,并且部分腺瘤存在假癌性浸润,即腺体结构浸润到黏膜下层甚至肌层内,因此仅依据传统形态学表现对腺瘤和腺癌进行准确鉴别有时存在困难。能谱CT扫描是采用两个球管同时扫描,一次曝光即可得到80~135 kV的一系列单能量图像,其虚拟单色图像能够改善图像质量,并通过其定量材料分解图像使得病变内部差异完全显示,从而定量反映出病灶组织密度、强化方式等。IC及NIC反映能谱增强CT扫描中不同组织对碘的摄取能力并且可以准确地量化其浓度[13],间接反映肿瘤细胞的状态及病灶血流动力学改变。结果显示静脉期腺瘤组的IC及NIC明显高于腺癌组,差异有统计学意义(P<0.001),使用静脉期NIC=3.52作为阈值时区分腺瘤与腺癌的灵敏度、特异度分别为72.0%、91.9%,具有较高的诊断效能。本研究认为,结直肠腺瘤与腺癌的血供均较丰富,在动脉期扫描时相内,对比剂迅速进入结节,但结节未充盈完全,所以腺瘤组与腺癌组动脉期IC及NIC差异无统计学意义。而腺癌细胞分化不成熟,细胞生长快,新生血管不成熟,微血管处于受压状态,相应部位微循环障碍,在静脉期对比剂充分充盈病灶内部,故腺瘤组与腺癌组病灶内部IC及NIC可具有明显差异,且静脉期腺瘤组IC及NIC均高于腺癌组。这与陈丽红等[14]对胃癌分化程度的研究结果一致,胃癌静脉期IC及NIC与肿瘤分化程度均有一定的相关性,而动脉期不同分化程度IC值之间差异无统计学意义。张夏等[15]使用能谱曲线对甲状腺癌和颈部转移淋巴结的研究认为,静脉期甲状腺正常组织、恶性结节、良性结节的能谱曲线斜率差异有统计学意义(P<0.05),而动脉期差异无统计学意义(P>0.05)。灌注参数反映肿瘤内部的血管密度、BV及毛细血管通透性,腺瘤组AF、BV明显高于腺癌组,但PS明显低于腺癌组,差异有统计学意义(P<0.05),使用AF=175.13 mL/(min·100 g)作为阈值时鉴别腺瘤和腺癌的灵敏度、特异度分别为80.0%、86.4%,相比BV和PS具有更高的诊断价值。分析以上原因,虽然结直肠腺癌新生血管较腺瘤多,理论上组织血流较丰富,病灶IC较高,但是一方面由于腺癌细胞分化不成熟,与腺瘤相比细胞功能不全。另一方面腺癌细胞生长快,新生血管不成熟,微血管处于受压状态,相应部位微循环障碍,在一定程度上致腺癌血流灌注较低,而腺瘤微血管密度丰富,管壁通透性良好且管壁完整,所以血供非常丰富,增强后病灶内对比剂滞留时间较长,导致腺瘤组的IC、NIC、AF和BV明显高于腺癌组,而PS明显低于腺癌组。
目前关于结直肠腺癌分化程度的研究主要集中于利用表观扩散系数(apparent diffusion coefficient,ADC)值来预测肿瘤的分化程度,但对其结果仍存在一定的争议[12]。肿瘤灌注成像作为一种功能性成像方法,可以检测肿瘤内微血管生成和分布情况,反映肿瘤内部的血流灌注状况,能够帮助分析肿瘤的生物学特性,对肿瘤的诊断和疗效评价有重要意义[16-17]。本次研究结果显示高分化腺癌组的AF、BV、PS均低于中低分化腺癌组,差异有统计学意义(P<0.01)。灌注成像是一种功能成像,依赖于肿瘤内血管生成,不同组织或同一疾病不同分化程度肿瘤内的血管密度不同,得到的灌注参数值不同,本研究结果表明肿瘤分化程度越差,肿瘤侵袭性越高,肿瘤的BV和PS越大,肿瘤的血液供应就越丰富。BV值在鉴别高分化腺癌和中低分化腺癌时有更高的AUC,与之前研究结果相符[18]。有研究表明,使用能谱成像中肿瘤内的碘分布值区分结直肠高分化腺癌和中低分化腺癌有诊断意义[19]。而本研究结果显示高分化组腺癌的动脉期IC、静脉期IC及NIC的绝对值均低于中低分化腺癌组,但差异无统计学意义(P>0.05)。分析原因可能是在腺癌高分化组和中低分化组之间,肿瘤细胞对碘的摄取能力的差异要小于腺瘤和腺癌之间的差异。此结果与某些能谱CT的研究[19-20]结果不一致,可能与使用的扫描方式、能谱算法、纳入患者的构成不同等因素有关,有待进一步研究。
本研究存在一些局限性。首先,纳入样本量较少,需进一步扩大样本量,以验证本研究所得结果。其次,在低分化组中,仅包括低分化的结肠腺癌,2例印戒细胞癌及1例绒毛管状腺癌伴低级别上皮内瘤变,代表性不全面。
动态能谱CT成像,可使用多个定量参数评估肿瘤良恶性及分化程度,反映肿瘤组织微循环的改变,相比传统CT成像,其术前评估结肠癌的良恶性及分化程度具有更高的诊断效能,可为临床诊断和治疗提供更多帮助。
