钼靶联合超声造影诊断乳腺导管原位癌1例
2020-11-25林乐武袁海霞吴爱琴许建芳王文平
林乐武,袁海霞,吴爱琴,毛 枫,许建芳,王文平
1. 复旦大学附属中山医院厦门医院超声科,福建 厦门 361015;
2. 复旦大学附属中山医院超声科,上海 200032
1 资 料
患者,女性,56岁,在外院钼靶体检发现“右乳2点方向多发钙化,性质待定”,然后于复旦大学附属中山医院厦门医院外科查体示双乳未触及明显肿物,挤压双乳头未见液体溢出。行超声检查发现,右乳2点方向,距乳头约3~4 cm处见片状回声紊乱区,范围约20 mm×11 mm,边界不清,其内散在分布多个点状强回声,彩色多普勒血流显像示其内见短线状彩色血流,测及动脉血流,阻力指数(resistance index,RI)为0.68(图1)。超声造影显示注射造影剂19 s后,右乳2点方向见大小为22 mm×11 mm的整体增强区,位置与回声紊乱区相对应,病变区增强强度显著高于周边乳腺组织,40 s左右减退为与周边组织类似的低回声区(图2)。双侧腋窝未见明显异常淋巴结回声。超声提示恶性肿瘤可能。血肿瘤指标:糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原 153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、细胞角蛋白19片段(cytokeratin-19 fragment,CYFRA21-1)均阴性。根据超声定位行乳腺肿块切除术,术后病理学诊断见图3。巨检结果为(右乳肿物)灰白灰黄组织1枚,大小5 cm×3 cm×2 cm,切面灰白质中,其间见散在颗粒样结节,直径0.1~0.2 cm。免疫组织化学结果为上皮细胞钙黏蛋白(E-cadherin,E-cad)(+),人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(原位癌3+),孕激素受体(progesterone receptor,PR)(-),平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SMMHC)(肌上皮+),内皮转录因子3(endothelial transcription factor 3,GATA3)(+),雌激素受体(estrogen receptor,ER)(原位癌约20%+),Ki-67(15%阳性),CK5/6(肌上皮+),CD10(肌上皮+),P63(肌上皮+)。病理学诊断为乳腺导管原位癌(ductal carcinomainsitu,DCIS),中等级别。
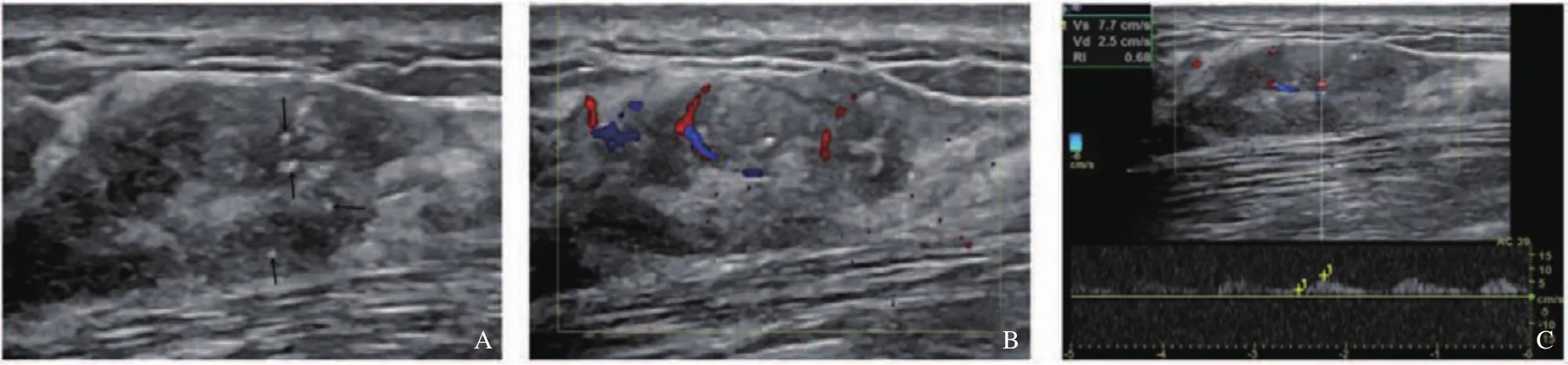
图1 DCIS的二维超声及彩色多普勒血流显像表现

图2 DCIS的超声造影表现

图3 DCIS大体病理及CD34免疫组织化学染色的表现
2 讨 论
DCIS是一种肿瘤性导管内病变,有发展为浸润性导管癌的风险,Naseem等[1]对937例乳腺癌患者的回顾性研究发现约90%的DCIS表现有钙化,其中40%可能进展为浸润性导管癌 。手术切除联合放疗或他莫昔芬是治疗DCIS的主要治疗方式[2]。与浸润性导管癌相比,DCIS患者病死率非常低[3]。因此,对DCIS的研究焦点在于早期发现、早期干预,预防浸润性导管癌的发生。
本研究中,患者为中老年女性,钼靶X线检查结果显示,其表现为右乳内上多发聚集钙化点,常规超声扫查该区域回声紊乱,局部见多发点状强回声,彩色多普勒血流显像可见短线状彩色血流。这些特征均有助于诊断病变。但无论是常规超声检查还是钼靶X线检查均无法确定病灶范围和边界,也无法进行良恶性的鉴别诊断。袁聪聪等[4]研究发现,单纯DCIS多表现为边缘到中央整体中高强度灌注,部分周边可见血管样灌注,其中部分可呈环形血管样灌注,本研究病变通过超声造影,呈现整体高增强,与上述文献报道相符。
由于DCIS起病隐匿,通常没有症状或体征,微钙化是诊断DCIS的重要征象,乳腺摄影检查是检出微钙化的最佳选择,虽然相关研究提示62%~98%的DCIS患者钼靶X线检查可见钙化灶,但特异度低,需行其他检查或穿刺确诊[5];对于无钙化的DCIS,超声检出率明显高于乳腺钼靶X线摄影[6],相比常规高频超声检查,超声造影对术前DCIS肿瘤大小的评估更为准确[7]。因此,将钼靶、高频超声和超声造影三者相结合,有助于病灶的早期检出和病变范围的确定,是值得推荐的临床诊断方法。
