放射性核素标记HER2抗体和纳米抗体的分子影像研究进展
2020-11-25宋宏杰周治国宋少莉王明伟
宋宏杰,周治国,宋少莉,王明伟
1. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学生物医学影像研究中心,上海分子影像探针工程技术研究中心,上海 200032;
3. 复旦大学核物理与离子束应用教育部重点实验室,上海 200433;
4. 上海师范大学化学与材料科学学院,上海 200234
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是酪氨酸激酶受体蛋白,已发现HER2高表达在许多癌症类型中对细胞分化、增殖和预后起关键作用[1]。研究发现:20%~30%的乳腺癌[2],20%的胃癌或胃食管交界癌[3],5%~15%的膀胱癌[4],5%~15%的宫颈癌[5],12%~15%的胆囊癌[6],8%~35%的子宫内膜癌[7],6%~7%的卵巢癌[8]和15%~37%的唾液腺癌[9]HER2呈阳性。因此,HER2表达检测对于癌症的诊断和治疗非常重要,特别是具有定性/定量和全身显像特点的HER2靶向性分子影像,能够同时检测原发灶、单/多转移灶和治疗过程中HER2表达动态变化。
为了发展有效的HER2分子影像检查方法,包括抗体[10]、肽[11-12]和适配体[13-14]等在内的HER2靶向性生物分子均有相关的研究报告。其中,曲妥珠单抗(trastuzumab,TzAb)是美国食品药品监督管理局(Food and Drug Administration,FDA)批准的一种人源化单克隆抗体,能够结合HER2的细胞膜外区并抑制其功能[15],基于该抗体的分子影像研究相对较多。然而,完整抗体的相对分子质量较大(约150×103),导致血液循环时间长,达到最佳显像效果的时间通常在注射后3~7 d,临床应用有一定的局限性。纳米抗体是天然存在的最小抗原结合片段,相对分子质量小,仅为10×103~15×103,只是完整抗体的1/10,并且有稳定性高、易于生产等优势,在分子影像领域的应用已经逐渐兴起[16-20]。本文主要综述放射性核素标记HER2完整抗体和纳米抗体的分子影像探针及其单光子发射计算机断层成像(single-photon emission computed tomography,SPECT)/电子计算机断层扫描(computed tomography,CT)、正电子发射断层成像(positron emission tomography,PET)/CT显像的研究进展。
1 基于高相对分子质量HER2单克隆抗体的核素分子影像
至今各类放射性核素标记靶向HER2的单克隆抗体已有很多研究。例如,64Cu[21-24]、18F[25-26]、89Zr[27-30]、99mTc[31-32]、111In[33-35]、131I[36-37]等核素标记的TzAb和帕妥珠单抗(pertuzumab,PzAb)处子不同的研究阶段,利用SPECT/CT或PET/CT显像可在体内检测肿瘤组织HER2表达水平。
1.1 核素标记TzAb及其SPECT/CT和PET/CT分子影像
TzAb是与HER2的细胞膜外结构域Ⅳ结合的重组人源化单克隆抗体[38]。放射性核素标记TzAb的临床前和临床研究都已经取得进展,能够使HER2阳性肿瘤病灶显像。为了利用SPECT/CT显像HER2表达,Price等[33]将螯合剂p-SCN-Bn-H4octapa{N,N’-[(羧酸基)甲基]-N,N’-[(6-羧酸基)吡啶(2-基)甲基]-1-(对苄基-异硫氰酸基)-1,2-二氨基乙烷}与TzAb偶联发展了新型HER2靶向抗体复合物H4octapa-Tz,并在温和的条件下(15 min,室温)实现了显像核素111In和治疗核素177Lu标记,以较高的放射化学标记率(94%~95%)获得了111In-octapa-TzAb和177Lu-octapa-TzAb(图1),研究者以SKOV-3卵巢癌移植瘤小鼠为实验模型,获得了111In-octapa-TzAb和177Luoctapa-TzAb SPECT/CT图像,均能清楚显像肿瘤部位(图1),二者分别于注射120和96 h后肿瘤摄取达到最大值[(72.4±21.3)%ID/g和(70.4±25.8)%ID/g]。该研究结果表明111In标记TzAb的HER2表达SPECT/CT显像具有很好的应用前景。随后,Gaykema等[35]报道TzAb治疗中HER2阳性转移性乳腺癌111In-TzAb SPECT显像具有可行性,发现治疗后111In-TzAb的肿瘤摄取值明显降低。
由于PET/CT显像的优势更加明显,利用半衰期较长的正电子核素标记TzAb PET/CT显像HER2表达的研究更受关注。Tamura等[23]以DOTA为螯合剂,制备了核素64Cu标记的HER2显像探针64Cu-DOTA-TzAb,并开展了HER2阳性乳腺癌患者64Cu-DOTA-TzAb PET/CT显像、安全性和内辐射剂量研究,该研究发现,注射后48 h是评价肿瘤摄取64Cu-DOTA-TzAb的最佳时间点,而且获得了乳腺癌原发灶和脑转移灶的高对比度的PET/CT显像(图2),其辐射剂量与常用的18F-FDG相当,具有较好的安全性。
1.2 核素标记帕妥珠单抗(pertuzumab,PzAb)及其SPECT/CT和PET/CT分子影像
如同TzAb一样,PzAb是靶向HER2的另一种单克隆抗体,其结合于HER2的细胞膜外亚结构域Ⅱ。放射性核素标记PzAb及其HER2表达分子影像的临床前和临床研究同样取得了良好的进展。McLarty等[34]于2009年报道111In-DTPA-PzAb micro SPECT/CT显像可灵敏地检测乳腺癌模型HER2表达变化,研究者首先通过体外SKBR-3细胞饱和结合实验测量111In-DTPAPzAb的Kd和Bmax分别为(2.0±1.0)nmol/L和(1.2±0.2)×106受体/细胞。MDA-MB-361肿瘤模型体内micro SPECT/CT显像表明,肿瘤部位显像清晰,而且能够动态监测TzAb治疗后导致的HER2表达降低(图3)。后来,他们又发展了用于制备111In-DTPA-PzAb的试剂盒,更加方便开展相关的临床研究[39]。
为了开展基于PzAb的HER2表达PET/CT显像研究,Jiang等[24]于2017年报道64Cu-DOTAPzAb micro PET可显像卵巢癌HER2表达。他们选择了3种卵巢癌细胞SKOV3、OVCAR3 和Caov3,开展64Cu-DOTA-PzAb的体外细胞结合实验,结果显示其与SKOV3细胞具有高的特异度[Ka=(3.1±0.6)nmol/L]。进一步micro PET显像结果表明,注射后48 h,3种肿瘤组织的64Cu-DOTA-PzAb摄取值分别为(41.8±3.8)、(10.5±3.9)和(12.1±2.3)%ID/g,且能清晰检查转移灶(图4)。2018年Ulaner等[30]报道89Zr-PzAb PET/CT可显像乳腺癌患者体内HER2表达,并首次开展临床应用和辐射剂量研究,该研究入组了6例HER2阳性转移性乳腺癌患者,注射89Zr-PzAb后均没有毒性发生,全身平均有效剂量为(0.54±0.07)mSv/MBq。89Zr-PzAb的最佳显像时间点为注射后5~8 d,其PET/CT显像能够检查到多个HER2阳性病灶和脑转移灶(图5)。
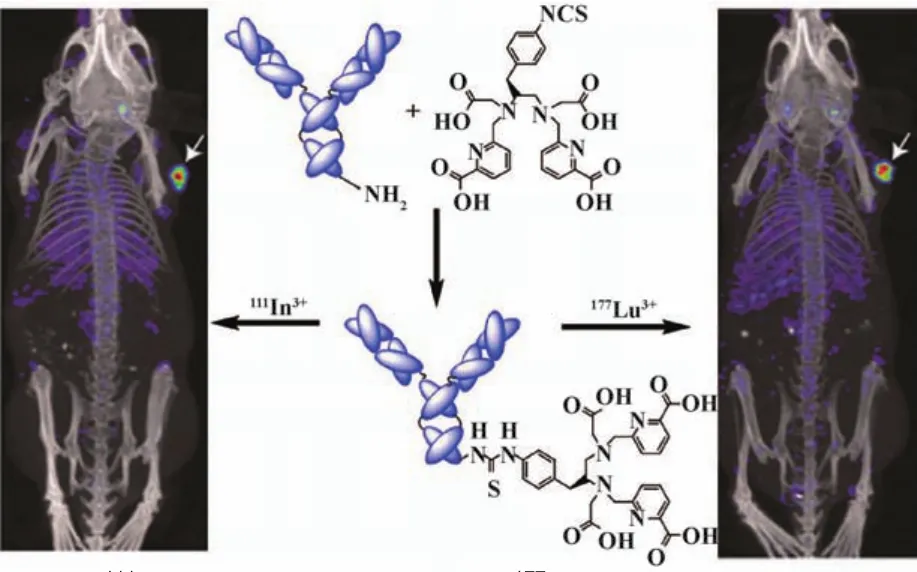
图1 111In-octapa-TzAb(左)和177Lu-octapa-TzAb(右)SPECT/CT显像及octapa-TzAb的结构(中)
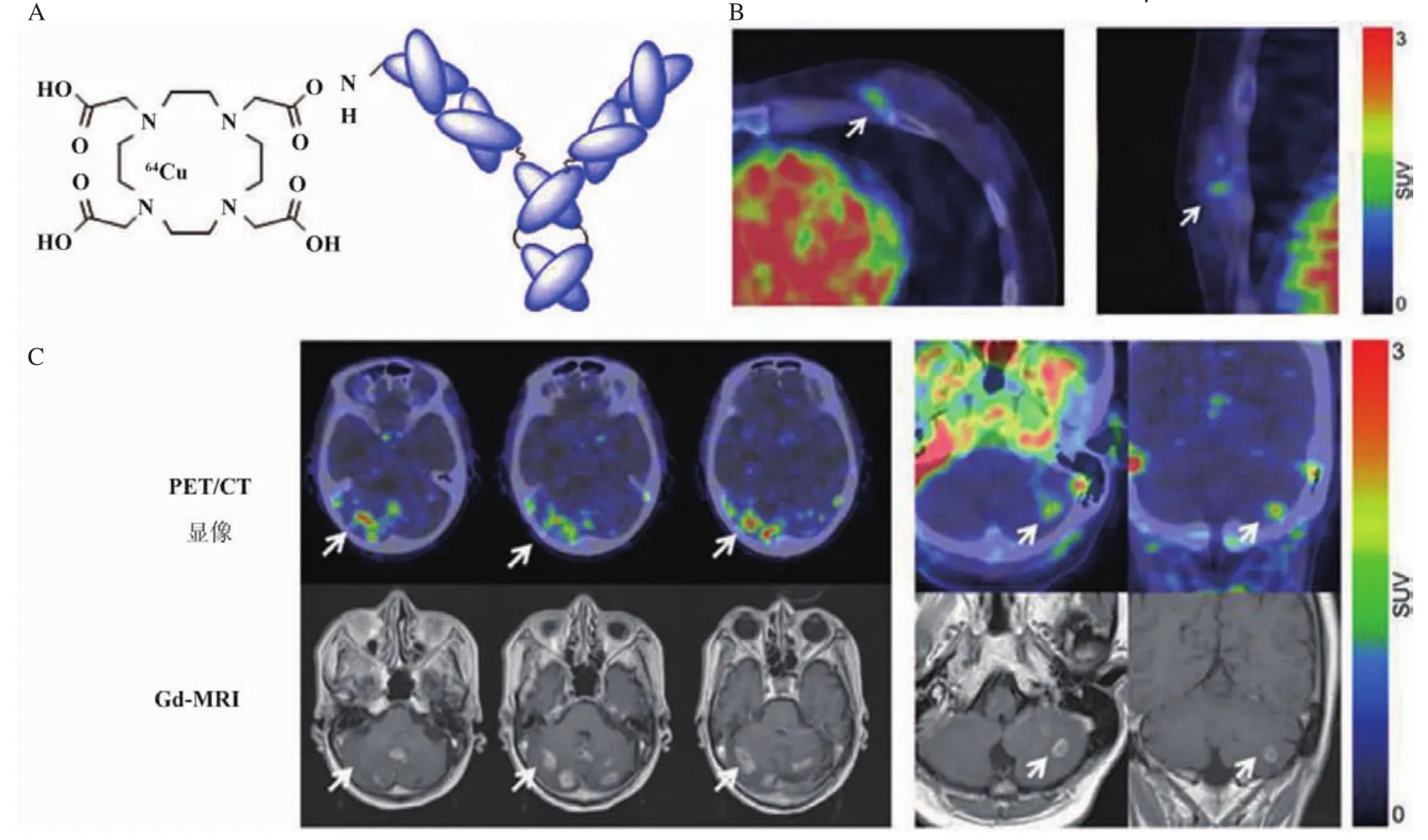
图2 64Cu-DOTA-TzAb结构和肿瘤患者PET/CT显像
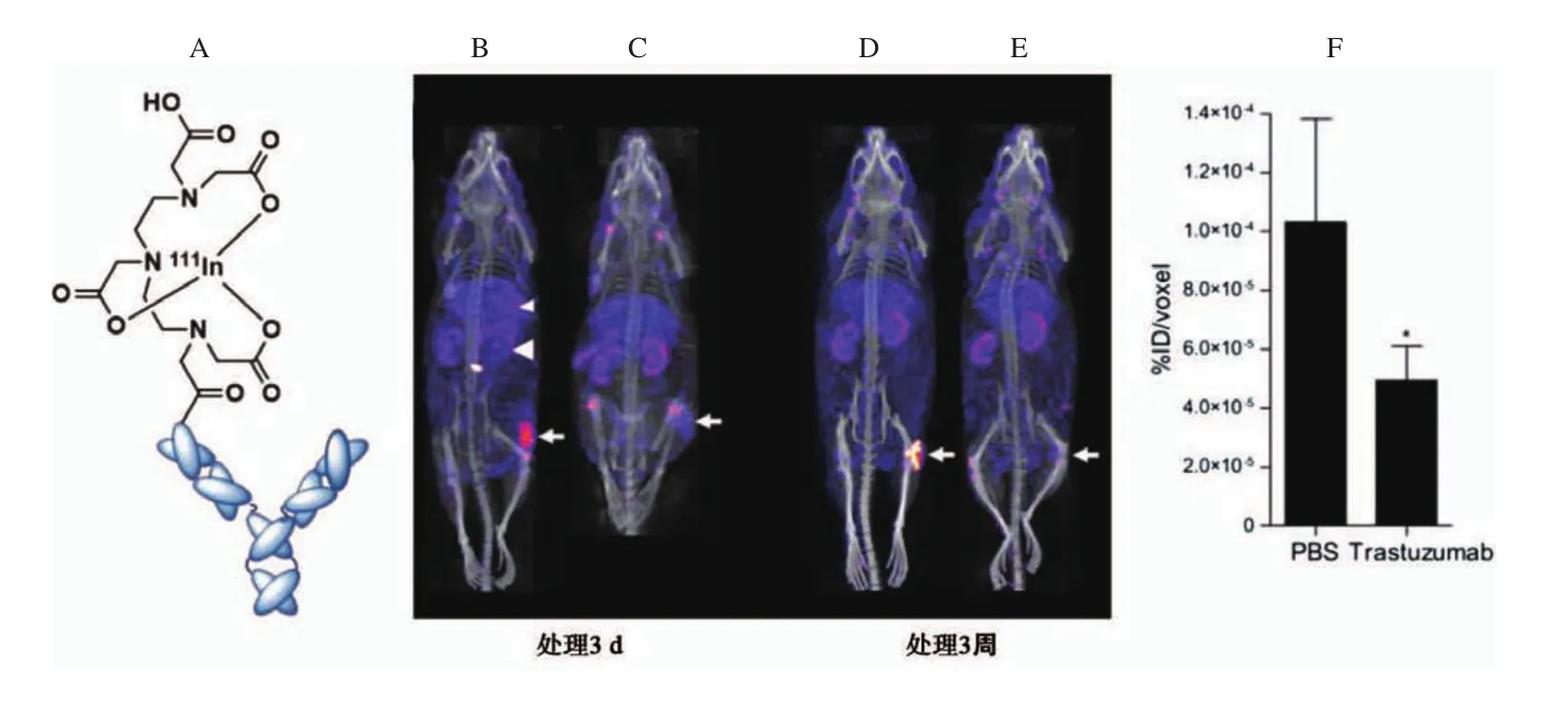
图3 111In-DTPA-PzAb结构和肿瘤模型SPECT/CT显像

图4 64Cu-DOTA-PzAb结构和肿瘤模型PET/CT显像

图5 89Zr-PzAb结构和肿瘤患者PET/CT显像
2 基于低相对分子质量HER2纳米抗体的核素分子影像
基于纳米抗体的肿瘤分子影像和诊疗应用是新兴研究领域,其中放射性核素标记HER2纳米抗体是非常活跃的一个研究领域。不同的放射性核素标记的靶向HER2纳米抗体及其应用见表1。

表1 核素标记HER2纳米抗体与应用
2.1 单光子核素标记HER2纳米抗体及其SPECT/CT分子影像
2.1.199mTc标记HER2纳米抗体及其SPECT/CT显像
Vaneycken等[40]于2011年制备了靶向HER2的38种纳米抗体,通过体外生化表征和细胞结合实验评价,发现2Rs15d纳米抗体稳定性好,能选择性与HER2蛋白和HER2阳性细胞结合,亲和力为纳摩尔水平,且与TzAb和PzAb不存在竞争关系,是HER2阳性肿瘤的新型生物靶向分子。他采用[99mTc(H2O)3(CO)3]标记2Rs15d的方法,获得对应的分子影像探针99mTc-2Rs15d。其HER2阳性肿瘤模型的SPECT/CT显像定量和生物分布分析表明,99mTc-2Rs15d肿瘤摄取高,血液清除快,非靶器官积累低(肾脏除外)。注射后1 h,肿瘤/血液(T/B)与肿瘤/肌肉(T/M)的比值均已很高,肿瘤显像对比度清晰(图6)。
2.1.2111In标记HER2纳米抗体及其SPECT/CT显像
位点特异度标记是发展基于抗体的分子影像探针的挑战和难点,纳米抗体也面临同样的问题。Massa等[43]于2014年通过硫醚键方法开发了位点特异度标记纳米抗体的通用策略,研究者在他们前期研究HER2纳米抗体的基础上,选择His标签化2Rs15d(2Rs15d-H)为实验对象,为了避免干扰抗原结合能力,在其羧基端依次引入连接子(Linker)和半胱氨酸(Cys)构建新的衍生物2Rs15d-HLC。在温和的还原剂存在条件下,他们进一步将2Rs15d-HLC与含有马来酰亚胺基团的螯合剂maleimide-DTPA螯合,实现了核素111In标记,得到新的SPECT/CT显像探针111In-DTPA-2Rs15d-HLC,并与随机标记得到的111In-CHX-A″-DTPA-2Rs15d-H进行比较。体外生化性质实验表明, DTPA-2Rs15d-HLC的化学组分单一,结构式和相对分子质量明确,与HER2的亲和力保持在纳摩尔水平。其体内HER2阳性SKOV3肿瘤SPECT/CT显像显示,肿瘤组织吸收高,肝、肺等正常组织摄取值较低,体内稳定性良好(图7)。

图6 99mTc-2Rs15d的标记反应和肿瘤模型SPECT/CT显像

图7 111In-DTPA-2Rs15d-HLC的结构和肿瘤模型SPECT/CT显像
2.2 正电子核素标记HER2纳米抗体及其PET/CT分子影像
2.2.168Ga标记HER2纳米抗体及其PET/CT显像
核素68Ga可以通过68Ge/68Ga发生器获得,来源较为便利,同时半衰期短(t1/2=68 min),适用于标记多肽和纳米抗体等血液清除快、相对分子质量小的靶向性生物分子,与其相关的PET/CT显像报道越来越多。前文讲述的纳米抗体2Rs15d结构中均含有His6标签,它是为了便于分离纯化而在生产期间引入的。然而,对于人体内应用,这些富含组氨酸标签的融合蛋白可能存在免疫原性的风险[49-50],需要考虑去掉His6标签。Xavier等[46]于2013年报道,纳米抗体2Rs15dHis6和2Rs15d与螯合剂NOTA连接后,可以实现快速高效的68Ga标记,生成HER2表达PET/CT显像探针68Ga-NOTA-2Rs15dHis6和68Ga-NOTA-2Rs15d。在pH为5的条件下,室温反应5 min,它们的标记率达到97%以上,比活度为55~200 MBq/nmol。生物分布研究显示,这两种探针均能快速、特异地积聚于HER2阳性肿瘤部位,其注射后1 h肿瘤摄取值分别为(3.13±0.06)和(4.34±0.90)%ID/g,并有很高的肿瘤/血液(T/B)和肿瘤/肌肉(T/M)的比值,因而获得高对比度PET/CT图像(图8)。该研究报道了两个非常重要的发现:不含His6标签的探针68Ga-NOTA-2Rs15d的肾脏摄取减少60%;注射抗体的质量显著改变其整体的生物分布,即NOTA-2Rs15d的质量增加100倍,肝脏摄取值从(7.43±1.89)%ID/g降低到(2.90±0.26)%ID/g,而肿瘤摄取值从(2.49±0.68)增加到(4.23±0.99)%ID/g。
随后不久,该课题组就开展了68Ga-2Rs15d PET/CT显像检测乳腺癌患者HER2表达的Ⅰ期临床试验研究[17]。该项临床研究入组22例HER2评分2+或3+的原发或转移性乳腺癌患者,注射53~174 MBq68Ga-2Rs15d后进行PET/CT显像。研究结果表明,所有患者均没有发生不良反应,68Ga-2Rs15d的血液清除较快,注射1 h后血液的放射性活度只有注射量的10%,正常组织器官的吸收主要见于肾脏、肝脏和小肠,有效剂量为0.043 mSv/MBq,平均每人的吸收剂量为4.6 mSv。68Ga-2Rs15d PET/CT显像可以检测肿瘤组织(图9),该探针在原发肿瘤的积聚变化范围较大,而在转移性肿瘤组织的积聚都在本底之上,其临床应用需要进一步的验证。

图8 68Ga-NOTA-2Rs15d的结构和肿瘤模型PET/CT显像

图9 肿瘤患者68Ga-NOTA-2Rs15d PET/CT显像
2.2.218F标记HER2纳米抗体及其PET/CT显像
18F由医用回旋加速器生产,获得便利,产量较高,半衰期(t1/2=109.7 min)合适,已有多样化的标记方法,是目前用于PET/CT显像最广泛的正电子核素。18F标记的PET显像探针在临床和临床前分子影像领域均是最有代表性的、最成功的应用,特别是18F-FDG PET/CT的普及,18F标记HER2显像探针自然会成为重要的研究方向。在前期工作的基础上,Xavier等[48]采取最常用的18F标记辅基18F-SFB与纳米抗体2Rs15d偶联的方法,制备得到HER2显像探针18F-FB-2Rs15d,开展了其体内生物分布和肿瘤显像研究。18F-FB-2Rs15d的放射化学产率为5%~15%(衰变校正之后),比活度为(24.7±8.2)MBq/nmol。体内生物分布和PET/CT显像实验表明,该探针肾脏清除快,在HER2阳性肿瘤内高特异度积聚,注射1和3 h后肿瘤摄取分别为(25.94±1.17)和(3.74±0.52)%ID/g,进而获得高对比度的肿瘤图像(图10)。与此同时,Vaidyanathan等[47]报道了18F标记另一种HER2靶向纳米抗体5F7的临床前评价研究,研究者利用两种18F标记方法,即两种辅基18F-SFB和18F-RL-I分别与5F7偶联,制备对应的PET显像探针18F-FB-5F7和18F-RL-I-5F7,评价其体内外生物学性质和显像效果。实验结果表明,18F-RL-I-5F7在HER2阳性细胞中内化程度高于18F-FB-5F7,注射1和2 h后前者在BT474M1肿瘤内摄取值分别为(28.97±3.88)和(36.28±14.1)%ID/g,显著高于后者,然而,前者在肾脏内分布是后者的28~36倍。同时,18F-RL-I-5F7 PET/CT可以清晰显像HER2阳性肿瘤,并能被TzAb阻断,说明其HER2特异性(图10)。

图10 18F-FB-2Rs15d和18F-RL-I-5F7结构和肿瘤模型PET/CT显像
3 结论和展望
核素分子影像即SPECT/CT和PET/CT显像在肿瘤精准诊断和治疗中的作用越来越重要。因此,本文综述了核素标记HER2完整抗体和纳米抗体的分子影像探针及其HER2阳性肿瘤SPECT/CT和PET/CT显像的研究进展。HER2抗体TzAb和PzAb均是成功的临床药物,临床上体内HER2表达显像的需求非常明确,与之相应,核素标记TzAb和PzAb开始较早,有关的SPECT/CT和PET/CT显像的临床试验较多,临床应用前景很好。特别是随着半衰期较长的新型正电子核素64Cu和89Zr的出现,更加有利于基于HER2抗体的PET/CT显像的临床转化研究和应用。然而,其最佳肿瘤显像时间是注射后3~5 d,这是其主要的局限性。与之相比,基于纳米抗体的药物尚处于临床试验和初期应用阶段,相应的核素标记HER2纳米抗体的研究起步较晚。由于相对分子质量小、血液清除快,核素标记HER2纳米抗体具有注射后“1 d内”及时显像的特别优势,因此其临床前和临床研究的进展较快,均已取得积极的结果。需要指出的是,HER2纳米抗体的生物半衰期与核素68Ga和18F的物理半衰期较为匹配,再加上PET/CT显像的固有优势,68Ga和18F标记HER2纳米抗体的研究越来越受到关注。总的来说,核素标记HER2完整抗体和纳米抗体均已呈现出很好的应用前景,将为临床上在体内检测HER2表达提供有效的核素显像探针。
