肾衰灵方作用于SHH信号通路对UUO大鼠肾间质纤维化的影响*
2020-11-25熊维建丁伟森
骆 言,刘 洪,黎 颖**,宋 娜,熊维建,张 玲,丁伟森
(1. 重庆市中医院肾病科 重庆 400021;2. 重庆市中医院肿瘤科 重庆 400021)
目前慢性肾脏病(Chronic kidney disease,CKD)全球发病率约为10%-15%,如何防治CKD 已成为全球医疗系统需面临的巨大挑战[1-2]。肾间质纤维化(Renal interstitial fibrosis,RIF)是各种CKD 进展到终末期肾病的共同途径和病理特征,如何减轻RIF 对于延缓CKD 进程具有重要意义[3]。根据我科多年临床经验结合国医大师郑新中医理论及有效医案3000 余份总结[5],肾衰灵方在临床治疗慢性肾脏病效果显著。肾衰灵方治疗慢性肾衰的作用靶点及作用机制需要进一步研究论证。
近年研究发现音猬因子(Sonic hedgehog,SHH)信号通路在RIF 中发挥重要作用[6-10]。本实验采用单侧输尿管梗阻(Unilateral ureterul obstruction,UUO)大鼠模型模拟RIF,观察在肾衰灵方作用下,RIF 的病理变化以及SHH 信号通路中SHH、神经胶质瘤相关癌基因同源蛋白-1(Glioma related cancer gene homologous proteins 1,Gli1)、锌指转录因子(Snail Family Zinc Finger 1,Snai1)蛋白表达水平,探讨肾衰灵方通过抑制SHH信号通路改善RIF的作用机制。
1 材料与方法
1.1 动物及细胞
SPF 级 雄 性 SD 大 鼠 共 80 只 ,7 周 龄 ,体 质 量(200±20)g,购自重庆医科大学动物实验中心,动物许可证号:SCXK:2012-0001。
1.2 实验药物
肾衰灵方由中药饮片大黄、党参、黄芪、生龙牡、红花、菌灵芝、当归、丹参,淫羊藿,蒲公英等组成,经高压灭菌密封制成(浓缩为含生药1.2 g·mL-1)。本课题组用于研究的肾衰灵方由上诉饮片组成,由重庆市中药研究所加工而成。
1.3 试剂及仪器
兔抗鼠SHH 多克隆抗体(武汉博士德生物工程有限公司),兔抗鼠Gli1 多克隆抗体(美国Santa Cruz Biotechnology 公司),鼠抗人GAPDH 单克隆抗体(美国Affinity Biosciences 公司),兔抗鼠Snail单克隆抗体(英国Abcam 公司),大鼠结缔生长因子(CTGF)PCR 试剂盒,ECL 发光试剂盒(碧云天生物科技有限公司),PVDF膜(美国Millipore公司),引物及GAPDH(上海生工生物有限公司)。AU400 全自动生化分析仪(日本OLYMPUS 公司);BX51T-PHD-J11 型显微镜(日本OLYMPUS 公司);80-2 型低速离心机(上海手术器械厂);图像采集系统CMOS(日本OLYMPUS 公司),Image-Pro Plus(美国Media Cybernetics公司)等。
1.4 大鼠分组和造模
1.4.1 分组
SPF 级雄性SD 大鼠,采用随机数字表法将50 只SD 大鼠随机分为5 组:假手术组、模型组、肾衰灵方低剂量组、肾衰灵方中剂量组、肾衰灵方高剂量组,每组10只。假手术组模型制备:大鼠经10%水合氯醛麻醉后,采用左侧背部切开腹腔,钝性分离左侧输尿管,再分层缝合关闭腹腔。UUO 模型制备:大鼠经10%水合氯醛麻醉后,采用左侧腹部切开腹腔,钝性分离左侧输尿管,于中上1/3 处以4-0 线双重结扎后切断输尿管,分层缝合关闭腹腔。肾衰灵组将UUO模型大鼠按照《实验药理学》换算大鼠用药量,低中高剂量组分别予以 5 mg·kg-1,15 mg·kg-1,25 mg·kg-1剂量进行灌胃,分别相当于成人临床剂量5 倍、10 倍、15 倍,持续治疗14天。假手术组及模型组予以蒸馏水按15 mg·kg-1剂量进行灌胃。
根据结果选取肾衰灵疗效最佳剂量组,再次采用随机数字表法将30 只SD 大鼠随机分为3 组:假手术组、模型组、肾衰灵方组,每组10只。
1.4.2 血液生化指标检测
造模治疗14天后,禁食禁水12 h,腹腔注射10%水合氯醛麻醉,心脏取血,常温静置1 h,3 500 r·min-1离心5 min,取上清液以备用,根据全自动生化分析仪测定血清血清尿素氮(BUN),肌酐(SCr),谷丙转氨酶(ALT),谷草转氨酶(AST),碱性磷酸酶(ALP),乳酸脱氢酶(LDH)含量。
1.4.3 Masson染色观察胶原纤维沉积
石蜡切片后按试剂说明行马松(Masson)染色,脱水、透明,中性树胶封片,观察肾组织病理学改变。400倍光镜下,每张切片随机选择10个不重叠视野,细纤维呈红色,胶原纤维呈蓝色,用Image-Pro Plus 6.0图像分析软件测定其阳性(蓝色)区域面积与该视野下总面积(除去肾小管管腔),以二者百分比计算肾间质胶原纤维沉积率。
1.4.4 Real-time PCR 检测CTGF的表达
将Trizol法提取的组织RNA用紫外分光光度计测定浓度后,取2 μg 总RNA 进行逆转录。采用DNA Engine OpticonTM实时荧光定量 PCR 仪以 20 μL 反应体系进行PCR 扩增,以β-Actin 为内参照。采用RESTXL 软件作基因表达的相对定量分析。引物如下:CTGF-F:5’-CGT ACC ATA TGT TCT GAC AG-3’,CTGF-R:5’-GAA AGA CAG GTA CTA GCT GA-3’;β-Actin-F:5’-CCGTAAAGACCTCTATGCCAACA-3’,β-Actin-R:5’-GCTAGGAGCCAGGGCAGTAATC-3’。
1.4.5 免疫印迹试验(Western blot)检测各组大鼠肾组织SHH、Gli1、Snail蛋白表达情况
根据血清学指标及Masson 染色结果,我们选择治疗效果最佳的肾衰灵组继续行WB实验。提取肾组织蛋白,蛋白定量后上样、电泳、转膜,分别加入I 抗(1∶1 000),摇床4℃孵育过夜,加 II 抗(1∶2 000),37℃孵育 120 min,ECL 显色,暗室曝光成像,采用Image J 图像分析灰度值,计算目的蛋白和GAPDH 条带吸光值的比值反应目的蛋白的表达水平。
1.5 统计学分析
采用SPSS 17.0 统计软件进行数据分析。计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 血清学指标含量
肾功能:与假手术组比较,模型组和肾衰灵各剂量组SCr 和BUN 水平均明显升高(P<0.05);与模型组相比,肾衰灵各剂量组SCr和BUN水平均明显降低,其中肾衰灵中剂量组SCr和BUN水平最低(P<0.05)。
肝功能:各组间ALT、AST、ALP、LDH 水平无显著差异(P>0.05),提示肾衰灵各剂量组安全性良好。(见表1)。
2.2 肾组织解剖观察
假手术组肾脏大小正常,暗红色质软;模型组左侧肾脏明显肿胀增大,暗褐色,包膜紧张,切开内可见浑浊积液,肾盂肾盏扩张变形,肾皮质较正常组明显变薄;肾衰灵高、中、低剂量组肾脏肿胀,暗褐色,肾皮质较模型组稍厚。
2.3 Masson染色观察肾组织纤维化
Masson 染色后结果显示假手术组大鼠肾小球基底膜、系膜、及小管周围间质仅有少量间质胶原沉积,模型组肾小球数量明显减少、肾小球严重萎缩,炎性细胞弥漫浸润,大量间质胶原纤维环状沉积于肾小球上皮组织、基底膜区等,提示模型组大鼠肾间质纤维化明显,肾衰灵方治疗组,肾间质胶原沉积较模型组明显减轻,提示肾间质纤维化明显改善。在200 倍镜下随机选取5 个不相重叠的肾小管间质视野,分别测量每个视野中肾小管间质纤维化的相对面积,取平均值进行半定量分析,计算肾间质胶原纤维沉积率,结果显示,与假手术组相比(0.54±0.04),模型组(8.57±1.49),肾衰灵低剂量组(3.95±0.92),肾衰灵中剂量组(2.67±0.54),肾衰灵高剂量组(3.05±1.04),与假手术组相比,其余各组胶原纤维沉积率明显增高(P<0.01)。与模型组相比,肾衰灵高中低组胶原纤维沉积率明显降低(P<0.01),其中肾衰灵中剂量组效果最佳(图1)。
2.4 real-time PCR检测CTGF表达情况
与假手术组比较,模型组CTGF mRNA 表达显著上调(P<0.01),与模型组比较,肾衰灵方高、中、低剂量组中CTGF mRNA 表达显著下降(P<0.01),与高剂量组及低剂量组比较,中剂量组CTGFmRNA表达显著下调(P<0.05),见表2。
2.5 Western blot 检测各组大鼠肾组织SHH、Gli1、Snail蛋白表达情况
根据血清学指标及Masson 染色结果,我们选择肾衰灵中剂量组进一步检测SHH 及其下游信号分子蛋白表达水平。Western blot 结果显示,与假手术组比较,模型组肾组织内SHH,Gli1,Snail 蛋白的表达较假手术组显著增强(P<0.05),与模型组比较,肾衰灵组肾组织中SHH,Gli1,Snail 蛋白的表达明显下降(P<0.05)(图2,表3)。
3 讨论
肾衰灵方是国医大师郑新在临证60 余载经验效方,郑老精通中医四大经典,融古通今,善于运用健脾补肾、活血化瘀、搜风通络等方法治疗肾脏相关疾病。郑老认为脾肾亏虚为起病之本,故治疗肾脏疾病多采用补益脾肾为基础。慢性肾脏病病程较长,患者脾胃亏虚,故口服药物吸收欠佳,郑老根据脏腑理论为基础,总结出脏病治腑,泻腑以补脏,即六腑以通为补。肾衰灵方以大黄为君药,通腑泻浊,活血化瘀,龙骨、牡蛎收敛固涩,与大黄配伍散中有收,防止大黄泻下伤正,另外慢性肾脏病久病体虚,一味攻伐忽视其本虚,或可取一时之效,疗效难以持续,日久反使正气更虚,故方中加党参、黄芪、菌灵芝补气扶正以化生气血,淫羊藿补益肾阳,红花、当归、丹参活血养血,蒲公英苦以开泄,利湿散结,为引经之药。本方充分反映了郑老重视脾肾、益气养血、活血化瘀的治疗法则。肾衰灵方保留灌肠在临床治疗慢性肾脏病效果极佳,可明显延缓慢性肾脏病患者进入血液透析治疗,提高患者生活质量。临床上,SCr 及BUN 通常被称作肾功能排毒不佳的标志,可根据SCr 及BUN 对慢性肾脏病患者进行临床分期,是评估慢性肾脏病发病及发展最简单有效的经典指标。课题组临床中根据患者血清检验可测得运用肾衰灵方灌肠治疗一个疗程的患者血清中SCr及BUN可得到明显下降。根据本实验结果显示,假手术组大鼠血清中SCr及BUN正常,说明假手术组大鼠肾功能正常未受假手术影响。UUO 大鼠模型组血清中SCr 及BUN 明显升高,提示肾间质纤维化大鼠肾功能受到明显损害,模型大鼠造模成功,而肾衰灵方组大鼠血清中的SCr 及BUN 明显降低,能降低模型大鼠血清中SCr 及BUN,提示肾衰灵方对模型大鼠肾脏功能有保护作用,能有效地降低模型大鼠血清中的肾衰指数。
表1 各组大鼠SCr、BUN含量比较(,n=10)

表1 各组大鼠SCr、BUN含量比较(,n=10)
注:*P<0.05与假手术组比较,#P<0.05与模型组比较,△P>0.05与假手术组比较。
LDH/U·L-1 181.33±12.79 174.67±13.94△173.67±845△170±8.81△170.83±12.79△组别假手术组模型组肾衰灵低剂量组肾衰灵中剂量组肾衰灵高剂量组Crea/μmol·L-1 34.11±2.23 52.82±9.13*42.63±8.12#40.30±8.01#43.30±8.61*#BUN/mmol·L-1 4.41±0.69 7.35±1.62*5.68±0.96*#5.27±0.44*#6.10±1.44*#ALT/U·L-1 261.17±40.33 265.5±30.93△260±41.53△255.17±38.03△279.17±32.34△AST/U·L-1 79.17±8.38 74.17±11.72△69.83±8.89△77±10.26△75.5±9.57△ALP/U·L-1 132.5±17.22 140.5±11.61△136±16.57△134.5±17.04△135.67±21.29△

图1 各组大鼠肾脏组织Masson染色(×200)
表2 肾衰灵方对各组大鼠肾组织CTGFmRNA表达的影响(,n=10)
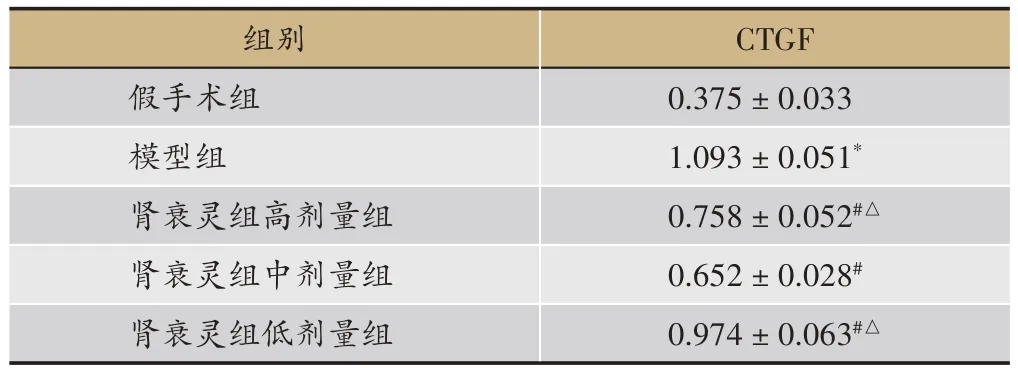
表2 肾衰灵方对各组大鼠肾组织CTGFmRNA表达的影响(,n=10)
注:*P <0.01 与假手术组比较,#P <0.01 与模型组比较,与肾衰灵方中剂量比较△P<0.05。
CTGF 0.375±0.033 1.093±0.051*0.758±0.052#△0.652±0.028#0.974±0.063#△组别假手术组模型组肾衰灵组高剂量组肾衰灵组中剂量组肾衰灵组低剂量组

图2 Western Blot测得各组大鼠肾组织中SHH,Gli1,Snai1蛋白表达
表3 各组大鼠肾组织SHH、Gli1、Snai1蛋白表达情况(,n=10)
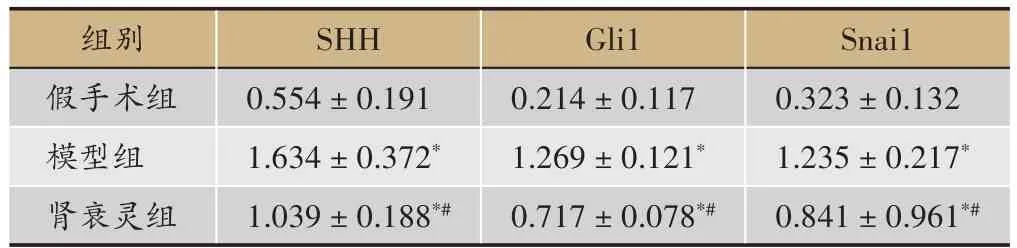
表3 各组大鼠肾组织SHH、Gli1、Snai1蛋白表达情况(,n=10)
注:*P<0.05与假手术组比较,#P<0.05与模型组比较。
Snai1 0.323±0.132 1.235±0.217*0.841±0.961*#组别假手术组模型组肾衰灵组SHH 0.554±0.191 1.634±0.372*1.039±0.188*#Gli1 0.214±0.117 1.269±0.121*0.717±0.078*#
临床上慢性肾脏病肾组织解剖相对较少,彩超等检查可见肾组织皮质变薄。模型大鼠肾组织解剖观察可见:假手术组肾脏大小正常,暗红色质软;而模型组左侧肾脏明显肿胀,暗褐色,包膜紧张,切开内可见浑浊积液,肾盂肾盏扩张变形,肾皮质较正常组明显变薄,提示肾间质纤维化模型大鼠造模成功;而肾衰灵组肾脏肿胀,暗褐色,肾皮质较模型组稍厚提示在运用肾衰灵方作用的模型大鼠肾组织损伤有所缓解,提示肾脏疾病进程较模型大鼠有所减缓。肾脏Masson 染色中显示肾小球数量明显减少、肾小球严重萎缩,炎性细胞弥漫浸润,大量间质胶原纤维环状沉积于肾小球上皮组织、基底膜区等,提示模型组大鼠肾间质纤维化明显,肾衰灵方治疗各组肾间质胶原沉积较模型组明显减轻,提示肾间质纤维化明显改善。从微观角度证明造模成功,另外肾衰灵方可以改善模型大鼠肾功能,改善模型大鼠肾间质纤维化情况,根据血清学及病理学评估肾衰灵方中剂量组效果最佳。通过肝功相关指标检测,提示肾衰灵方安全性良好,不会引起肝功能异常。
肾间质纤维化(Renal interstitial fibrosis,RIF)是各种慢性肾脏病进展到终末期肾病的共同途径和病理特征,在此过程中有效肾单位逐渐丧失、肾功能进行性下降。研究证实RIF严重程度与肾功能下降程度密切相关,是一项决定预后的有效指标。研究提示,结缔生长因子(Connective tissue growth factor,CTGF)是一种可刺激成纤维细胞增殖和分泌胶原蛋白的生长因子,在RIF进程中发挥重要作用[12-14]。CTGF的检测,可以看出肾衰灵方各剂量组相较模型组大鼠均有治疗作用,其中中剂量组大鼠CTGF 的表达最低,提示纤维细胞增殖相对受到抑制。另有研究发现在各种原因所致慢性肾脏病(Chronic kidney disease,CKD)患者中SHH 在肾小管上皮细胞表达明显上调;这一结果在各种大鼠肾纤维化模型中也被证实,这提示SHH 信号通路激活是各种肾脏疾病的共同病理结果[15]。经典SHH 信号通路活化途径为SHH 经过自动的催化裂解后与细胞膜受体跨膜蛋白Patched(Ptch)结合,解除对Smoothened(SMO)的抑制,SMO 解除了 Gli1 磷酸化等过程,从而使Gli1 以全长形式入核启动对靶基因的转录[16],其中Gli1 是SHH 信号通路的重要的多功能转录因子,其激活使反应SHH 信号通路活性的可靠指标。SHH-Gli1 通路通过促进细胞增殖参与RIF 发生发展[17-18]。通过大鼠基因敲除Gli1-LacZ 揭示SHH-Gli1通路是肾纤维化必不可少的信号通路[19]。研究表明Snai1 具有介导细胞间充质转化(Epithelialmesenchymal transition,EMT)的作用,广泛参与发育、肿瘤、纤维化过程[20]。EMT 是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,研究表明EMT 在RIF 的发病机制中同样起到关键作用[21-24]。最近研究发现SHH/Gli1 通路可诱导转录因子Snai1 的表达[25],国外学者研究发现活化SHH/Gli1 可通过调控转录因子Snai1表达,精密调控EMT 的发生[26-27]。由此可假设SHH-Gli1-Snai1 信号通路是肾组织在EMT 过程中导致RIF 的信号通路。综上,若阻断SHH 信号通路,则SHH 的表达下降,则下游信号通路分子Gli1 及Snai1也会随之下降。据此,我们假设肾衰灵方阻止肾脏细胞纤维化是通过阻断SHH 信号通路实现的,故设计本次三组对照实验。模型组SHH、Gli1、Snai1 蛋白表达显著升高,提示肾间质纤维化指标明显升高,提示模型组大鼠肾间质纤维化明显。且可能是大鼠肾间质纤维化的信号通路。而肾衰灵方组中SHH、Gli1、Snai1蛋白表达显著降低,提示肾衰灵方能降低肾间质纤维化SHH、Gli1、Snai1 蛋白指标的表达,提示肾衰灵方可能通过抑制SHH、Gli1、Snai1 的表达从而抑制肾间质纤维化。而SHH、Gli1、Snai1 蛋白的表达上升与下降方向明显相同,提示SHH-Gli1-Snai1信号通路存在,肾衰灵方对模型大鼠纤维化指标改善明显,提示肾衰灵方可能作用于SHH-Gli1-Snai1 三种蛋白构成的信号通路有明显的抑制作用。综上所述,肾衰灵方可能通过抑制SHH-Gli1-Snai1 信号通路阻断EMT 抑制肾脏RIF。根据此,我们将开展细胞实验,将肾衰灵含药血清作用于肾间质纤维化细胞,进一步深入研究肾衰灵方对肾脏细胞纤维化的作用机制。
