铁掺杂的介孔氧化硅复合物催化酮经贝克曼重排一步转化合成酰胺
2020-11-24陈婷婷洪欣悦冯是燕张祖磊
陈婷婷,洪欣悦,冯是燕,李 雯,张祖磊
(1.浙江省化工高效制造技术重点实验室,浙江大学 化学工程与生物工程学院,浙江 杭州310027;2.嘉兴学院 生物与化学工程学院,浙江 嘉兴314001)
1 前 言
酰胺化合物存在于许多常用的天然产物和工业用料中,是一类非常重要的有机化合物[1]。其中,N-苯基苯甲酰胺是制备农药如杀虫剂、植物生长调节剂等的原料,在香料及医药方面也有较为广泛的应用。在工业上,N-苯基苯甲酰胺主要是由苯胺与苯甲酸反应而得,反应温度超过200℃,且反应后处理过程较为复杂。
1886年德国化学家恩斯特·奥托·贝克曼(Ernst Otto Beckmann)[2]首次发现肟作为起始原料可合成酰胺,其后人们将该反应命名为Beckmann 重排反应。由于反应的原子经济性较高,Beckmann 重排反应一直是合成酰胺的首选方法之一。许多研究者将Beckmann 重排反应用于制备N-苯基苯甲酰胺,最开始使用液体酸如浓H2SO4、PCl5、P2O5等作为催化剂,但这些催化剂具有强酸性、强腐蚀性等特点,对设备的要求较高。其后通过对液体酸催化剂进行优化改性,反应的产率有所提高。Mahajan 等[3]使用FeCl3.6H2O一步无溶剂法催化二苯甲酮与NH2OH.HCl 发生Beckmann 重排反应生成N-苯基苯甲酰胺,研究发现在130℃下反应60 min 后,N-苯基苯甲酰胺的产率高达92%。此外,还探究了FeCl3.6H2O对其他酮类化合物的催化效果,结果显示产率大多在85%以上。Aricò等[4]使用三氟乙酸在NH2OH.HCl 条件下一步法催化酮或醛类化合物发生Beckmann 重排反应生成相应的酰胺,研究发现反应的转化率及选择性与酮或醛类化合物取代基的位阻效应密切相关。由于使用液体酸催化剂,产物不易分离。人们开始寻找优良的固体酸催化剂来代替液体酸催化剂,起先使用了一些单组分氧化物如B2O3、SiO2等,但这些氧化物容易失活。后来人们把目标放在多组分氧化物上,Jain 等[5]使用Fe2O3/SiO2核壳结构催化剂催化酮或醛类化合物发生Beckmann 重排反应,研究发现二苯甲酮与NH2OH.HCl 在该催化剂作用下反应23 h 后,产物N-苯基苯甲酰胺的产率为85%。
随着对该反应的进一步探索,发现部分反应的后处理过程较为复杂,反应条件苛刻,催化剂不易回收利用等问题。为了寻找一个温和、高效的催化体系,本文制备了铁掺杂介孔氧化硅复合物,并对其进行了一系列的表征。以二苯甲酮及盐酸羟胺为原料以铁掺杂介孔氧化硅复合物作为催化剂采用一步无溶剂法制备了N-苯基苯甲酰胺。重点考察该催化剂的催化性能,并优化了催化反应的各项参数,如催化剂用量、催化反应温度以及反应时间。在优化条件下,研究了催化剂对各种酮类化合物的普适性。
2 实验部分
2.1 实验材料与仪器
主要试剂:盐酸羟胺(分析纯,广东福耀试剂公司);二苯甲酮、1-茚酮(分析纯,上海达瑞精细化学品有限公司);亚苄基丙酮、苯乙酮、对甲氧基苯乙酮、对硝基苯乙酮、4-氨基苯乙酮、正硅酸乙酯(分析纯,国药集团化学试剂有限公司);间硝基苯乙酮、间溴苯乙酮、邻甲基苯乙酮(分析纯,上海凌峰试剂有限公司);苯丙酮、邻氯苯乙酮、P123(分子量5 750 g.mol-1)、二氧化硅、Fe(NO3)3.9H2O、乙二醇(分析纯,上海阿拉丁试剂有限公司)。
主要仪器:旋转蒸发器(上海亚荣生化仪器厂),真空干燥箱(上海森信实验仪器有限公司),磁力搅拌器(上海思乐仪器有限公司),扫描电镜(日本日立公司),透射电子显微镜(日本电子公司),傅里叶红外光谱仪(美国热电公司),X 射线光电子能谱仪(美国Thermo Fisher 公司),紫外分析仪ZF-7(上海嘉鹏科技有限公司)。
2.2 催化剂制备
称取一定量的三嵌段共聚物P123(聚环氧乙烷-聚环氧丙烷-聚环氧乙烷)溶解于适量的2.0 mol.L-1HCl溶液和去离子水中,加入磁子。在水浴温度40℃下搅拌3 h,其后在1 h 内边搅拌边滴加交联剂正硅酸乙酯(TEOS),滴完后继续搅拌24 h,然后将得到的凝胶倒入反应釜,在80℃下老化24 h。待反应结束后,使用抽滤装置抽滤冷却后的产物,用无水乙醇和去离子水多次洗涤产物。真空干燥后,用甲醇:水=4:1(体积比)的混合液去除模板剂,再一次真空干燥得到白色粉末介孔材料MSNs。
称取一定量的MSNs和0.6 g Fe(NO3)3.9H2O溶解于20 mL无水乙醇中搅拌过夜,在60℃下烘干,除去无水乙醇得到黄色固体,然后向黄色固体中逐滴加入2.0 mL 乙二醇,湿固体置于管式炉中在400℃加热2 h(氮气保护,5.0℃.min-1),然后用大量乙醇洗涤,80℃真空干燥后合成铁掺杂介孔复合材料m-MSNs。
2.3 催化剂表征
对制备的新型介孔复合催化剂的结构进行一系列的表征,分析表征如下:a.用红外光谱(FT-IR)分析催化剂的官能团和结构;b.用热失重曲线(TG)分析催化剂的热稳定性;c.用X-射线衍射光谱(XRD)分析催化剂的晶型结果;d.用X-射线光电子能谱(XPS)分析催化剂的表面组成;e.用氮气吸附-脱附等温线分析催化剂的比表面和孔径分布;f.用磁滞回线表征催化剂的磁饱和强度;g.用透射电镜(TEM)和扫描电镜(SEM)观察催化剂的表面形貌;h.重复使用6次考察催化剂再生性能。
2.4 催化剂催化效果
以制备的m-MSNs作为催化剂探索了催化剂的用量、反应温度和反应时间对催化效果的影响,得到优化条件。此外,进一步探究了该催化剂在优化条件下催化不同底物的催化效果,使用二氯甲烷作为流动相,通过薄层层析分离产物,计算产物的产率,并对结果进行分析。
3 实验结果与讨论
3.1 催化剂结构表征
3.1.1红外光谱(FT-IR)
图1(a)是介孔材料MSNs和铁掺杂介孔复合催化剂m-MSNs的红外光谱图。从图中可以看到,m-MSNs在波数580 cm-1处有一个明显的特征吸收峰,而这个特征吸收峰归属于Fe─O的特征吸收峰,说明铁掺杂是成功的。另外,在1 640 cm-1处两种物质都有归属于Si─O─Si 的特征吸收峰,表明铁掺杂并不会破坏材料的介孔结构。

图1 介孔材料MSNs 和m-MSNs的表征图Fig.1 Characterization results of mesoporous materials MSNs and m-MSNs
3.1.2热失重曲线(TG)
从MSNs和m-MSNs的热失重曲线(图1(b))可见,随着温度的升高,失重增加,最后达到稳定。250℃以下的失重主要是材料表面结合水的蒸发,250~800℃的失重主要是未除干净的表面活性剂的分解。制备的MSNs只是在80℃下老化,未进行高温处理,而m-MSNs在进行铁掺杂时经400℃加热处理,因而铁掺杂以后的介孔复合材料具有更高的热稳定性,这和失重曲线结果一致。
3.1.3 X-射线衍射光谱(XRD)
从图1(c)的MSNs和m-MSNs的XRD衍射广角图中可见,位于24.9°处,两种材料都有一个很强的特征衍射峰,这个衍射峰主要归属于SiO2。另外,相比之下,在m-MSNs中可以看到Fe3O4的几个特征衍射峰(2θ=30.2°、35.6°、43.3°、45.5°和57.2°)[6-7],这些结果说明铁掺杂成功,同时制备过程中并没有破坏材料原来的介孔结构和成分。从MSNs和m-MSNs的XRD 衍射小角图(图1(d))中可以看出,两种材料中都存在3个反射峰分别指向(100)、(110)和(200)反射,说明两种材料均具有六方晶格排列的有序介孔结构。而在m-MSNs中,(110)和(200)反射明显减小,说明铁掺杂到介孔孔道后一定程度上降低了介孔的有序性,也进一步证实了铁掺杂成功。
3.1.4 X-射线光电子能谱(XPS)
为了探究MSNs和m-MSNs的表面化学成分,用X 射线光电子能谱对MSNs和m-MSNs材料进行表征,结果如图1(e)所示。两种材料的X 射线光电子能谱的谱图中都含有Si 和O的峰,说明SiO2是两种材料的主要成分。另外,在m-MSNs中还有Fe2p的特征峰,进一步说明了铁掺杂的成功。由图1(f)可知,Fe 的存在形式有3种:八面体Fe(II)、八面体Fe(III)和四面体Fe(III)。介孔复合材料的Fe(II)/Fe(III)的值为0.5,证实了介孔复合催化剂中存在Fe3O4[8-9]。
3.1.5氮气吸附-脱附等温线
图2(a)为MSNs和m-MSNs的氮气吸附-脱附等温线图。由图可知,两种材料的吸附等温线均是典型的IV 型等温线,此外还有H1磁滞回线,说明两种材料均为介孔结构。在相对压力p.p0-1=0.4~0.8,两种材料的吸附等温线均急剧增加,说明氮气产生毛细凝聚,可进一步说明m-MSNs为介孔结构。与MSNs相比,m-MSNs的吸附-脱附等温线在低相对压力位置就有拐点产生,原因是由于其孔径较大导致氮气毛细凝聚量增加。图2(b)是两种材料的孔径大小分布曲线图,从图中可以看出,两种材料的孔径范围主要在3~9 nm。由相关参数计算可得,MSNs 的比表面、孔径和孔容分别为624 m2.g-1、5.9 nm 和0.76 cm3.g-1。合成m-MSNs后比表面、孔径和孔容变为386 m2.g-1、7.2 nm 和0.48 cm3.g-1。MSNs合成m-MSNs后比表面积变小,孔径变大,孔容变小,可归因于高温条件下进行铁掺杂以后,介孔孔道内未去除干净的介孔模板剂得到了进一步去除而导致孔径变大,而后在介孔孔道内填充了Fe3O4,导致m-MSNs比表面积变小,孔容变小。
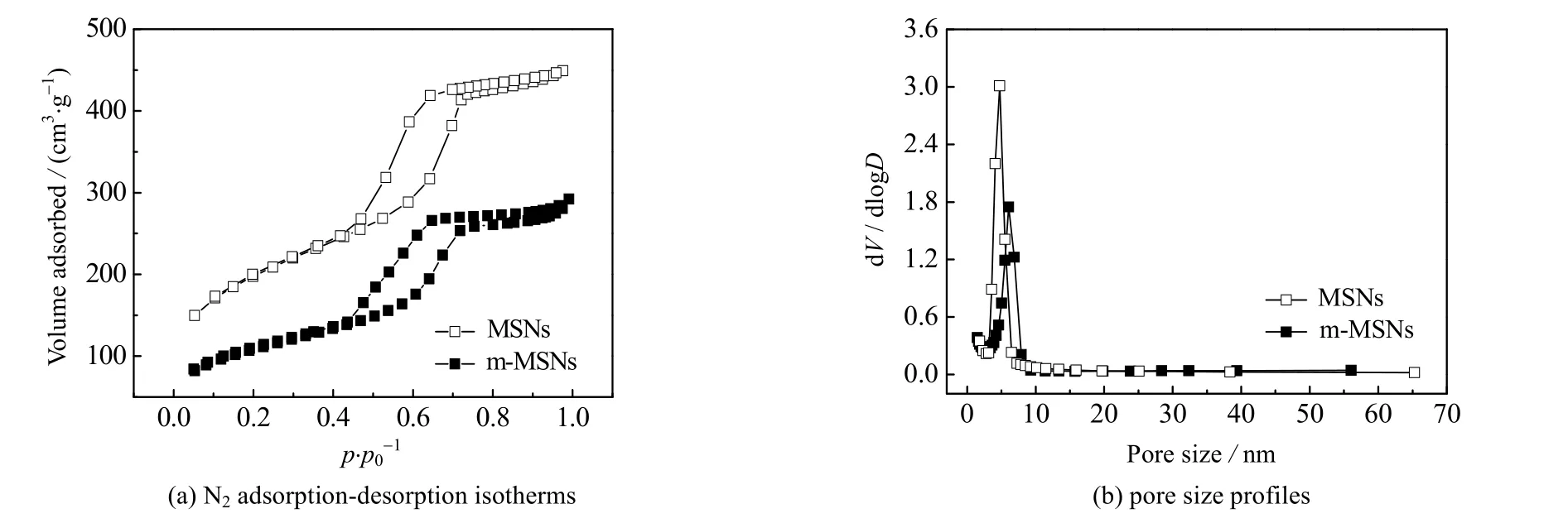
图2 MSNs 和m-MSNs的氮气吸附-脱附等温线和孔径分布图Fig.2 N2 adsorption-desorption isotherms and poresize profiles of MSNs and m-MSNs
3.1.6磁饱和强度测试
从磁滞回线图(图3)中可以发现m-MSNs的磁滞回线关于原点对称,说明m-MSNs具有超强的顺磁性。在298 K 下m-MSNs的磁饱和强度为4.48 emu.g-1,在外部磁场的作用下可快速分离介孔复合材料m-MSNs。内嵌图为悬浮在乙醇中的m-MSNs以及在外加磁场作用后的对比图片。由内嵌图可知,m-MSNs在30 s内就被成功分离。
3.1.7透射电镜(TEM)和扫描电镜(SEM)
MSNs和m-MSNs的扫描电镜和透射电镜照片如图4所示。从MSNs的扫描电镜照片图4(a)可以看出,MSNs与SBA-15的形貌非常相近。从透射电镜照片图4(b)可以看出,MSNs具有非常有序的介孔结构。对MSNs进行铁掺杂后从扫描电镜图4(c)可以看出表面形貌并没有太大变化,但从透射电镜图4(d)发现孔道内有很多Fe3O4的颗粒生成,表明铁掺杂是成功的。

图3 m-MSNs的磁滞回线;(内嵌图)悬浮在乙醇中(左)和在外加磁场作用下(右)分离m-MSNs 的图片Fig.3 Hysteresisloop of m-MSNs.Embedded:Pictures of m-MSNs suspended in alcohol (left)and separated under external magnetic field (right)

图4 MSNs 和m-MSNs 的扫描电镜和透射电镜图Fig.4 SEM and TEM micrographsof MSNs and m-MSNs
3.2 m-MSNs 催化性能研究
3.2.1催化反应式
以二苯甲酮为底物一步无溶剂法合成N-苯基苯甲酰胺的催化反应式和反应机理如图5所示,二苯甲酮与盐酸羟胺反应生成N-苯基苯甲酮肟,经Beckmann 重排进一步转化生成目标产物N-苯基苯甲酰胺。

图5 二苯甲酮为底物一步无溶剂法合成N-苯基苯甲酰胺Fig.5 One-step solvent-free synthesis of N-phenylbenzamide with benzophenoneas substrate
3.2.2 m-MSNs用量对产率的影响
以m-MSNs为催化剂,二苯甲酮为底物一步无溶剂法合成N-苯基苯甲酰胺,原料二苯甲酮2 mmol,盐酸羟胺3 mmol,在反应温度130℃、催化时间60 min 的条件下,探究m-MSNs用量分别为10、20、30、40、50、60 mg 时对反应的影响,结果如图6(a)所示。从图中结果可知当m-MSNs的用量处于10~40 mg,随着m-MSNs用量的增加,催化效果增强;当m-MSNs的用量处于40 mg 时,其催化效果最佳;当m-MSNs的用量大于40 mg 催化产率均高于90%。因此在获得最高效率的前提下本着催化剂用量适中的原则,下述研究均采用m-MSNs为40 mg 时考察反应温度和反应时间对催化反应的影响。
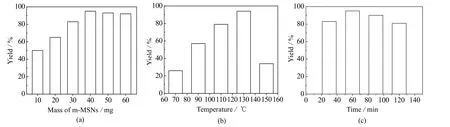
图6 N-苯基苯甲酰胺产率的影响因素Fig.6 Effects of different factorson N-phenylbenzamideyield
3.2.3催化反应温度对产率的影响
控制催化剂用量为40 mg,反应时间为60 min,探究反应温度为70、90、110、130、150℃对反应产率的影响,结果如图6(b)所示。从图中结果可知在70~130℃,m-MSNs的催化效果和反应温度呈正相关,随着反应温度的升高,催化效果逐渐显现。在130~150℃,m-MSNs的催化效果和反应温度呈负相关,随着反应温度的升高,催化效果不断降低。当反应温度为70℃时,N-苯基苯甲酰胺的产率只有26%;反应温度为90℃时,产率为57%;反应温度为110℃时,产率为79%;在反应温度为130℃时催化效果最好,产率达到94%;当反应温度为150℃时,产率为34%。秉承低温有利于降低能耗的原则,选择130℃为最优反应温度。
3.2.4催化反应时间对产率的影响
控制催化剂用量40 mg,反应温度130℃,探究反应时间为30、60、90、120 min 时对反应产率的影响,实验结果如图6(c)所示。在反应时间为30~60 min,产物的产率随着反应时间增加而增加;60~120 min,产物的产率随着反应时间的增加而降低。当反应时间为30 min 时,产率为83%;反应时间为60 min 时,产率最高为95%;反应时间为90 min 时,产率下降为90%;反应时间为120 min 时,产率为81%。秉承经济及效率的原则,选择最优催化时间为60 min。
3.2.5与其他催化剂的催化性能对比
选取了FeCl3.6H2O、AlCl3、NaHSO4.H2O、TiO2、UiO-66、MSNs和m-MSNs几种催化剂进行催化性能的对比,按照实验方法控制原料二苯甲酮2 mmol、盐酸羟胺3 mmol,采用无溶剂一步法合成相应的酰胺产物,反应温度为130℃,反应时间60 min,各种催化剂的用量为0.2 mmol,N-苯基苯甲酰胺的产率如图7所示。从图中结果可知,m-MSNs的催化性能明显优于MSNs,说明介孔孔道内引入Fe3O4大大提高了催化剂的催化效率。另外,m-MSNs的催化效果也要明显优于FeCl3.6H2O、AlCl3、NaHSO4.H2O等催化剂,进一步证实了铁掺杂介孔氧化硅催化剂的高效性。
3.2.6催化剂m-MSNs再生性能研究

图7 催化剂种类对Beckmann 重排反应产率的影响Fig.7 Effects of different catalysts on Beckmann rearrangement reaction yield

图8 催化剂m-MSNs的再生性能图Fig.8 Regeneration performanceof catalyst m-MSNs
进一步考察了催化剂m-MSNs的再生性能,催化反应结束后产物用二氯甲烷溶解,催化剂用磁铁进行磁性分离后用超纯水和无水乙醇洗涤,烘干待用。催化剂的再生结果如图8所示,6次再生后催化产率为70%左右。实验结果表明,6次再生使用后,催化剂m-MSNs仍具有一定的催化性能,是一类可循环使用的新型催化剂。另外,根据图7中MSNs和m-MSNs的催化效率的差异,说明m-MSNs再生后催化能力不断下降的原因可能在于m-MSNs在磁性分离、洗涤及再生过程中Fe3O4的不断流失。
3.2.7产物N-苯基苯甲酰胺的表征
对催化反应合成的产物N-苯基苯甲酰胺进行了熔点测定以及核磁共振1H 和13C表征。熔点测定结果显示产物的熔点为162.1~163.0℃,与文献值162~163℃基本一致。另外,从核磁共振谱图中可知产物的核磁共振1H 的化学位移分别为:δ= 7.09(t,J= 7.4 Hz,1H),7.33(t,J= 7.8 Hz,2H),7.48~7.61(m,3H),7.77(d,J= 8.0 Hz,2H),7.94(d,J=8.0 Hz,2H),10.25(s,1H);碳谱数据为13C NMR (100 MHz,DMSO-d6):δ=120.8(2C)、124.1、128.1(2C)、128.8(2C)、129.0(2C)、132.0、135.4、139.6、166.0。表征结果说明反应成功合成了目标产物N-苯基苯甲酰胺,进一步说明催化剂m-MSNs可催化二苯甲酮一步无溶剂法Beckmann 重排合成N-苯基苯甲酰胺。
3.2.8 m-MSNs对不同底物的适用性研究
为了考察催化剂m-MSNs对催化反应不同底物的适用性,除二苯甲酮外,另外选取了邻甲基苯乙酮、苯乙酮、对甲氧基苯乙酮等11种酮类化合物作为反应底物,研究m-MSNs的催化反应产率。实验结果列于表1。从表中数据可以看到,催化剂m-MSNs对二苯甲酮、邻甲基苯乙酮、苯乙酮、对甲氧基苯乙酮的催化产率均超过80%,而对其他底物的催化反应产率较低。
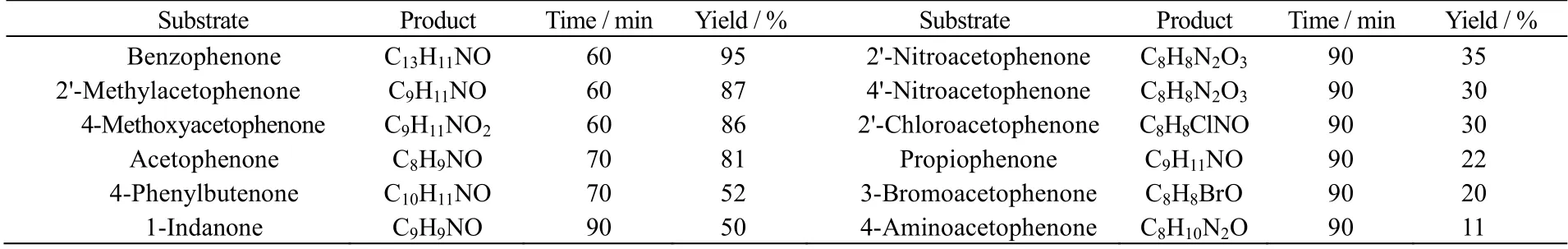
表1 不同反应底物的Beckmann 重排反应产率Table 1 Beckmann rearrangement yieldsof different reaction substrates
4 结 论
研究制备了一种铁掺杂的介孔复合催化剂m-MSNs,并对催化剂的形貌和结构进行了一系列的分析和表征,结果表明,铁掺杂成功并且掺杂过程中并未破坏材料的介孔结构。介孔复合催化剂的磁饱和强度为4.48 emu.g-1,在外部磁场的作用下可将其快速分离。将合成的介孔复合催化剂用于二苯甲酮一步无溶剂法催化合成N-苯基苯甲酰胺,结果表明在催化剂用量为40 mg、反应温度为130℃、反应时间为60 min时催化产率可达到95%。将制备的介孔复合催化剂m-MSNs用于不同底物的催化反应,考察催化剂对底物的普适性。结果表明,催化剂m-MSNs对二苯甲酮、邻甲基苯乙酮、苯乙酮、对甲氧基苯乙酮的催化产率均超过80%,对其他底物的反应产率较低。6次再生使用后,催化剂m-MSNs的催化产率仍能达到70%左右,说明所制备的介孔复合催化剂材料可以多次循环使用,是一类高效、绿色、并有潜在工业应用价值的催化剂。
