微生物菌剂对楸树幼苗生长及根际土细菌群落结构的影响
2020-11-24李金花高克祥曹国玉焦方园王延平田叶韩赵炳杰李传荣
李金花,高克祥,万 利,曹国玉,焦方园,王延平,田叶韩,赵炳杰,李传荣,*
1 泰山森林生态系统国家定位观测研究站,泰安 271018 2 黄河下游森林培育国家林业局重点实验室,泰安 271018 3 山东农业大学植物保护学院,泰安 271018 4 中国标准化研究院,北京 100191 5 烟台市林业局,烟台 264000
微生物是土壤环境的重要组成部分,参与调节了土壤生态系统中80%—90%的代谢过程,不仅是养分循环和转化的主要推动者,更是有机质形成和分解的主要参与者[1- 2],因而众多学者将微生物群落特征的变化作为评价土壤生态系统结构和功能的动态指标。在所有土壤微生物中细菌种类最为丰富,数量多且分布广,约占土壤微生物总量的70%—90%[3- 4]。其不仅在维持土壤生态系统稳定和提高土壤肥力方面发挥了重要作用[5],而且在促进植物生长、防治或减轻病虫害方面扮演着重要角色[4,6- 8]。土壤细菌对外界环境的干扰极为敏感[9],不同施肥模式[10]、施用微生物菌剂[6]、不同林下植被管理措施[11]等均会导致细菌群落结构发生大幅度变化,从而影响土壤生态系统的稳定性及功能发挥。可见,土壤细菌群落特征指标可用于评价土壤生态系统功能。
微生物菌剂是有益微生物菌群以某种多孔物质为载体加工制成的微生物活菌制剂,能够在土壤或基质中繁殖,形成有利于植物生长的优势菌群[12],其在一定程度上能改善土壤微生物区系及代谢活性,防治土传病害,对植物具有显著的促生作用。相关研究表明,施用芽孢杆菌、荧光假单胞杆菌、淡紫拟青霉等微生物菌剂能够显著促进烟草植株的生长,控制根结线虫的发病率,提高土壤微生物群落的多样性和对碳源的利用率[13]。王超等[14]的研究也表明,有机农田施用枯草芽孢杆菌菌肥可显著促进冬瓜体内营养成分的积累,改善冬瓜品质,提高土壤细菌群落的丰富度。另外由于微生物菌剂应用成本低、处理效果好、不会对环境造成污染,也已成为国内外退化生态系统恢复的主要研究内容[15- 16],特别是恢复模式的评价和选择。球毛壳(Chaetomiumglobosum)ND35微生物菌剂的活性菌株ND35是分离自健康毛白杨(Populustomentosa)内生优势菌株,具有广泛的拮抗活性,属子囊菌门、核菌纲、球壳目、黑孢壳科、毛壳菌属[17]。该菌株寄主范围广,定殖能力强,其菌丝在植物体内蔓延迅速,与植物形成互惠共生关系[18]。作为促生微生物菌剂,目前诸多研究报道了其对黄瓜、番茄、小麦等草本及禾本科植物的促生作用[19- 21],而关于其对乔木促生及根际土壤微生物群落的影响尚未引起足够的重视。
楸树(Catalpabungei)属紫葳科梓树属,是我国特有的珍贵用材和观赏树种,自古素有“木王”之美称。由于根系发达,常常作为固沙保土、护堤固岸的造林树种。目前研究多见于楸树种质资源、抗逆性、无性株系、良种壮苗配套技术等方面[22- 24],鲜有调控其根系生长环境方面的研究。本研究探讨施用球毛壳ND35微生物菌剂对楸树幼苗生长的影响,并采用高通量测序的方法分析其根际土壤微生物群落的响应,同时结合土壤肥力指标,探讨其对楸树的作用机理,旨在为楸树资源的可持续利用提供技术依据,为将其应用于困难立地和退化生态系统的植被恢复提供理论依据。
1 材料和方法
1.1 试验材料
该试验在山东农业大学林学实验站遮雨棚内进行。选择一年生粗细一致、无病虫害的楸树实生苗进行盆栽实验,培养基质为过2 mm筛的砂质土。其田间最大持水量为22.35%,有机质含量为9.99 g/kg,硝态氮64.93 mg/kg,氨态氮61.92 mg/kg,速效磷13.27 mg/kg,土壤pH为7.05。种植盆规格为高19.7 cm,外口径为29.4 cm,内口径为25.4 cm。为减少试验时花盆内水分及养分的流失,每个花盆下面都配有花盆托。试验所用微生物菌剂为山东农业大学植保学院高克祥教授实验室提供,其活性成分为球毛壳菌(Chaetomiumglobosum)ND35 菌株,孢子浓度约为6.01×107cfu/g。
1.2 试验设计
试验时基质灭菌,每盆栽植一株楸树实生苗,试验中球毛壳ND35微生物菌剂的用量为0、10、15、20 g/株,分别记为CK、T1、T2、T3,每处理10个重复。在试验进行120 d时,每个处理中随机选取6株楸树幼苗,测定株高、地径,之后整株收割用于生物量的测定。同时从中选取3株轻轻抖掉根系外围土,用毛刷轻轻刷粘附在根表面的土壤作为根际土,过2 mm筛后,一部分置于无菌的15 mL离心管中,用液氮罐保存带回实验室,用于细菌群落结构的测定;另一部分用自封袋带回实验室,风干过筛后用于土壤理化性质和土壤酶活的测定。
1.3 测试指标及方法
1.3.1土壤理化性质和酶活性的测定
土壤 pH 值用电极法测定,土壤悬浊液为水土质量比1∶2.5;土壤有机质采用重铬酸钾容量法测定;土壤氨态氮、硝态氮采用流动分析仪(AA- 3,德国)测定;土壤有效磷采用NaHCO3浸提-间断流化学分析仪(Smartchem 200,意大利AMS)测定。
土壤脲酶采用靛蓝比色法测定,蔗糖酶采用3,5-二硝基水杨酸比色法测定,碱性磷酸酶采用磷酸苯二钠法测定,过氧化氢酶采用高锰酸钾滴定法测定。
1.3.2土壤微生物基因组DNA的提取
采用CAT法提取样本基因组DNA[25],利用琼脂糖凝胶电泳检测提取DNA的纯度及浓度。取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL,置于冰箱-20℃保存。
1.3.3土壤细菌16S rDNA基因 PCR 扩增
以稀释后的基因组DNA为模板,用引物515F(5′-GTGCCAGCMGCCGCGG- 3′)和806R(5′-GGACTACHVGGGTWTCTA AT- 3′)[26]对V4-V5高变区进行PCR扩增。
PCR反应体系为:15 μL Phusion Master Mix(2×);3 μL Primer(2 μmol/L);10 μL Gdna(1 ng/μL);2 μL H2O。
PCR反应程序为:(1)在98℃下预变性1 min;(2)在98℃下变性10 s,50℃下退火30 s,72℃下延伸30 s,循环30次;(3)在72℃下继续延伸5 min。PCR产物用2%浓度的琼脂糖凝胶进行电泳检测,检测完毕后于4℃保存备用。
1.3.4土壤细菌 16S rDNA 基因测序
将PCR扩增产物送至北京诺禾致源生物信息科技有限公司利用Illumina Hiseq 2500平台进行高通量测序。
1.4 数据处理方法
使用Qiime软件(Version 1.9.1)进行Chao1指数、Shannon指数、Simpson指数、ACE指数的计算;应用SPSS 21.0软件对数据进行单因素方差分析(one way ANOVA)及Pearson相关性分析,以Duncan法则进行多重比较,显著水平P<0.05,极显著水平P<0.01;运用Canoco 5.0软件进行冗余分析(RDA)及主成分分析(PCA);采用Origin 2018作图。
2 结果分析
2.1 微生物菌剂ND35对楸树幼苗生长指标的影响
施用球毛壳ND35微生物菌剂可显著促进楸树幼苗的生长(图1),且不同施用量的作用效果不同。与CK相比,楸树幼苗的株高和地径在T1处理下分别显著提高25.37%和7.53%(P<0.05),地下生物量在T1和T2处理下显著提高40.41%和29.00%(P<0.05),地上生物量在3种菌剂施用量下均与CK差异显著(P<0.05),提高率为22.60%—41.74%。因此,球毛壳ND35菌剂在T2、T3施用量下对楸树幼苗的促生效果较为显著。

图1 不同处理下楸树的生长量指标Fig.1 The growth indices of Catalpa bungei under different treatments在同一指标图中,不同字母表示在 5%水平上差异显著(Duncan test);CK:不施微生物菌剂对照Unamended control;T1:施用10 g/株 ND35微生物菌剂ND35microbial agent was applied at 10 g/tree;T2:施用15 g/株 ND35微生物菌剂ND35microbial agent was applied at 15 g/tree;T3:施用20 g/株 ND35微生物菌剂ND35microbial agent was applied at 20 g/tree
2.2 微生物菌剂ND35对土壤酶活性与理化性质的影响
球毛壳ND35微生物菌剂的施用对土壤中脲酶、蔗糖酶、碱性磷酸酶活性有显著影响,对过氧化氢酶活性的影响不显著(表1)。脲酶活性随菌剂用量的增加呈先降低后上升趋势,其中T3中的脲酶活性较CK显著提高60.48%(P<0.05)。碱性磷酸酶、蔗糖酶均随菌剂用量的增加呈先上升后下降的趋势,其活性较CK分别提高57.44%—114.88%、13.03%—78.90%,T2中碱性磷酸酶、蔗糖酶活性与CK差异显著(P<0.05)。为了更好刻画菌剂施用对土壤质量的影响,参考García-Ruiz[27]的方法将土壤酶的几何平均数(Geometric Mean of Enzymes, GMea)作为评价土壤质量的酶活性指标。结果发现,T1、T2、T3处理下的GMea显著高于CK(P<0.05),且在T2处理下GMea有最大值。说明施用球毛壳ND35菌剂可显著提高土壤酶活性,这主要是由于土壤酶一般来自植物根系、微生物群落和动植物残体,其活性与外界环境变化密切相关。
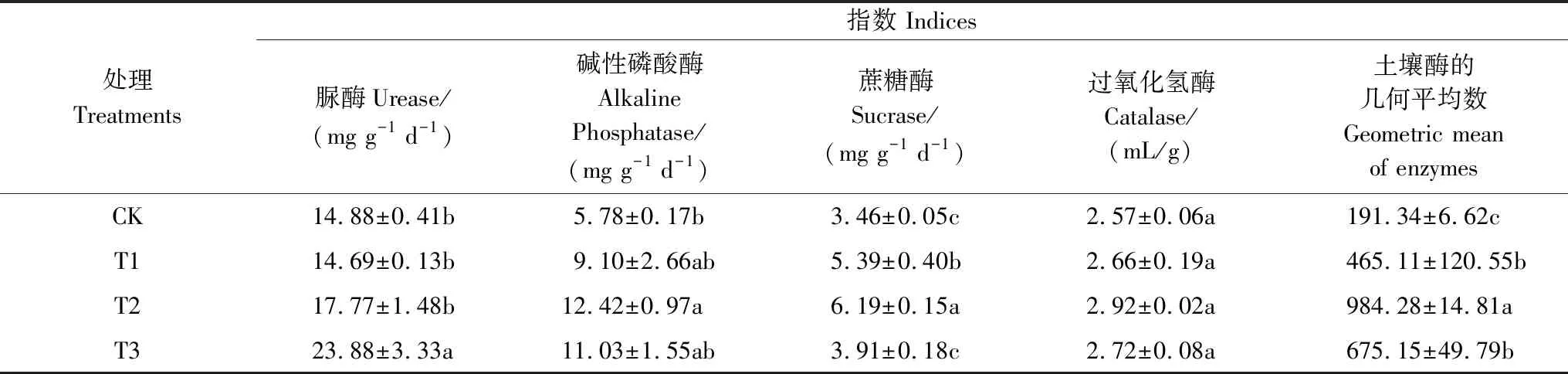
表1 不同处理土壤酶活性分析
菌剂的施用显著提高了土壤中有机质、铵态氮、硝态氮的含量(表2),对土壤速效磷含量影响不显著。与CK相比,球毛壳ND35微生物菌剂使土壤中有机质、铵态氮、硝态氮的含量分别提高35.61%—54.24%、25.00%—82.71%、13.04%—48.42%(P<0.05)。但不同用量处理之间,土壤有机质、铵态氮含量差异不显著,而硝态氮含量在T2、T3处理下显著高于T1处理(P<0.05)。菌剂处理下的土壤速效磷含量相比CK提高2.71%—7.35%,但不显著(P>0.05)。这一方面可能是由于微生物菌剂自身含有部分元素含量,另一方面可能是微生物作为土壤的重要组成部分,其代谢产物能够促进土壤中的养分循环。
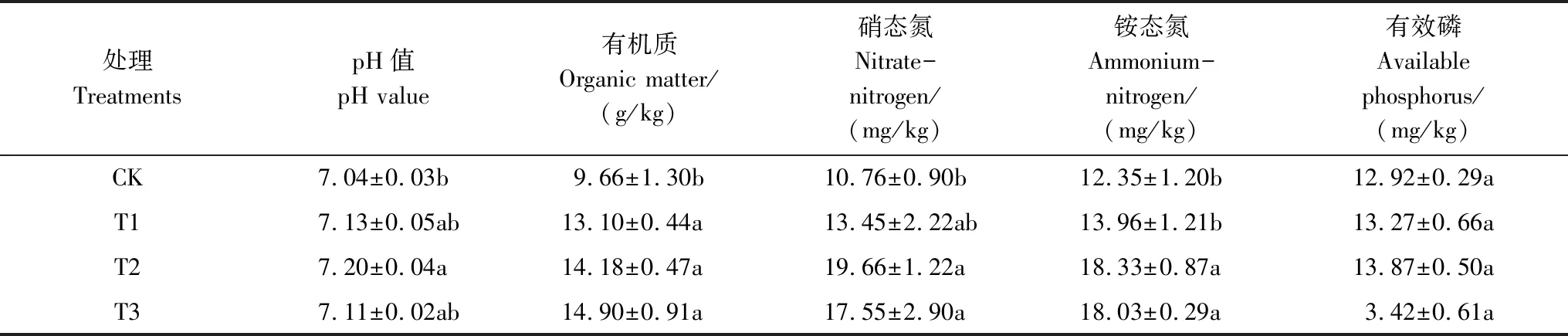
表2 不同处理土壤的pH和养分含量
2.3 微生物菌剂ND35对土壤细菌群落结构的影响
2.3.1土壤α多样性分析
施用球毛壳ND35微生物菌剂后,土壤样品的ACE、Chao1、Shannon及Simpson指数均随施用量的增加呈现先上升后下降的趋势(表3)。T1、T2、T3中细菌群落的多样性和丰富度指数均显著高于CK,尤其T2中的ACE、Chao1、Shannon、Simpson指标数值相比CK分别显著提高了19.83%、38.82%、4.62%、2.01%(P<0.05),说明球毛壳ND35菌剂的施用能显著提高土壤细菌群落的丰富度和多样性。
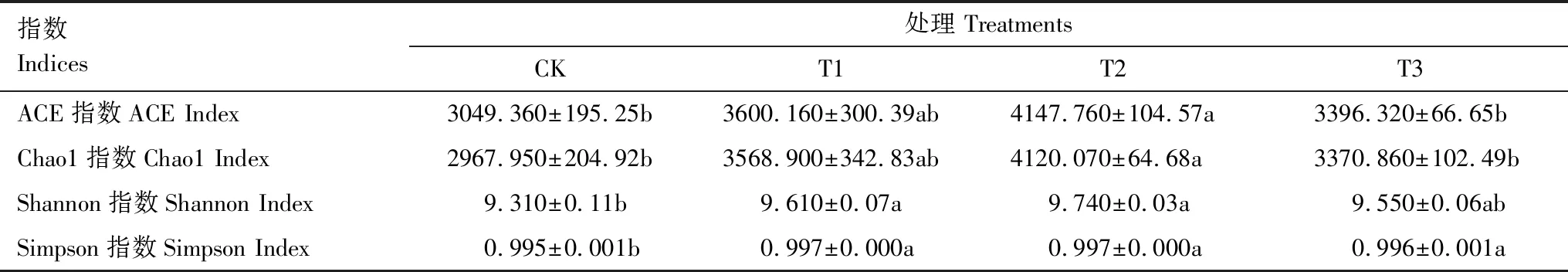
表3 不同处理土壤细菌群落多样性分析
2.3.2土壤β多样性分析
将土壤细菌群落OTU的相对丰度进行PCA分析,结果如图2所示。图2中第一主成分(PC1轴)可解释13.93%的细菌群落组成,第二主成分(PC2轴)可以解释10.84%的细菌组成。结果表明,施用与未施用微生物菌剂处理的土壤细菌主要成分有比较明显的分类趋势,除个别样品外,CK处理下细菌的种类基本集中在第四象限,含有较高的第一主成分,T1、T2、T3处理下细菌的种类基本分布在第一和第二象限,含有较高的第二主成分,并且分布相对集中。此结果认为,施用球毛壳ND35微生物菌剂能够显著改变土壤中细菌的群落组成,但不同用量处理下土壤细菌群落组成差异不明显。
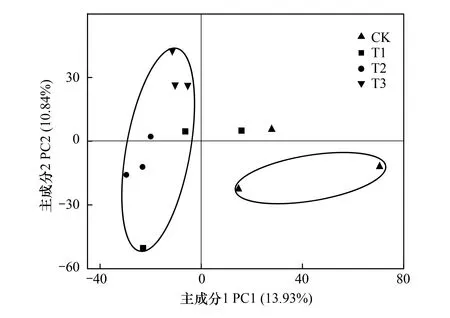
图2 不同处理土壤细菌群落OTU相对丰度的主成分分析(PCA)Fig.2 Principal components analysis based on OTU relative abundance of soil bacterial community
2.3.3土壤细菌群落组成
从门的分类水平看,各处理细菌群落组成相似(图3)。主要包含变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、浮游菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)10个细菌门,约占全部细菌丰度的95%左右。其中各处理的变形菌门、酸杆菌门及放线菌门相对丰度在10%以上,为优势细菌门。变形菌门是最为优势的细菌门,主要包括β-变形菌纲(Betaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)4个亚纲。施用球毛壳ND35微生物菌剂后,变形菌门的相对丰度有所下降,其4个亚纲的分布也发生了显著变化(图4)。其中β-变形菌纲、γ-变形菌纲的相对丰度呈下降趋势,尤其是T2、T3中β-变形菌纲的相对丰度比CK分别下降34.70%、37.22%(P<0.05),而α-、δ-变形菌纲的相对丰度呈显著增加趋势,分别从CK的7.72%、6.34%增加至10.68%—12.55%、7.69%—8.83%,T2中这两个细菌纲的相对丰度分别比CK增加62.59%和39.24%(P<0.05)。酸杆菌门是第二大优势细菌门,施用球毛壳ND35微生物菌剂后,它的相对丰度有所降低,尤在T2中下降了25.93%(P<0.05),这可能是其他细菌门的增加所致。放线菌门能产生种类繁多的胞外酶和次生代谢产物,促进土壤中动植物遗骸的腐烂,在生态系统中扮演着重要角色,它也是不同处理下的优势细菌门类。与CK相比,施用微生物菌剂可使其相对丰度提高7.21%—21.6%(P>0.05),这主要是由于菌剂的施用显著提高了土壤环境中有机质的含量。另外,还有部分细菌门的相对丰度发生显著了变化,与CK相比,T1、T2、T3中绿弯菌门、拟杆菌门、厚壁菌门、硝化螺旋菌门的相对丰度分别增加21.30%—32.01%、28.56%—40.64%、50.04%—70.47%、2.22%—13.59%,其中绿弯菌门及厚壁菌门的相对丰度在T3中与CK差异显著(P<0.05)。
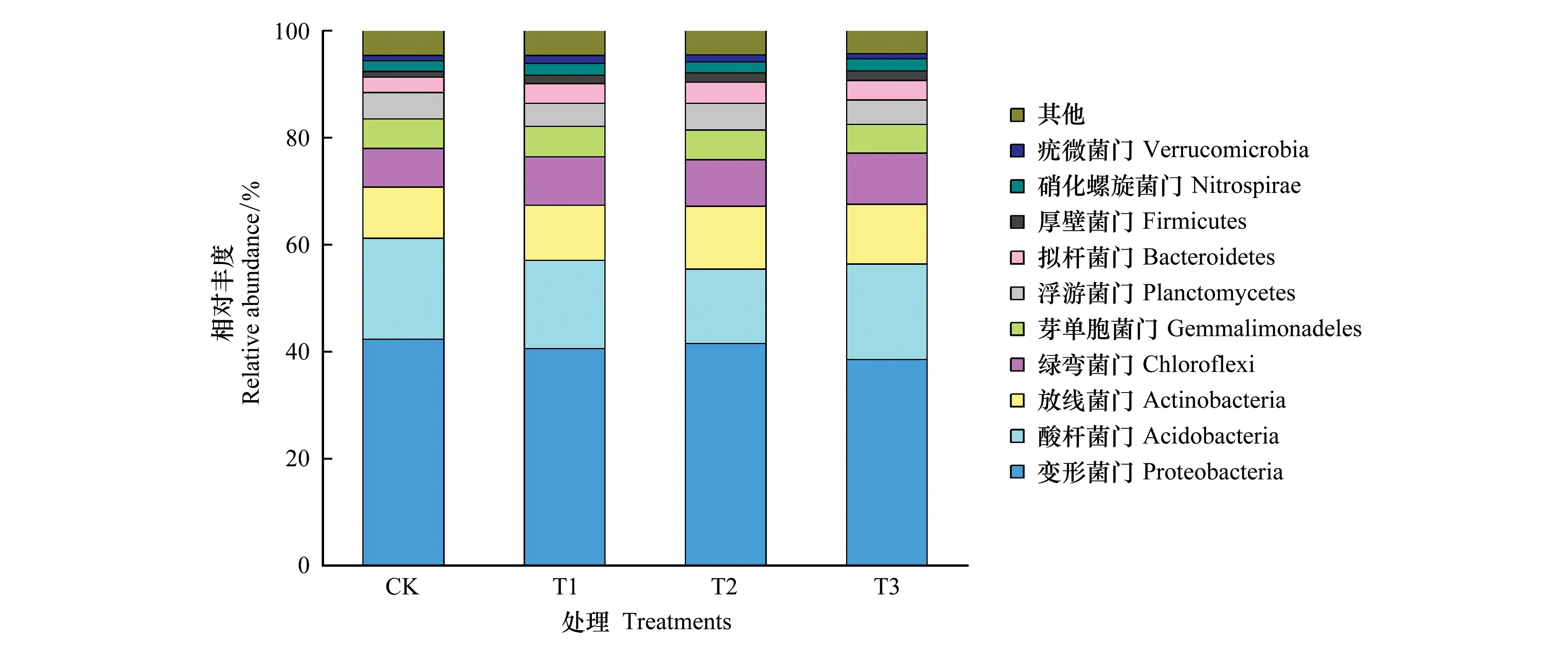
图3 不同处理土壤门水平细菌群落组成Fig.3 Composition of soil bacterial community on the phylum level

图4 不同处理土壤中变形菌纲亚群的分布 Fig.4 Distribution of soil proteobacteria under different treatments
从细菌属水平来看,根据物种注释和丰富度信息,选取相对丰度排名前30的细菌属进行分析(图5)。未施用微生物菌剂的土壤(CK)中固氮弧菌属(Azoarcus)、H16、苔藓菌属(Bryobacter)、Gaiella的相对丰度较高(>1%)。T1、T2处理的土壤中,RB41、地杆菌属(Geobacter)、固氮弧菌属(Azoarcus)、H16、Gaiella、unidentified-Rhodospirillaceae、类固醇杆菌属(Steroidobacter)的相对丰度较高(>1%),T3处理的土壤中,RB41、H16、Gaiella、unidentified-Rhodospirillaceae、类固醇杆菌属(Steroidobacter)、酸酐菌属(Acidibacter)的相对丰度较高(>1%)。另外,施用球毛壳ND35微生物菌剂可显著增加土壤中某些功能菌株和有益菌株的相对丰度。例如,施用微生物菌剂后,土壤中鞘氨醇单胞菌属(Sphingomonas)的相对丰度提高了21.88%—103.56%(P<0.05);芽孢杆菌属(Bacillus)的相对丰度在T1、T2、T3处理中相比CK分别显著提高65.38%、66.28%、65.97%(P<0.05)。施用球毛壳ND35菌剂后,土壤中酸杆菌属(Acidibacter)相对丰度提高了12.76%—38.06%。由此可见,施用球毛壳ND35微生物菌剂,可显著引起土壤中细菌属水平群落组成的变化。
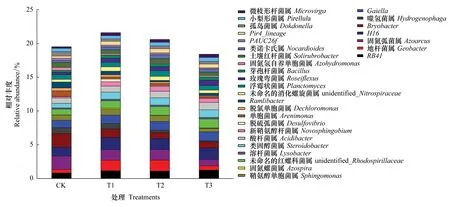
图5 不同处理土壤属水平细菌群落组成Fig.5 Composition of soil bacterial community on the genus level
2.3.4土壤细菌群落特征与土壤因子的相关性
土壤微生物群落不仅受生物因素的影响,也会受到土壤中环境因子的影响。为探讨它们之间的关系,本研究选取不同处理下土壤的化学性质及酶活性作为环境因子,以优势细菌群落的相对丰度及其多样性指标作为物种数据,进行RDA分析(图6)。从图中可以看出,优势细菌群落的相对丰度主要与土壤中硝态氮、铵态氮、有机质含量高度相关,其中硝态氮、铵态氮、有机质含量对土壤中放线菌门、δ-变形菌纲、α-变形菌纲的分布具有正反馈效应,对β-变形菌纲、γ-变形菌纲、酸酐菌门、变形菌门的分布具有负反馈效应。土壤细菌群落的多样性和丰富度主要受土壤中硝态氮、铵态氮、有机质含量的影响,硝态氮、铵态氮、有机质含量的积累会提高土壤细菌群落的多样性。土壤酶主要来自植物根系分泌物、动植物残骸及微生物的代谢产物,因此土壤微生物群落的变化势必会对土壤酶活性产生影响。研究结果显示,土壤中α-变形菌纲、δ-变形菌纲及放线菌门的相对丰度对土壤酶活性呈正相关,其中α-变形菌纲的相对丰度与脲酶、磷酸酶活性高度正相关,δ-变形菌纲的分布与蔗糖酶活性高度正相关;而土壤中酸酐菌门、β-变形菌纲、γ-变形菌纲、变形菌门的相对丰度与土壤酶活性呈负相关,其中过氧化氢酶活性与土壤中酸酐菌门、β-变形菌纲的分布高度负相关。综合分析可得,土壤硝态氮、铵态氮、有机质是影响土壤优势细菌群落组成及多样性的主要环境因子,土壤中α-变形菌纲、δ-变形菌纲、酸酐菌门、β-变形菌纲的分布能够显著影响土壤的酶活性。
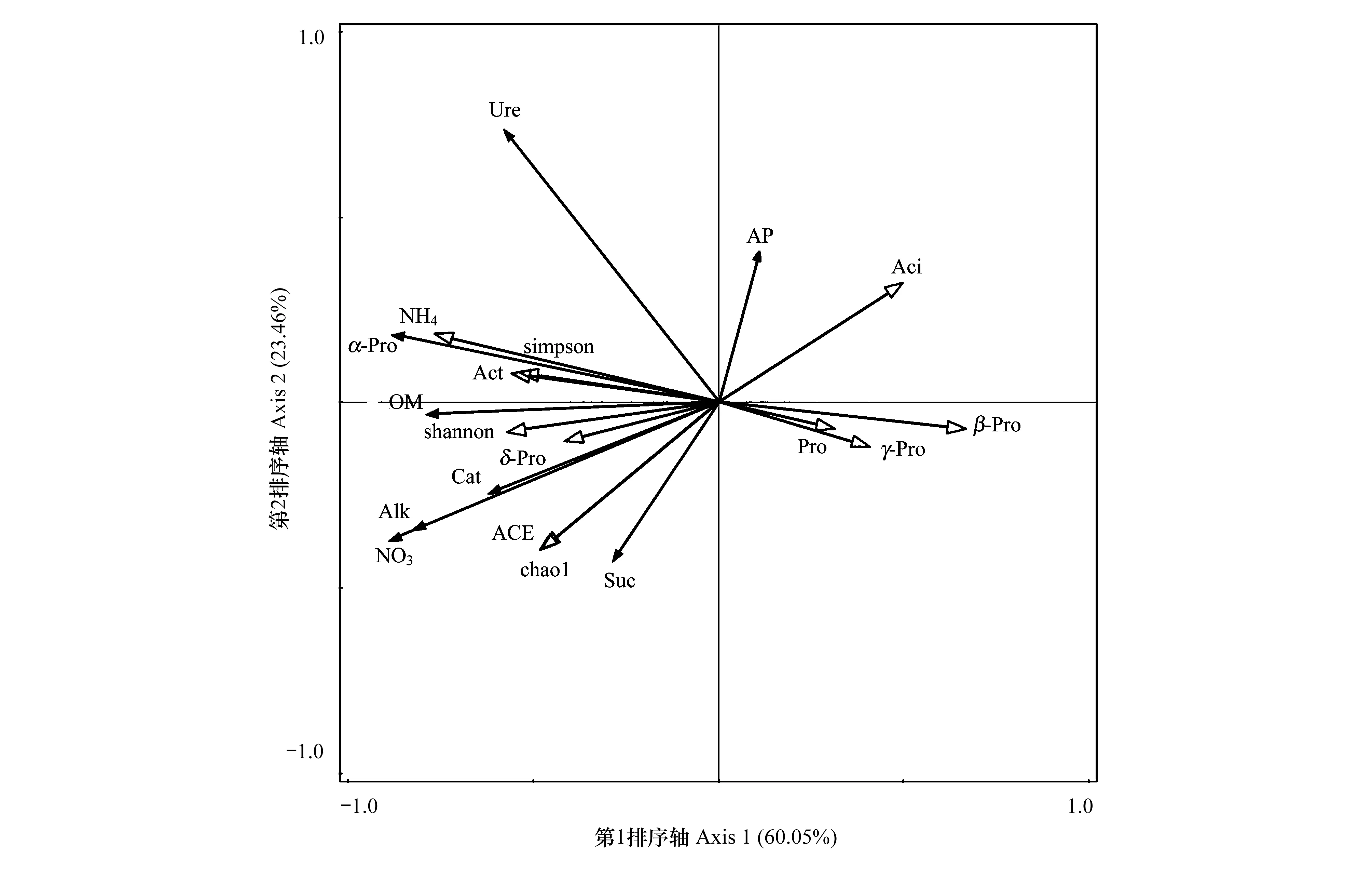
图6 细菌群落特征与土壤因子的冗余分析(RDA)Fig.6 Redundancy analysis of bacterial community and soil factors AP:速效磷Available Phosphorus;OM:有机质Organic Matter;NO3:硝态氮Nitrate-Nitrogen;NH4:铵态氮Ammonium-Nitrogen;Pro:变形菌门Proteobacteria;Aci:酸酐菌门Acidobacteria;Act:放线菌门Actinobacteria;α-Pro:α-变形菌纲Alphaproteobacteria;β-Pro:β-变形菌纲Betaproteobacteria;γ-Pro:γ-变形菌纲Gammaproteobacteria;δ-Pro:δ-变形菌纲Deltaproteobacteria;Cat:过氧化氢酶Catalase;Ure:脲酶Urease;Suc:蔗糖酶Sucrase;Alk:碱性磷酸酶Alkaline Phosphatase
2.4 楸树生长量与土壤指标的相关性
为了解土壤因子对楸树幼苗生长的影响,本研究对土壤化学性质、酶活性及优势细菌群落与楸树生长指标进行相关性分析,结果如表4。从表4可以看出,土壤中速效磷、硝态氮、铵态氮、有机质、脲酶、蔗糖酶、碱性磷酸酶、过氧化氢酶及优势细菌群落α-变形菌纲、δ-变形菌纲、放线菌门的分布对楸树幼苗的生长具有正向促进作用,其中株高与土壤中铵态氮、有机质含量呈显著正相关(P<0.05),与硝态氮含量及α-变形菌纲的分布呈极显著正相关(P<0.01);地径与硝态氮、铵态氮、有机质、蔗糖酶、碱性磷酸酶及优势细菌群落α-变形菌纲、δ-变形菌纲呈显著正相关(P<0.05),与过氧化氢酶活性呈极显著正相关(P<0.01);地上、地下生物量与硝态氮、过氧化氢酶、碱性磷酸酶及δ-变形菌纲的分布呈显著正相关(P<0.05),与蔗糖酶活性及α-变形菌纲的分布呈极显著正相关(P<0.01);所有生长指标与速效磷含量及放线菌门的分布相关性不显著(P>0.05)。优势细菌群落β-变形菌纲、酸酐菌门的分布对植物的生长具有负反馈效应,β-变形菌纲的含量与株高、地下生物量呈显著负相关(P<0.05),酸酐菌门的分布与地上生物量呈显著负相关(P<0.05),与地径及地下生物量呈极显著负相关(P<0.01),这可能由于这两种细菌群落中含有致病菌群。综合分析可知,土壤因子硝态氮、铵态氮、有机质、蔗糖酶、碱性磷酸酶、过氧化氢酶、酸酐菌门、α-变形菌纲、β-变形菌纲、δ-变形菌纲能够显著影响楸树幼苗的生长状况。
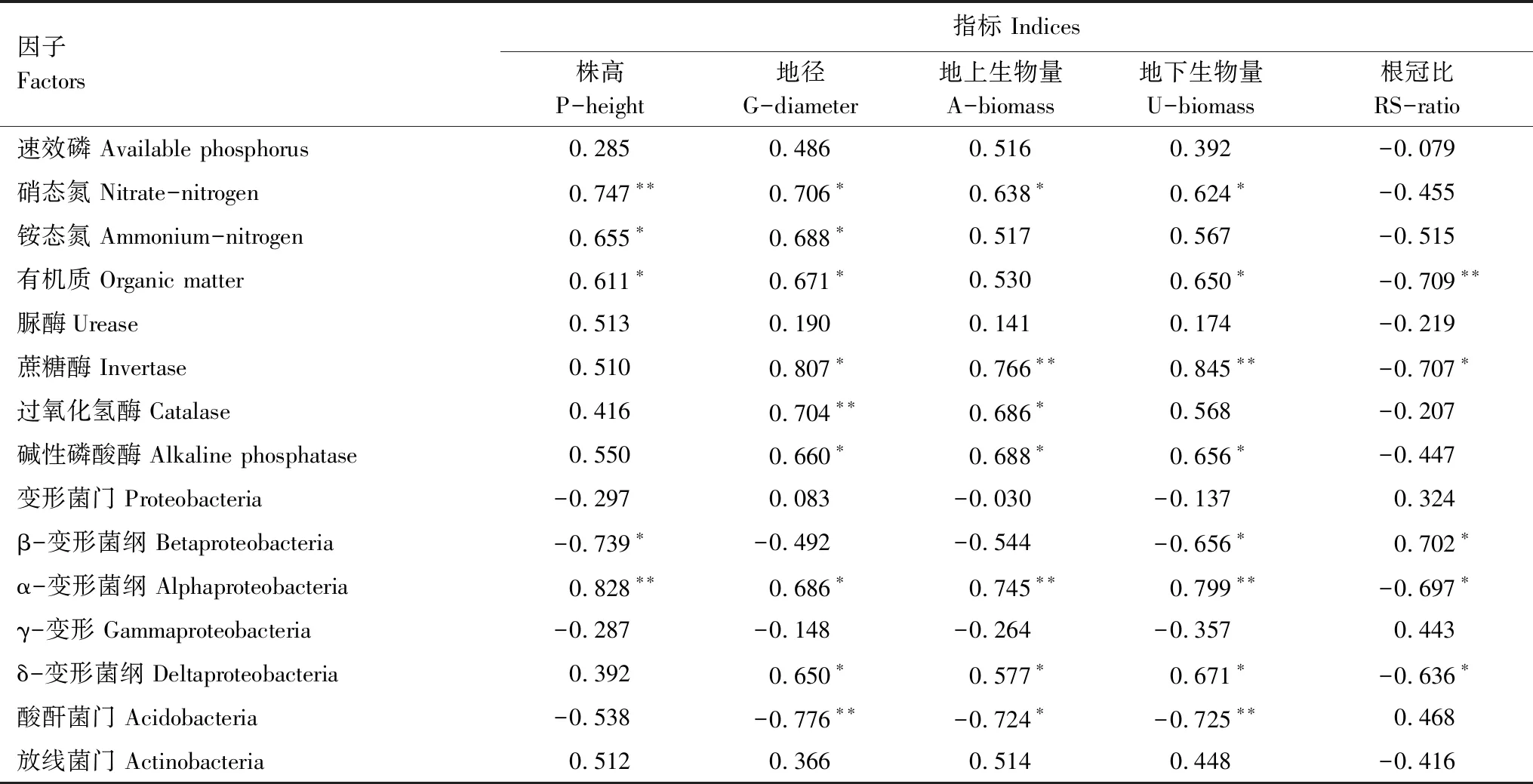
表4 楸树幼苗生长指标与土壤因子相关性矩阵
3 讨论
3.1 球毛壳ND35微生物菌剂对楸树根际微生物群落的影响
本研究基于Illumina MiSeq测序平台对不同用量球毛壳ND35微生物菌剂处理的楸树幼苗根际土细菌群落结构进行测序分析。根际土是受植物根系直接影响的区域,是植物-微生物-酶相互作用的特殊生态环境,是植物能量代谢和物质循环最活跃的区域之一,其细菌群落结构是表征土壤肥力的主要生物学指标[28]。以往研究发现微生物菌剂的施用会导致土壤微生物功能多样性发生变化,从而使土壤细菌群落结构发生显著变化[13- 14],本研究的土壤细菌群落结构分析得出与之一致的结果。这首先是由于微生物菌剂中含有大量的蛋白类、糖类等有机成分及氮、磷、钾等营养物质,其次其活性菌株在土壤中定殖后可分泌激素类物质,促使植物根系释放更多的分泌物[29]。这些均为微生物的生长繁殖提供了更多的碳源物质,能够促进土壤中有益菌的增殖。本研究所使用的球毛壳ND35菌剂可分泌吲哚乙酸(IAA)、赤霉素等物质(GAs)[30],可提高土壤中放线菌门、厚壁菌门、拟杆菌门等有益菌的相对丰度,放线菌门中某些细菌的次生代谢产物可拮抗病原菌[31],厚壁菌门中的大多数细菌具有病害生物防控的功能,拟杆菌门可有效降解土壤中的纤维素,促进有机碳循环[26]。以往研究结果认为,变形菌门、酸酐菌门、放线菌门为不同类型土壤中的优势细菌群落[32- 34],这与本研究结果一致。在本研究中微生物菌剂施用使变形菌门和酸酐菌门的相对丰度有不同程度的下降,放线菌门的相对丰度显著提高,但优势菌门的种类并未因菌剂的加入而改变,与施用枯草芽孢杆菌菌剂对烟草根际土壤细菌群落影响的研究一致[35]。这可能与不同细菌具有不同的生态幅有关,变形菌门、酸酐菌门、放线菌门在土壤中的生态幅较宽[32],受环境影响较小,因此菌剂的加入并未影响各处理中优势细菌的种类。值得注意的是,施用球毛壳ND35微生物菌剂后,变形菌亚群的分布发生了显著变化,β-变形菌纲、γ-变形菌纲的相对丰度显著下降,而α-变形菌纲、δ-变形菌纲的相对丰度显著上升,这可能与菌剂处理的土壤具有较高的养分含量有关。有研究表明高营养状态的土壤中含有丰富的α-变形菌,土壤中有机质及全氮含量对α-变形菌的相对丰度具有正向促进作用[36- 37]。本研究的RDA分析也表明,α-变形菌的相对丰度与土壤中有机质、硝态氮、铵态氮的含量呈正相关性,这可能是因为α-变形菌中包含大量参与碳氮循环的细菌群落。
研究表明微生物菌剂的施用可以显著提高土壤中微生物群落的多样性,促进有益菌的增殖[13- 14]。逆境条件下也得出类似的结果,如接种蜡样芽胞杆菌(B.cereus)L90可显著提高干旱生境中核桃根际土壤细菌群落的多样性[38]。本研究结果亦显示,施用菌剂的土壤细菌群落多样性和丰富度指标均显著高于CK,且各指标随菌剂施用量的增加呈现先上升后下降的趋势,在T2处理下有最大值。丰富的细菌群落多样性,会促进土壤生态系统健康稳定的发展,是土壤健康的标志之一。研究发现由于细菌的拮抗和竞争,在高细菌多样性的土壤中病原菌难以生长繁殖,并且微生物能够释放土壤酶,催化氧化还原、有机质矿化、污染物降解、腐殖物质在土壤中的合成以及生长活性物的释放等多种生物化学反应[39]。因此施用球毛壳ND35微生物菌剂会使土壤向“健康细菌型”发展。这一方面可能是由于球毛壳ND35微生物菌剂对病原菌的重寄生作用以及营养和生态位点的竞争作用及其在代谢过程中产生了具有抑菌活性的抗生物质[40-41],从而抑制了病原菌的增殖,使有益菌占据了更多的生态位,例如本研究中球毛壳ND35微生物菌剂处理后含有大量与植物共生有益菌的α-变形菌纲的相对丰度显著上升;另一方面球毛壳ND35菌剂的施用提高了土壤酶活性,改善了土壤的养分状况,使得土壤环境更适合有益微生物的生长繁殖。
3.2 球毛壳ND35微生物菌剂对楸树根际土壤酶活及理化性质的影响
研究发现,微生物菌剂的施用可显著提高土壤中关键酶的活性[12,42]。这与本研究结果一致,在本研究中球毛壳ND35菌剂显著提高了土壤中脲酶、蔗糖酶、磷酸酶、过氧化氢酶的活性。这主要是由于微生物菌剂能够利用其自身的微生物活动,改善植物根际环境,提高根际土壤中微生物的多样性,而根际微生物分泌的一些诱导化合物可以提高土壤酶活性[43]。例如本研究中优势细菌群落α-变形菌纲、δ-变形菌纲的分布对土壤脲酶、蔗糖酶及碱性磷酸酶活性具有正反馈作用,而球毛壳ND35微生物菌剂的施用可显著提高土壤中α-变形菌纲、δ-变形菌纲的相对丰度。也有研究认为,施用微生物菌剂对土壤酶活性的影响并不显著,甚至是抑制某些土壤酶活性,例如在鲁凯珩等[44]的研究中发现,施用贝莱斯芽孢杆菌(Bacillusvelezensis)S3- 1微生物菌剂会抑制土壤中脲酶的活性,而对土壤蔗糖酶活性无显著影响,这可能与不同的菌剂类型及土壤pH有关。土壤中的酶活性与速效养分含量密切相关,酶活性越高,越有利于土壤中营养元素的矿化,从而更有利于系统内的物质循环[45],因此酶活性的提高会促进土壤中养分的利用。本研究中,酶活性较高的土壤中其有机质、速效磷、硝态氮、铵态氮含量也显著提高,与以往的研究结果一致[46]。这首先是由于微生物菌剂自身含有的大量有机质和养分含量,其次是由于微生物菌剂的有益菌株在土壤中定殖后,可分泌有机酸溶解释放出被土壤颗粒等吸附的营养元素,在提高土壤酶活性的同时活化土壤中的养分含量,延长了土壤中速效养分的有效供给[29]。微生物不仅可以改善土壤肥力,反过来土壤环境因子对细菌的种类及组成也具有一定影响[47- 48]。值得关注的是在本研究结果中,土壤pH与细菌群落结构的相关性并不显著,而以往的许多研究报道了土壤 pH是影响细菌群落结构的重要因子[49- 50],尤其是对酸酐菌门的影响。方宇等[51]的研究认为酸酐菌门的相对丰度与土壤pH呈极显著正相关,而Männisto等[52]和Griffiths等[53]的研究表明,酸杆菌丰度与pH呈显著负相关,在本研究中土壤pH与酸酐菌门的分布并未存在显著相关性,这一结果此前也有所报道[54],这可能与不同的土壤类型及管理方式有关。此外还有研究证实,微生物菌剂能通过改善土壤的团粒结构,提高土壤的保水能力[16],这在本研究中未涉及,需要进一步探讨。
3.3 球毛壳ND35微生物菌剂对楸树幼苗生长量的影响
许多研究证实施用微生物菌剂对植物具有显著的促生作用,如微生物菌剂的施用可显著促进冬瓜、烟草植株及高羊茅的生长[13- 14,42],也有研究认为单施微生物菌剂对植物的促生作用不显著[55]。这可能与不同的菌剂类型及宿主植物有关,同时菌剂与宿主植物的作用时间也会显著影响试验结果。本研究结果表明,施用球毛壳ND35微生物菌剂提高了楸树幼苗的株高、地径及生物量的积累,且综合评价结果显示,在T2、T3处理下与CK差异显著(P<0.05),这说明在一定的菌剂施用量下显著促进了楸树的生长发育。有研究表明,微生物菌剂对植物的促生作用机制一方面是由于菌剂中的活性菌株能够产生多胺[56]、植物激素[57]、铁载体[58]、抑制性物质或抗菌化合物、合成降解酶[59]等,提高植物抗逆性,促进植物生长,另一方面微生物菌剂活性菌株可通过改善植物营养,调节纤维素酶、果胶酶、几丁质酶、淀粉酶、蛋白酶和脂肪酶的作用来催化不同的生化过程促进植物生长[60]。也有研究表明,菌剂的施用改善了植物根际的微生物群落结构,促进有益菌的定植,提高土壤酶活性,防止土壤中养分含量的流失,从而促进植物生长[29,61]。这一作用机制在本研究也得到证实。本研究发现施用球毛壳ND35微生物菌剂可显著提高植物根际土壤中鞘氨醇单胞菌属(Sphingomonas)的相对丰度, 其在土壤中的主要功能是降解芳香族化合物,产生吲哚乙酸(IAA)、赤霉素(GAs)促进植物生长[62];土壤中酸杆菌属(Acidibacter)在分解蛋白质、摄取土壤酸性物质方面发挥着重要作用,是维持土壤生态平衡的有益菌株[63],施用球毛壳ND35后,其相对丰度显著提高;芽孢杆菌属在土壤中起着拮抗病原微生物、诱导系统抗性、促进植物生长的作用,施用球毛壳ND35菌剂可显著提高其相对丰度[64- 65]。另外,研究的细菌群落β多样性分析表明,施用微生物菌剂能够显著影响土壤中细菌群落的特征,细菌群落特征与土壤酶活性及环境因子的RDA分析发现,土壤中优势细菌群落α-变形菌纲、δ-变形菌纲、酸酐菌门、β-变形菌纲的分布能够显著影响土壤中酶的活性及速效养分含量,而楸树生长指标与土壤因子的相关性分析结果发现,土壤中的速效养分含量、蔗糖酶、碱性磷酸酶、过氧化氢酶活性及酸酐菌门、α-变形菌纲、β-变形菌纲、δ-变形菌纲的分布能够对楸树的生长产生显著的影响[66]。
4 结论
(1)球毛壳ND35微生物菌剂的施用可通过改善和平衡土壤中微生物群落的结构特征,促进土壤酶的释放,改善土壤肥力,从而促进楸树的生长,且在T2处理下对土壤的改善作用及楸树的促进作用最为显著。在实际应用的过程中,适宜的菌剂用量不仅对植物的生长至关重要,同时可节约经济成本。本研究可为微生物菌剂的合理施用提供技术参考。另外,本研究结果进一步验证了球毛壳ND35对植物的作用机理,完善了其对乔木植物作用机制的研究空白,为楸树的壮苗培育提供了新的研究方向。
(2)以往研究结果表明水分限制和养分匮乏是裸露矿区退化生态系统植被难以恢复的主要因子,其将直接影响植被的恢复效果及矿区的生态功能,因此提高土壤肥力及蓄水能力是矿区生态修复的关键。本研究中发现,球毛壳ND35微生物菌剂的施用能够快速活化土壤养分,显著提高植物对土壤养分的利用效率,促进植物的生长发育。因此,在困难立地及退化生态系统恢复与重建中具有巨大的应用潜力,而应用后的生态效益还有待进一步的研究。
