水热预处理与Myceliophthora thermophila复合酶协同高效降解混合生物质的研究
2020-11-24钱玉霞邱卫华
钱玉霞,邱卫华,任 虹*
(1.北京工商大学轻工科学技术学院 食品质量与安全北京实验室 中国轻工业清洁生产和资源综合利用重点实验室,北京 100048;2.中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190;3.中国科学院洁净能源创新研究院,辽宁 大连 116023)
将低值化的木质纤维素转变成制备高值化产品的原料,首先需要突破抵御生物和酶攻击的天然屏障,构建高浓度的“糖平台”[1-3]。预处理技术可以打破木质纤维素原料的致密结构,增大其表面孔径和比表面积,从而提高原料的纤维素酶(Cel)水解效率及后续微生物的多糖利用率。水热预处理(hot-water pretreatment,HWP)因无需添加任何化学试剂即可高效去除大量半纤维素和部分木质素等,被认为是一种低成本的绿色预处理方法[4-5]。然而,水热预处理对原料中木质素的降解能力较弱。由于残留的木质素可能会形成物理屏障,导致酶的非生产性吸附,从而影响后续的酶水解效率[6-7]。真菌,尤其是白腐菌,因具有独特的半纤维素、木质素分解酶系,可选择性降解木质素和半纤维素,并且具有能耗低、环境友好等优势,真菌处理成为重要的木质纤维素生物预处理方法[8-10]。但是,真菌处理存在微生物生长周期长、发酵温度多为常温、发酵过程较难控制等缺点。嗜热毁丝霉(Myceliophthorathermophila)是一种高效的木质纤维素天然降解剂,能够有效利用植物生物质并将其水解产生单糖及其它小分子物质[11-12]。研究表明,该菌株的基因序列含有大量编码木质纤维素分解酶的基因,可分泌大量热稳定的碳水化合物分解酶和木质素降解酶,从而降解各种不同的生物质[13-15]。
传统的以单一原料为主的生物质炼制技术存在原料供应易受地域、储运成本限制等问题。相比而言,混合生物质原料具有供应更稳定、储量更大、更易于收集等优势。研究表明,混合生物质原料的充分利用可能提高生物乙醇的产量,并提高生物精炼厂的经济可行性[16-17]。鉴于此,作者以甘蔗渣-棉杆-小麦秸秆 (4∶2∶1,质量比)混合生物质为研究对象,考察水热预处理参数对混合生物质中各组分含量的影响;研究嗜热毁丝霉复合酶(MTE)与Cel协同作用下,不同水热预处理参数下制备的混合生物质的酶解效率;最后结合酶解液的UV变化及酶解渣的FTIR图谱分析,解析MTE与水热预处理协同作用提高混合生物质降解效率的机制。
1 实验
1.1 材料、试剂与仪器
甘蔗渣(广西)、棉杆(河北)、小麦秸秆(河北),在60 ℃真空干燥箱中烘干至恒重,并粉碎至60目。按质量比4∶2∶1将甘蔗渣、棉杆、小麦秸秆混合,制备混合生物质。采用美国可再生能源实验室(NREL)标准检测方法[18]分析混合生物质中主要组分的含量,其中酸不溶木质素、葡聚糖、木聚糖的含量分别为21.2%、36.5%、19.6%。
纤维素酶(Cel),诺维信公司;其它试剂未特殊标注均为分析纯,北京奥博星生物技术有限责任公司、国药集团化学试剂有限公司等。
H1650型台式高速离心机、H2050R-1型高速冷冻离心机,湘仪离心机仪器有限公司;754PC型紫外可见分光光度计,上海菁华科技有限公司;LC-20A型二元高压液相色谱仪,日本岛津;Y92-ⅡN型超声波破碎仪,宁波新芝生物科技有限公司;S-450型扫描电子显微镜,日立公司;System 2000型红外光谱仪,美国Perkin-Elmer公司。
1.2 菌种
嗜热毁丝霉(M.thermophilaDSM 1799),德国微生物和细胞培养物保藏中心(DSMZ)。
1.3 发酵液的制备
将嗜热毁丝霉接种于土豆葡萄糖琼脂培养基(PDA)中,28 ℃培养5 d后,保存于冰箱中,备用。
将嗜热毁丝霉菌丝接种至土豆葡萄糖培养基 (PDB)中,于50 ℃、180 r·min-1振荡培养3 d,得种子液;然后按5%的接种量将种子液接种至PDB培养基中,于50 ℃、180 r·min-1振荡培养5~7 d,即得嗜热毁丝霉发酵液。
1.4 嗜热毁丝霉复合酶的制备
将嗜热毁丝霉发酵液于8 000 r·min-1离心10 min,分离菌体和发酵液;将菌体细胞重悬于1/5~1/10发酵液体积的50 mmol·L-1pH值 7.4的Tris-HCl缓冲液中,冰浴下进行超声破碎;将混合物于10 000 r·min-1离心10 min,收集上清液,即为嗜热毁丝霉胞内酶液。
将嗜热毁丝霉发酵液和胞内酶液合并后,加入硫酸铵至浓度为80%,4 ℃静置,充分沉淀蛋白质,于10 000 r·min-1离心10 min,取沉淀溶于0.2 mol·L-1pH 值5.0 的PBS缓冲液后,装入透析袋中,于4 ℃透析去除硫酸铵,即得MTE。以牛血清蛋白为标准品,采用考马斯亮蓝法[19]测得MTE的总蛋白含量为23.5 mg·mL-1。
1.5 混合生物质水热预处理
将混合生物质加入高温高压反应釜反应罐中,并按固液比1∶10(g∶mL,下同)加入蒸馏水;反应釜密封后加热至预设温度,恒温一定时间,迅速冷却至室温;泄压,抽滤,收集生物质残渣和水解液;记录水解液的体积,生物质残渣晾干后备用。按式(1)计算水热预处理强度(PS)[20]:
(1)
式中:t1为反应器温度达到100 ℃的时刻,min;t2为反应器温度冷却至100 ℃的时刻,min;T为反应器温度,℃。
1.6 混合生物质的酶解
按以下3种方式进行水热预处理生物质残渣的酶解:(1)加入MTE处理24 h后,加入Cel进行酶解,记为MTE-Cel;(2) 同时加入MTE与Cel进行酶解,记为MTE+Cel; (3)仅加入Cel进行酶解,记为Cel。MTE加量为10 mg蛋白·(g底物)-1,Cel加量为40 U·(g底物)-1。
酶解操作为:取水热预处理生物质残渣1 g,加入酶,以0.02 mol·L-1pH 值4.8的醋酸-醋酸钠缓冲液调节酶解体系的固液比为1∶20;搅拌均匀后,于50 ℃、180 r ·min-1振荡酶解;真空抽滤进行固液分离,用20 mL蒸馏水洗涤酶解渣,洗涤液与酶解滤液合并得到酶解液,酶解渣晾干,备用。
按式(2)计算酶解总糖得率(ST,%):
(2)
式中:mge和mxe分别为酶解液中葡萄糖和木糖质量,g;mgb和mxb分别为酶解前原料中葡聚糖和木聚糖质量,g;0.9为葡萄糖和葡聚糖的转化系数;0.88为木糖和木聚糖的转化系数。
按式(3)计算MTE对Cel的协同酶解效率(SE,%):
(3)
式中:STMTE和STCel分别为MTE协同酶解方式下和Cel单独酶解方式下得到的总糖得率,%。
1.7 分析方法
1.7.1 葡萄糖和木糖含量的测定
采用HPLC法测定葡萄糖、木糖的含量[21]。色谱条件:色谱柱为Aminex HPX-87H (300 mm×7.8 mm,Bio-Rad Laboratories Inc.),流动相为脱气处理的5 mmol·L-1H2SO4,流速为0.6 mL· min-1,柱温为65 ℃,示差检测器温度为40 ℃。
1.7.2 混合生物质组分分析
采用NREL的两步酸水解法[18]分析混合生物质中主要组分。称取0.3 g混合生物质,加入3 mL 72%浓硫酸,30 ℃保温60 min后,再加入84 mL去离子水,于121 ℃水解60 min后,取出冷却至室温;抽滤分离生物质残渣和水解液。取1 mL水解液,采用HPLC法测定葡萄糖和木糖含量;生物质残渣经洗涤后,置于60 ℃烘箱中烘干至恒重,测定酸不溶性的木质素含量。按式(4)~(6)分别计算葡聚糖、木聚糖和木质素的降解率:
(4)
(5)
(6)
式中:V为水解液的体积,mL;cg、cx分别为水解液中葡萄糖含量、木糖含量,g·mL-1;mg、mx分别为水热预处理混合生物质中葡聚糖、木聚糖的质量,g;m0、m1分别为水热预处理前、后混合生物质中木质素的质量,g。
1.7.3 酶解液的UV分析
将酶解液以适量蒸馏水稀释,在220~450 nm范围内进行全波段扫描。
1.7.4 酶解渣的FTIR分析
分别取约1 mg混合生物质及酶解渣样品,加入约200 mg干燥的溴化钾,充分研磨后压片,进行FTIR分析。扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描10次进行光谱累加,环境气氛为空气[22]。
2 结果与讨论
2.1 水热预处理参数对混合生物质中各组分含量的影响
水热预处理温度和时间对混合生物质中各组分含量的影响如图1所示。

图1 水热预处理温度和时间对混合生物质中各组分含量的影响
从图1可以看出,总体来说,相对于未处理原料,水热预处理使混合生物质中葡聚糖和木质素含量增加,而木聚糖含量显著减少。
在140~170 ℃范围内,混合生物质中葡聚糖含量变化不明显;但是当温度升高至180 ℃时,葡聚糖含量有所减少。
木聚糖含量随着水热预处理温度升高而不断减少。在维温时间为10 min、温度由140 ℃升至150 ℃和由170 ℃升至180 ℃时,混合生物质中木聚糖含量分别减少了5.08 %和41.1%。木聚糖降解率随维温时间延长而升高,且高温区维温时间对木聚糖降解率的影响更为显著。在140 ℃下维温时间由10 min延长至30 min时,木聚糖降解率仅提高11.74% (由9.69%升高至21.43%);而在180 ℃下维温时间由5 min延长至10 min时,木聚糖降解率则提高了45.4%,达到81.6%。
木质素含量随着水热预处理温度的升高和水热预处理时间的延长呈增加的趋势,最大含量达到32.6%。维温时间为10 min、温度从140 ℃升至150 ℃和从170 ℃升至180 ℃时,混合生物质中木质素含量分别增加了5.19%和22.1%。维温时间对木质素降解率的影响也较大,在160 ℃维温10 min和180 ℃维温5 min,木质素含量分别增加了16.98%和38.68%。但是,在各温度下,延长维温时间对于木质素含量的增加影响并不明显。
总体而言,水热预处理对混合生物质中各组分含量的变化趋势与已有报道[23-24]较为一致。木聚糖含量的变化主要是由半纤维素的降解引起的。通常,水热预处理中半纤维素首先降解为木糖低聚物、葡萄糖醛酸和乙酸等。半纤维素的降解打破了原料致密的细胞壁结构,有利于提高后续酶解过程中酶的生物可及性[25-27]。但是过高的水热预处理强度下,上述初级产物可被二次降解为木糖单体、糠醛、5-羟甲基糠醛、乙醇酸、甲酸等抑制物质,从而对酶解产生不利影响[23,28-29]。由于多糖类组分的降解,原料中木质素含量随着水热预处理强度的升高而增加。另一方面,多糖降解物以及水解液中的小分子物质之间发生再凝集反应生成酸不溶性的木质素类似物,这些物质会沉积在纤维素表面,也会造成水热预处理后木质素含量增加[30-31]。而木质素对于后续混合生物质的酶解存在诸多不利影响,包括影响Cel活性和酶吸附、解吸效率等,进而影响酶解效率[32-35]。
相近水热预处理强度下混合生物质中各组分含量变化如表1所示。

表1 相近水热预处理强度下混合生物质中各组分含量变化
从表1可以看出,温度是影响各组分含量变化的主要因素,150 ℃维温30 min时,木质素含量为(26.50±1.33)%;而180 ℃维温5 min时,木质素含量为(29.40±1.35)%。可见,高温会导致葡聚糖降解及木质素含量增加,不利于后续混合生物质的酶解。
2.2 水热预处理混合生物质多酶协同酶解
不同酶解方式下,不同水热预处理混合生物质的总糖得率及协同酶解效率如图2所示。
在不同酶解方式下,混合生物质的总糖得率均随水热预处理强度升高而升高。混合生物质的酶解总糖得率随水热预处理温度升高而升高,维温时间为20 min、温度从140 ℃升至180 ℃时,混合生物质的Cel酶解总糖得率从36.51%升至79.21%,而MTE-Cel和MTE+Cel的总得糖率则均升至约85%(图2a)。在140~170 ℃范围内,随着维温时间的延长,混合生物质的酶解总糖得率也随之升高;但是当水热预处理温度为180 ℃且维温时间超过20 min时,酶解总糖得率降低(图2b)。这可能是由于,一方面,长时间高温水热预处理得到的混合生物质中含有的糠醛、羟甲基糠醛、木质素降解物等物质对酶的活性具有抑制作用[4];另一方面,长时间高温水热预处理条件下,由于一些酸不溶性木质素类似物沉积在纤维素表面,限制了纤维素对酶的可及性,并且在酶促水解过程中造成Cel的无效吸附,从而影响水热预处理混合生物质的酶解效率[31,36-37]。
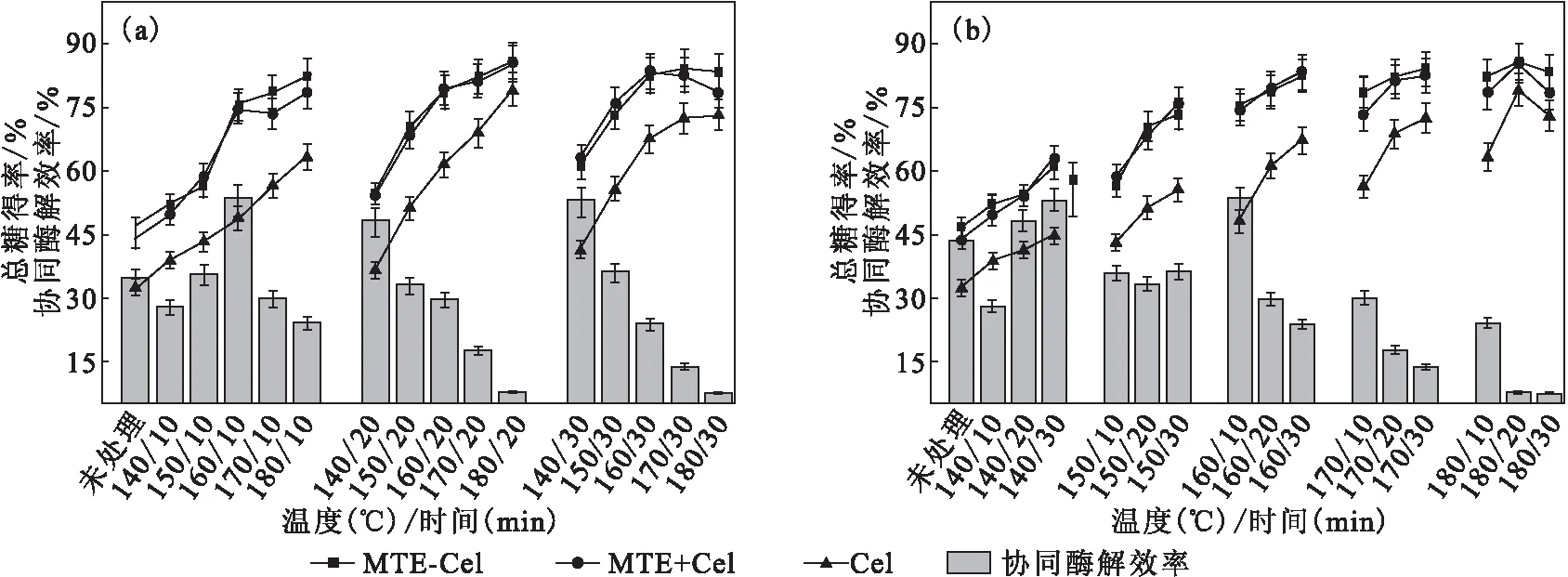
图2 不同酶解方式下,不同水热预处理混合生物质的总糖得率及协同酶解效率
MTE-Cel和MTE+Cel酶解方式均具有明显的协同酶解效果。在MTE-Cel酶解方式下,混合生物质的总糖得率略高于MTE+Cel酶解方式。当维温时间为10 min、温度由140 ℃升至160 ℃时,MTE对Cel的协同酶解效率逐渐升高,并在160 ℃时达到最高,为53.6%,之后协同酶解效率迅速降低(图2a)。而维温时间在20 min和30 min时,MTE对Cel的协同酶解效率均随温度升高而快速降低,在180 ℃维温20 min和30 min时,MTE对Cel的协同酶解效率分别为7.7%和7.4%。而水热预处理时间对MTE协同Cel水解生物质的影响也存在较大的差异。在140 ℃分别维温10 min、20 min和30 min的混合生物质,经MTE+Cel酶解的总糖得率较Cel单独酶解分别提高了28.17%、48.21%和53.21%。而在150 ℃下维温10 min,MTE对Cel的协同酶解效率为35.8%,之后延长预处理时间对协同酶解效率的影响不大。在160~180 ℃范围内,协同酶解效率则随维温时间延长而快速降低 (图2b)。这说明,MTE与Cel协同作用可以降低水热预处理强度,从而达到减少能耗的目的。而当水热预处理强度较高的情况下,MTE对Cel的协同酶解效果减弱。
MTE具有协同酶解作用主要是由于,在嗜热毁丝霉的基因序列中含有大量编码木质纤维素分解酶的基因,如木聚糖酶、内切葡聚糖酶(CMCase)、β-葡萄糖苷酶以及与木质素降解有关的漆酶基因等,这使得该菌可以将木质纤维素原料有效降解为单糖及其它小分子物质[13-15,38]。其中,漆酶及其介体催化体系是催化木质素降解的重要催化剂之一。而经水热预处理的生物质会产生一定量的木质素衍生物,这些小分子物质一些已经被证实可以作为漆酶的介体,构成漆酶-介体催化体系催化木质素的降解[41],从而达到降低木质素含量,减少木质素引起的Cel无效吸附等。但是,高水热预处理强度下,木质素的降解物浓度过高,会导致MTE酶活性的降低甚至失活。另外,一些具有低聚结构的降解物还会引起聚集体的形成,也会导致酶的失活。因此,确定以160 ℃维温10 min对混合生物质进行水热预处理,再以MTE+Cel协同酶解来实现混合生物质的高效生物降解。
2.3 酶解液的UV分析
生物质中具有紫外吸收的物质主要来自于木质素降解产物,160 ℃维温10 min水热预处理的混合生物质在不同酶解方式下酶解液的UV图谱如图3所示。
通常190 nm附近和270~300 nm范围内的紫外吸收峰归属于含有羰基的饱和醛酮类化合物。而在α、β-不饱和醛酮中,羰基与乙烯基产生的π-π共轭作用使上述两个谱带红移至220~260 nm和310~330 nm。从图3可以看出,酶解前,溶液中由于水热预处理残留的木质素降解产物的存在,在280 nm附近具有较弱的紫外吸收;酶解后,酶解液在280 nm附近的吸收峰强度均有所升高。280 nm处是含有酚羟基物质的特征紫外吸收峰。Cel作用下,混合生物质中的纤维素被水解,从而使得吸附在混合生物质表面的木质素残渣以及凝聚态假木质素等被释放出来,引起紫外吸收强度的升高。而MTE与Cel协同作用的酶解液在330 nm处的吸收峰强度也明显升高,尤其是MTE-Cel酶解方式下,酶解液在330 nm处的吸收峰强度显著高于其它两种方式。而对于木质素可溶性降解产物,330 nm处的吸收峰主要归属于具有强共轭体系的不饱和醛酮类物质,如黄酮、香豆素类等多酚类物质以及一些茋类化合物[42]。这说明,MTE的加入可以进一步催化木质素降解产生具有不饱和共轭结构的降解产物。

图3 不同酶解方式下,水热预处理混合生物质酶解液的UV图谱
2.4 酶解渣的FTIR分析
不同酶解方式下,水热预处理混合生物质酶解渣的FTIR图谱如图4所示。
从图4可以看出,3 385 cm-1附近为酚羟基和脂羟基O-H伸缩振动,经过Cel单独酶解或者经与MTE协同酶解后的相对吸收强度均有所升高,尤其是两者协同作用下的吸收强度显著升高;2 925 cm-1附近为甲基亚甲基C-H伸缩振动,经酶解后吸收强度都略有升高;1 645 cm-1处为木质素苯环结构中共轭羰基C=O伸缩振动,经MTE与Cel协同酶解后吸收强度显著升高,而Cel单独酶解升幅较小。1 608 cm-1处为芳香核及C=O伸缩振动、1 510 cm-1处为芳香核振动,在3种酶解方式下,1 608 cm-1、1 510 cm-1处吸收强度均有升高,但Cel酶解方式下的增幅明显低于MTE+Cel和MTE-Cel。这可能是由于,经过酶解后,原料中主要组分是木质素,因此木质素的特征吸收峰均变得更加明显,且吸收强度明显升高。1 456 cm-1处为木质素芳香环上的C-H变形振动;1 421~1 423 cm-1处为纤维素-CH2和C-H伸缩振动及芳香环上C-H平面变型振动。1 370~1 380cm-1处为纤维素和木质素中C-H弯曲振动,吸收强度均降低,表明纤维素与木质素间相互作用已被破坏。可以推测,经不同方式酶解后,纤维素与木质素之间的连接均被破坏,从而造成Cel单独酶解时,因原料中木质素的释放而引起3 385 cm-1、1 608 cm-1、1 510 cm-1和1 370~1 380 cm-1处吸收强度升高。但是由于MTE中不仅含有木质纤维素分解酶而且还含有少量木质素氧化酶,因此MTE协同酶解时,不仅上述吸收强度会更明显升高,而且1 645 cm-1处共轭羰基C=O吸收峰显著升高。1 325~1 330 cm-1处为特有的紫丁香基吸收峰。1 241~1 245 cm-1处为愈创木基环伸缩振动及C=O伸缩振动。1 158~1 169 cm-1和1 034~1 038 cm-1处分别为纤维素和半纤维素的骨架结构中的C-O-C伸缩振动和C-O伸缩振动;895~898 cm-1处为纤维素中葡萄糖环的伸缩振动,经不同方式酶解后,这两处的相对吸收强度均有不同程度的降低。说明经酶处理后,混合生物质中的纤维素含量降低。

图4 不同酶解方式下,水热预处理混合生物质酶解渣的 FTIR图谱
3 结论
以甘蔗渣-棉杆-小麦秸秆(4∶2∶1,质量比)混合生物质为研究对象,进行了水热预处理与MTE生物处理协同高效降解的研究,得到以下结论:
(1)水热预处理温度是影响混合生物质中各组分含量变化的主要因素,在相近水热预处理强度下,经150 ℃维温30 min和180 ℃维温5 min处理的混合生物质中木质素含量分别为(26.50±1.33)%和(29.40±1.35)%。高温会导致葡聚糖降解及较高的木质素含量,从而不利于后续混合生物质的酶解。
(2)MTE对Cel具有明显的协同作用,且受水热预处理温度的影响较大。MTE对经160 ℃维温10 min处理的混合生物质的Cel酶解协同效率最高达(53.60±2.68)%,酶解总糖得率达(75.50±3.77)%。而继续升高温度或者延长维温时间,虽然酶解总糖得率略有升高,但MTE的协同酶解效率快速降低。可见,MTE的协同作用可以降低水热预处理强度。
(3)UV分析显示,MTE协同酶解可使酶解液在280 nm和330 nm处的吸收强度显著升高,结合酶解渣的FTIR光谱分析,推测MTE中丰富的木质纤维素分解酶和木质素氧化酶不仅可以破坏纤维素与木质素之间的连接,而且可直接降解木质素产生具有不饱和共轭结构的可溶性物质,达到减少木质素对Cel的无效吸附,并提高酶解效率的作用。
