肌少症研究进展
2020-11-24刘月涛杜冠华秦雪梅
何 盼 刘月涛 杜冠华 秦雪梅
1.山西大学中医药现代研究中心,太原,030006,中国
2.中国医学科学院北京协和医学院药物研究所,北京,100050,中国
肌肉减少症(sarcopenia,Sp),又名肌少症、少肌症、肌肉衰减症,其定义为增龄性的骨骼肌质量减少、肌力下降、肌功能下降[1]。肌少症已于2016 年在第十版国际疾病分类(The International Classification of Disease,Tenth Revision,Clinical Modification,ICD-10-CM)中 获得其独有的疾病代码ICD-10-CM(M62.84)[2],这表明肌少症已被认为是一种独立的实体疾病。2018 年欧洲肌少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)对肌少症的定义达成共识,不仅指肌肉质量和力量的减弱,更强调肌肉功能的下降[3]。临床上对肌少症的诊断常以肌力、肌量和肌功能三个指标,并结合影像学进行评估。肌少症容易造成中老年人体力活动减少,骨骼肌对骨骼结构的刺激下降,进而使成骨作用衰退、骨-肌单位萎缩[4],导致患者跌倒和骨折风险增加,并与心脏疾病、呼吸系统疾病和认知障碍相关,使患者日常生活质量下降,丧失独立生活能力,或长期需要别人照料,死亡风险增加[5]。流行病学调查发现,肌少症在≥65 岁老年人中患病率为20%,而在≥80 岁人群中达50%~60%[6]。目前,肌少症逐渐引起老年医学界的广泛关注,本文拟对肌少症的病理机制、中西医治疗现状及疾病模型三个方面进行综述。
1 肌少症病理机制研究进展
肌少症的发生涉及多种风险因素和机制,如老年人缺乏运动,蛋白质等营养摄入缺乏,导致肌肉合成阻碍……本文从神经-肌肉接头阻滞及运动神经元缺失、与肌肉蛋白降解、合成相关的信号通路三个方面对其发病机制(Fig.1)进行综述。
1.1 神经-肌肉接头阻滞及运动神经元缺失
运动神经元在肌肉运动中发挥重要角色,随着年龄增长,神经元的失神经支配会引起肌肉神经源性障碍,支配肌肉的运动神经元数量及功能的衰退会直接导致肌肉力量以及协调性下降,是肌少症发生的重要诱因[7]。M.Drey[8]等对肌少症病人、健康人及肌萎缩脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)病人的神经运动单元数量指数(motor unit number index,MUNIX)及运动单元大小指数(motor unit size index,MUSIX)进行分析,结果表明肌少症病人的MUNIX 值高于ALS 病人,低于健康人,MUNIX 与MUSIX 两个指标呈显著负相关(反比例函数),MUNIX 对将来诊断和治疗肌少症有重要意义。由此可见,神经肌肉接头的退化及运动神经元的缺失与肌少症的发生密切相关。
1.2 与肌肉蛋白降解相关的通路
1.2.1 泛素蛋白酶通路(ubiquitin proteasome pathway,UPP)
骨骼肌蛋白质降解的主要途径为泛素-蛋白酶体途径。其中,MAFbx 和MuRFl 是骨骼肌泛素化蛋白酶体途径中的限速酶。Mikael Altun[9]等研究了泛素蛋白酶通路在肌少症大鼠中的活性,结果表明与4 月龄的成年大鼠相比,30 月龄衰老大鼠肌肉质量明显下降,26 S 蛋白酶系高2~3 倍;MuRF1、Atrogin/MAFbx 表达升高,通过泛素蛋白酶系蛋白降解的活力升高。王今越[10]等研究了胰岛素受体底物1(insulin receptor substrate 1,IRS1)、蛋白激酶 B(protein kinase B,PKB/Akt)、叉头框蛋白O1(forkhead box protein O1,FOXO1)在少肌症发生及其运动性缓解中的作用,结果表明衰老肌肉IRS1/Akt、FOXO1 通路的生肌信号抑制且分解信号增强,可能通过提高(泛素蛋白酶通路)分解代谢而非降低(生肌因子途径)合成代谢介导了少肌症发生。因此,UPP 导致肌肉蛋白降解,在肌少症的发生中扮演重要的角色。
1.2.2 炎症反应
炎症反应是机体对各种致炎因素引起损害而产生的一种基本病理过程。目前已经证实炎性因子能促使老年肌少症的发生[11]。炎症标志物如白介素-6(interleukin 6,IL-6)、C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等在老年人机体内显著升高,机体炎症反应加剧。这些炎症因子可以加速肌肉蛋白降解,最终导致老年人肌肉质量、力量及肌肉功能的降低[12]。王今越[13]等研究了p38、核因子κB(nuclear factor-kappa B,NFκB)、IL-6 在少肌症发生及其运动性缓解中的作用,表明运动可以拮抗衰老引起NF-κB、IL-6 等炎症因子变化,抑制肌肉蛋白降解引起的肌肉流失(少肌症)。林白阳[14]等研究发现IL-6、IL-10 浓度在老年慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)合并肌少症患者血浆中明显增高,表明炎症因子可促进蛋白酶体对肌肉蛋白的降解,为肌肉减少症发生的危险因素。因此,炎症加剧被认为是老年肌少症发生的重要原因之一。
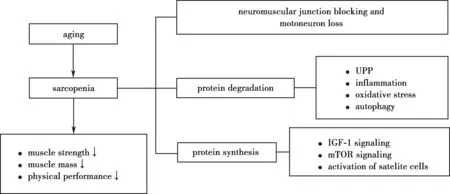
Fig.1 The pathological mechanisms of development of sarcopenia
1.2.3 氧化应激
衰老是机体健康水平和维持自身内稳态能力的退行性改变。神经/肌肉中活性氧的积聚导致机体衰老、线粒体DNA 损伤和肌细胞凋亡,从而加速肌少症的发展[15-16]。近年来研究者们从氧化应激的角度对肌少症进行了研究。Ramy[17]等采用NOD 样受体蛋白3(NOD-like receptor protein 3,NLRP 3)基因缺陷小鼠证明了由活性氧(reactive oxygen species,ROS)积累激活NLRP3 炎性小体相关酶的缺失可以减缓衰老导致的肌少症及线粒体损伤。因此,氧化应激也可介导肌少症的发生发展。
1.2.4 细胞自噬
衰老还可以引起线粒体功能异常,骨骼肌氧化应激反应与肌细胞凋亡增加,同时骨骼肌的收缩会产生衰老的细胞器和毒性蛋白等。为防止肌肉过度损伤,细胞自噬激活,但自噬过度激活会加速肌肉蛋白的降解,从而诱发肌肉组织的损伤。梁计陵[18]等综述了运动诱导细胞自噬在老年肌少症康复中的研究。Tomonori Sato[19]等研究了自噬在快速老P8 小鼠 (senescenceaccelerated mouse prone 8,SAMP8)肌少症小鼠体内的作用。由此可见,细胞自噬是肌少症发生发展的又一个重要成因。
1.3 与肌肉蛋白合成相关的通路
1.3.1 胰岛素样生长因子通路
胰岛素样生长因子(insulin like growth factor 1,IGF-1)具有促细胞存活及生长的作用,在骨骼肌蛋白合成中发挥重要角色[20]。Silvia Giovannini[21]等发现衰老所致生长激素(growth hormone,GH)和IGF-1水平降低,可致肌肉蛋白合成缓慢,肌肉质量和力量下降,GH/IGF-1 轴的调控可阻碍老年人肌少症的发展。
1.3.2 mTOR 信号通路
雷帕霉素靶蛋白(mammalian target of the rapamycin,mTOR)是一种丝氨酸/苏氨酸激酶,其参与的信号通路可调控细胞生长和周期,mTOR 信号通路的激活可以促进肌肉蛋白的合成,维持骨骼肌质量[22]。Olivier Le Bacquer[23]等通过对比基因双敲除真核起始因子4E结合蛋白1 和2(eukaryotic initiation factor 4E-binding proteins,4E-BP1/4E-BP2)小鼠与24 月龄的野生型小鼠,发现双基因敲除小鼠四肢抓力及自主活动均增加,肌肉蛋白合成也增加,并结合LC/MS 代谢组学技术,发现野生型衰老小鼠氨基酸稳态、碳水化合物及脂质代谢紊乱。mTOR 通过调控其下游靶点4E-BPs 来促进肌肉蛋白合成,减缓肌少症发生。
1.3.3 卫星细胞的激活
卫星细胞是骨骼肌的干细胞,位于骨骼肌纤维基底膜和肌膜之间的狭小空隙中。卫星细胞的激活可使机体发挥自我更新和定向分化的干细胞功能,促进肌肉蛋白合成,使衰老骨骼肌肥大,从而提升肌肉力量,延缓骨骼肌衰减[24]。卜凡[25]等研究了耐力运动可以维持老年小鼠肌卫星细胞的干细胞属性,通过促进肌纤维再生从而对骨骼肌进行修复。
此外,目前肠道菌群与RNA 干扰(RNA interference,RNAi)技术介导疾病的发病机制研究成为热点。肠道微生物重要的代谢物之一,短链脂肪酸(short-chain fatty acids,SCFAs),在衰老机体中含量降低,SCFAs 可以增加三磷酸腺苷(adenosine triphosphate,ATP)产生的相关蛋白通路,从而影响胰岛素的功能及骨骼肌的蛋白合成[26],因此,肌少症的发生与肠道菌群代谢物中SCFAs 关系较为重要。Martina Casati[27]也综述了肠道菌群紊乱,可以改变肌肉质量、与衰老相关的炎症和免疫、线粒体损伤与氧化应激,以及胰岛素抵抗,来影响骨骼肌稳态导致肌少症的发生。研究与肌肉组成、肌纤维、肌节功能相关的RNAi 也可以更好地筛选肌少症的发生机制[28]。另外,Iryna Rusanova[29]等综述了与肌少症机制相关的microRNAs,miR-21 和miR-206 在肌肉功能衰减者血清中升高;miR-146a,miR-155,miR-185 和miR-206 等在衰老骨骼肌中上调,而miR-148a和miR-434 发生下调等等。
综上可知,肌少症的发病机制较为复杂,目前并没有取得全面的认识。新技术的发展对于肌少症的发病机制研究与诠释提供了技术支撑。
2 肌少症治疗的研究现状
2.1 西医治疗肌少症现状
现代医学预防和治疗肌少症主要有运动疗法、营养(如肌酸[30]、亮氨酸[31]等)和饮食补充以及药物疗法,这些方法对一些肌肉衰减综合征患者有一定疗效,但也存在局限性。运动疗法不适用于老年人,以及伴有其他疾病需要长期坐轮椅、卧床休息的患者。肌少症的药物治疗尚处于初步探索阶段,查阅美国食品和药物管理局(Food and Drug Administration,FDA)网站(https://www.fda.gov/),尚无治疗肌少症的专属药物。有文献报道,使用血管紧张素转化酶抑制剂(angiotensinconverting enzyme inhibitors,ACEIs)可以提高心力衰竭患者的躯体活动能力[32];雄性激素(睾酮)水平降低可以导致肌肉力量和质量的减弱,补充雄激素后,肌肉质量增加,但其主要针对男性患者[33];β受体阻断剂可以改善衰老导致的肌少症状,尤其是肌肉质量的缺失[34]。Tab.1 总结了上述三种药物治疗肌少症的疗效指标。
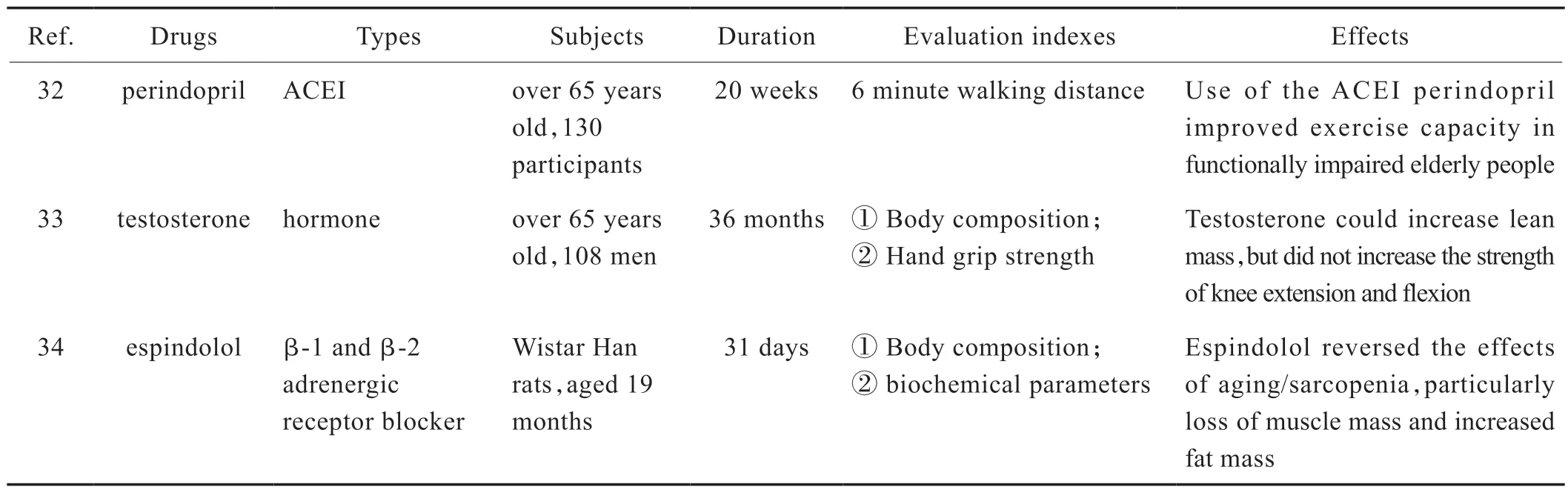
Tab.1 Evaluation of medicine and therapeutic effects on sarcopenia
总之,西医治疗肌少症的药物较少,且研究所使用的药物并不是以肌少症为主要适应症。
2.2 中医对肌少症的认识
传统中医并无肌少症之称,根据肌少症肌肉瘦削、软弱无力的特征,将其归属于“痿证”范畴,痿证是以肢体筋脉弛缓,软弱无力,不得随意运动,日久而致肌肉萎缩或肢体瘫痪为特征的病证。中医古籍中与肌量、肌力减少,肌功能下降的病证还有“肌极”“虚劳”等。《四圣心源》有云:“肌肉者,脾土之所生也,脾气盛则肌肉丰满而充实”[35]。《太平圣惠方》曰:“脾胃者,水谷之精,化为气血,气血充盛,营卫流通,润养身形,荣于肌肉也。”可见脾与肌肉的关系非常密切[36]。脾主运化为气血生化之源;肾藏先天之精,主骨生髓。由此,肌少症病位在肌肉,其病机可能在于年老肾衰、脾胃虚损、气血亏虚等。
根据中医对肌少症的病机认识,梁清月[37]等研究了加减八珍汤联合营养支持对老年性骨骼肌减少症患者的疗效,结果表明与对照组同期比较,试验组治疗后肌肉功能提高,步速、日常生活能力(activities of daily living,ADL)升高。温春瑜[38]等对补中益气汤加减辅助治疗老年肌少症的临床疗效进行观察,结果显示治疗后,观察组肌肉质量、肌肉力量、身体活动功能和日常生活能力均明显高于对照组。八珍汤[39]、补中益气汤加减辅助治疗老年肌少症,可有效改善患者躯体功能,增强肌肉力量,改善日常生活能力。徐划萍[40]等研究了补肾益气方(由制何首乌、肉苁蓉、黄芪和党参四味中药组成)可以增加D-半乳糖诱导的衰老大鼠的运动能力,提高骨骼肌线粒体数量及体积;王新梅[41]等研究了天麻多糖(gastrodia elata polysaccharide,GEP)可以提高D-半乳糖致衰老大鼠的肌肉力量和骨骼肌肌纤维横截面积。分析邓铁涛教授治疗脾胃肌病的处方,在治疗脾胃肌肉疾病中的高频药类以补益药为主,单味药物应用频次较高的前8 味药物依次是黄芪、五爪龙、甘草、白术、陈皮、党参、茯苓及升麻[42]。可见,中医治疗肌少症以益气健脾、气血双补为主,辅以补肾。通过辨证论治,选择合适的中药复方来取得疗效。
3 肌少症的疾病模型及评价研究现状
3.1 地塞米松诱导肌少症模型
地塞米松是一种糖皮质激素,有研究显示长期注射地塞米松可导致肌肉质量衰减和肌肉力量减弱[43]。地塞米松诱导的肌少症表现为体重下降、骨骼肌萎缩和胰岛素抵抗。王丛丛[44]等通过对昆明小鼠皮下注射地塞米松注射液10 mg·kg-1,发现连续注射10 天,从体成分分析、肌肉力量(抓力仪)、肌肉功能(转棒疲劳仪)三个方面进行评价,体成分中肌肉质量下降,小鼠的最大抓力显著下降,转棒掉落次数明显增加,肌少症模型复制成功。王月兵[45]等通过对昆明小鼠皮下注射地塞米松5 mg·kg-1,发现连续19 天后,小鼠肌肉质量和肌肉力量均明显低于空白组。但是激素造成的肌少症模型更关注长期注射、服用激素的人群,不能反映衰老所致的肌少症。
3.2 限制运动导致肌少症模型
王全全[46]等通过固定24 月龄C57BL/6 的小鼠头部和前肢,躯干与后肢与地面呈30°,导致小鼠运动缺失,腓肠肌湿重及肌纤维的横截面积下降,造成肌少症模型,并研究了人脐带华通氏胶间充质干细胞治疗肌肉衰减综合征。但这种方式更多研究的是航天员长期处于失重状态下肌肉质量的变化,不是由于年龄的增长这种生理状况而导致的肌肉衰减,不能很好的模拟增龄性的衰老所致肌肉质量、力量和功能下降。
3.3 D-半乳糖诱导肌少症模型
D-半乳糖大量注射机体后导致机体细胞内D-半乳糖无法被代谢而出现积累,从而累积大量活性氧,目前作为一种公认的、快速且经济的衰老模型制备药物[47-48]。有研究[49]以D-半乳糖诱导肌肉衰减综合征模型,对C57BL/6 小鼠腹腔注射D-半乳糖400 mg·kg-1,连续55 天,体成分中肌肉质量下降,转棒掉落时间增加。
3.4 自然衰老大小鼠肌少症模型
采用自然衰老的大小鼠研究肌少症可以更好地反映随着年龄的增长而导致的肌肉衰减,肌少症模型实验研究中常采用的自然衰老大小鼠品系有Wistar大鼠、SD 大鼠、C57BL/6 小鼠、BALB/c 小鼠,月龄有20 月龄、24 月龄、26 月龄等。Mohammed Mukhram Azeemuddin[50]等对比20 月龄Wistar 大鼠与3 月龄的青年大鼠,从肌肉质量、自主活动及耐力训练三个指标评价,结果发现,衰老大鼠的腓肠肌质量明显下降,肌肉病理学切片显示腓肠肌纤维数量变少,肌肉力量及自主活动均减弱。Olivier Le Bacquer[23]的研究表明了24 月龄衰老的BALB/C 野生型小鼠腓肠肌质量和握力明显低于4E-BP1/4E-BP2 双敲除小鼠。B.M.Meador[51]等采用自然衰老20 月龄的SD 大鼠作为肌少症模型组,研究了绿茶中多酚类化合物表儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)对其骨骼肌的影响,结果表明,模型组大鼠腓肠肌质量明显降低。
3.5 基因敲除小鼠模型
Sathyaseelan S.Deepa[52]等研究了Cu/Zn 超氧化物歧化酶基因敲除的小鼠表现出高度的氧化应激及线粒体损伤,可以加速肌少症的发生。此外,NLRP3 基因敲除的C57BL/6J 小鼠[17]、双基因敲除4E-BP1/4EBP2 的 BALB/c 小鼠[23]也被用来研究肌少症的病理机制。
综上所述,药理实验研究中常用的肌少症模型虽然选择的大小鼠品系、采用的诱导因素不同,但评价指标大多数围绕肌肉质量、肌肉力量和肌肉功能三个方面进行评价,与临床诊断较为接近。肌肉质量可以通过体成分分析仪得出肌肉含量,或对腓肠肌称重、观察肌纤维的横截面病理切面中肌纤维数目和大小等来评价。肌肉力量常采用大小鼠抓力仪或握力计进行测量。肌肉功能可以通过转棒疲劳仪的掉落次数、自主活动能力等指标评价。总之,研究肌少症选择合适的疾病模型,应从多方面综合评价,旨在为肌少症的发生机制研究及治疗药物的筛选奠定基础。
4 展望
肌少症是目前常见且重要的老年综合征,严重影响老年人的健康及生活质量,在老年医学领域越来越受关注。本文对肌少症的病理机制、目前中西医的治疗现状以及肌少症的疾病模型进行了综述,发现药理实验研究中肌少症的模型较多,但评价指标均是围绕肌肉质量、力量及功能三个方面;肌少症发生的病理机制较为复杂,涉及通路繁多;西医治疗肌少症选用的药物并不是以肌少症为主要适应症,成分单一,且有些疗效不明显。
中医药文化博大精深,中药复方具有多成分、多靶点、存在协同作用的特点,符合疾病发生的复杂机理,因此,可以从中医药宝库中挖掘预防和治疗肌少症的中药复方。本文提出以下研究思路:①肌少症是基于衰老的基础上发生肌肉衰减的一种老年性疾病,单一因素较难反映疾病特征,因此可通过复合因素来造模,如D-半乳糖结合限制运动等;②通过复制合理的动物模型,给予“益气健脾、气血双补”的中药复方,如八珍汤、十全大补汤、补中益气汤加减等等,结合与中药“整体观”相符合的代谢组学技术,对治疗肌少症的药物进行生物效应评价;③针对肌少症病理机制复杂的特点,可借助网络药理学推测作用机制,并通过肌源细胞C2C12 进行验证,或基因敲除小鼠验证相关通路;④采用血清药物化学、谱效相关等技术阐明中药治疗肌少症的药效物质基础,明确活性部位或活性成分。通过以上研究,可对中药治疗肌少症进行全面的质效评价,揭示肌少症的发生机制,阐明复方的药效物质基础,为研究预防和治疗肌少症的药物开辟新途径。
