铬取代针铁矿异化铁还原过程及铬的环境行为研究
2020-11-23王春童辉华健陈曼佳刘承帅
王春,童辉,华健,陈曼佳*,刘承帅,
1.广东石油化工学院生物与食品工程学院,广东 茂名 525000;2.广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650;3.中国科学院地球化学研究所/环境地球化学国家重点实验室,贵州 贵阳 550001
铬(Cr)自然环境中普遍存在的重金属之一,环境中铬的价态通常在-2到+6价之间,而+3价和+6价两种价态相对稳定(Fendorf et al.,2000),且Cr(VI)的毒性远远大于 Cr(III),具有强烈的“三致性”(Han et al.,2004)。随着我国工业化的快速发展,Cr及其化合物通过电镀、冶金、皮革鞣制、纺织染色等方式排放到环境中,造成不同程度的土壤Cr污染,危害农产品安全及人类的健康(Dotaniya et al.,2014)。已有研究表明,Cr在土壤中的环境行为与含量丰富的铁氧化物密切相关(Stewart et al.,2016),Cr可通过吸附铁氧化物表面,形成表面络合物或者沉淀物,影响Cr的迁移转化(Singh et al.,2002)。同时,由于 Cr(III)和 Fe(III)的离子半径十分接近(61.5 vs 64.5 pm),Cr(III)常与铁氧化物结构中的 Fe(III)发生取代进入晶格中形成 Cr取代铁氧化物,显著影响了Cr(III)的移动性,生物可利用性以及 Cr(III)向有毒 Cr(VI)氧化转化过程(Choppala et al.,2013)。因此,研究铁Cr取代铁氧化物的氧化还原、稳定性及 Cr的环境行为具有重要的土壤学和环境学研究意义。
铁氧化物作为土壤中具有较高地球化学活性和高含量的重要矿物,其氧化还原循环过程需要微生物提供基本驱动力(Borch et al.,2010;Roden,2003)。在厌氧还原条件下,土壤中的铁还原菌能以有机碳作为电子供体,以胞外不溶性铁氧化物为末端电子受体,通过氧化电子供体耦联Fe(III)还原,并从这一过程贮存能量(Kappler et al.,2005;Roden,2003),这一过程也称为异化铁还原过程。已有研究表明,土壤异化铁还原过程可通过氧化还原、甲基化以及固定等作用显著影响重金属形态转变、有效性以及迁移转化等(Bousserrhine et al.,1999;Burton et al.,2019;Zachara et al.,2001;毛晖等,2005;司友斌等,2015)。Burton et al.(2019)对异化铁还原过程中锑的迁移转化进行研究,结果表明游离态的锑可被固定在新生成的铁氧化物中,从而减少重金属的危害。毛晖等(2005)研究不同Cr(VI)浓度压迫下,水稻土的异化铁还原过程,结果表明,Cr(VI)参与水稻土的铁还原过程,在该过程中,Cr(VI)可被铁氧化物或微生物吸附,降低了Cr的可利用性和生物有效性;且高浓度的Cr(VI)对土壤中铁还原微生物具有毒害作用,从而抑制了水稻土的异化铁还原过程。反之,金属取代的铁氧化物在异化铁还原过程中,由于结构态Fe(III)的还原溶解,铁氧化物结构发生变化,结构中的重金属可被溶解释放,提高了重金属的移动性和可利用性(Zachara et al.,2001;张蕊等,2015)。Bousserrhine et al.(1999)研究表明,在Clostridiumbutyricum还原5% mol Cr取代针铁矿([Cr]/([Cr]+[Fe])为0.05)时,针铁矿发生还原溶解,固体中约8.46%的Cr释放到环境中。
尽管重金属取代铁氧化物的异化铁还原过程对重金属的影响已引起广泛关注和重视,但已有的研究仍集中在重金属取代弱晶型的铁氧化物(如Cr取代的聚合硫酸铁和Cr取代施氏矿物)(Wan et al.,2018;Li et al.,2016),对重金属取代的强晶型铁氧化物的生物还原溶解过程中铁物种和重金属的环境行为、矿物结构变化等,仍缺乏系统性的研究。因此,本研究以土壤中常见的Cr(III)取代的针铁矿(下文简称Cr取代针铁矿,Cr-Goe)为研究对象,将不同 Cr取代比例的针铁矿作为铁还原菌的唯一电子受体,探究Cr取代针铁矿的异化铁过程中Fe、Cr以及矿物结构变化特征,为土壤环境中Cr的迁移转化等行为提供理论依据。
1 材料与方法
1.1 针铁矿及铬取代针铁矿的制备
针铁矿和Cr取代针铁矿的合成主要参考已有文献报报道的方法(Schwertmann et al.,2000)。首先,将150 mL 5 mol·L-1的KOH溶液加入到250 mL 0.5 mol·L-1的 Cr(NO3)3溶液中在烧杯中混合均匀,制得碱性Cr溶液。分别量取0、3.3、8.4、8.4、30.5、75.3 mL上述配好的碱性Cr溶液,均依次加入 50 mL,1 mol·L-1Fe(NO3)3溶液和 5 mol·L-1KOH溶液(使得最终悬浮液中KOH的浓度为0.3 mol·L-1),最后加入超纯水定容到1 L。混匀溶液,并在70 ℃下老化30 d。接着,将老化的混匀液取出离心去除上清液,保留固体,用 3 mol·L-1H2SO4,于50 ℃下浸提固体2 h,去除固体中的无定型杂质。同时,用超纯水将固体样品清洗5次,并在70℃烘箱中干燥过夜,最后用研钵研磨过筛,得到所需的不同Cr取代的针铁矿,根据开始添加时[Cr]/([Cr]+[Fe])([Me]: mol·L-1)比例计算,其理论取代值分别为 0、2%,5%,16%和32%,并最终根据实际的Cr取代值,分别命名为Goe、1.4-Cr-Goe、3.5-Cr-Goe、9.03-Cr-Goe 以及10.3-Cr-Goe。
1.2 菌种来源和活化
本研究所采用的铁还原菌为Shewanella oneidensisMR-1,ATCC70050。菌体购于北京百欧博伟生物技术有限公司。菌体在30 ℃的LB液体培养基(成分为 10 g·L-1蛋白胨,5 g·L-1酵母粉,10 g·L-1的 NaCl)中培养 16 h,于 4 ℃ 6000 r·min-1条件下离心10 min,用灭菌超纯水洗涤重悬浮,重复3次,最终配成约1010cell·mL-1的菌悬液待用。
1.3 实验设计
在本实验开始前,对所有用到的实验器具和溶液进行标准的高压灭菌流程后在无菌超净台进行操作。在20.2 mL的西林瓶中依次加入哌嗪-1, 4-双(2-乙烷磺酸)(PIPEs)缓冲溶液、乳酸钠(电子供体)和铁还原菌ShewanellaoneidensisMR-1,混匀之后,加入针铁矿或不同Cr取代比例的针铁矿,最终培养溶液的总体积为10 mL,各物种的终浓度分别为 0.02 g 针铁矿,25 mmol·L-1(PIPEs)、10 mmol·L-1乳酸钠以及约 108cell·mL-1的Shewanella oneidensisMR-1。实验同时设置不添加铁还原菌的对照处理(CK:灭菌针铁矿+PIPEs+乳酸钠)。为达到最优的铁还原效果,本研究通过PIPES缓冲溶液将pH值控制在7.0左右。高纯氮气充气30 min排氧,然后用橡胶塞压紧,并用铝盖密封,置于厌氧培养箱中 (25±1) ℃静置培养。反应进行到设定的时间点,在厌氧箱中取样。首先取适量的样品用同体积的0.4 mol·L-1HCl进行提取浸提90 min,取出在离心机中10000 r·min-1转速下离心10 min,用针头过滤器(0.22 μm)过滤上清液并收集,用于游离态物质含量分析(He et al.,2008),而固体继续用同体积的浓HCl(约11.2 mol·L-1)进行溶解,待固体完全溶解之后进一步过滤收集液体,用于结构态物质含量分析(Hua et al.,2018)。上述两种液体样品进一步用于后续 Fe(II)和 Cr(III)物种的浓度分析。另取适量的样品,进行固液分离,收集固体,用于后续矿物结构表征分析。
每个样品设置3个重复,文中所示数据均为数据平均值。
1.4 测试与表征方法
游离态 Fe(II)物种的检测采用邻菲罗啉比色法,测试方法根据已有文献(Tamura et al.,1974)报道进行改进,具体步骤如下:取1 mL上清液,先加入50 μL浓盐酸进行酸化,依次加入50 μL 0.1 mol·L-1氟化铵,200 μL 1 g·L-1邻菲罗啉和 200 μL 5 mol·L-1醋酸缓冲溶液,充分混匀之后显色15 min,上机检测。分析仪器为紫外可见分光光度计(TU-1800,北京普析通用)。游离态和结构态Cr(III)物种的检测采用电感耦合等离子发射光谱仪(ICPOES,Perkin-Elmer optima 2000,USA)测定(Hua et al.,2018)。矿物的晶相结构分析,首先将矿物粉末压片,在X’Pert Pro MPD X射线衍射仪上进行衍射分析(XRD)。测试要求条件:Ni滤波片,Bragg-Brentano几何衍射,探测器为LynxBye阵列,Cu Ka(λ=0.154059 nm),管压40 kV,管流40 mA,步长为 0.02°,扫描速度为 1°·min-1或步长为 0.04°,每步积分时间为10 s。
1.5 数据分析
采用微生物生长曲线Logistic方程拟合异化铁还原过程(He et al.,2008)。所有数据采用Microsoft Office Excel 2010进行统计,SPSS 20.0进行方差分析,Origin 8.0进行做图。
2 结果与讨论
2.1 不同Cr取代针铁矿的性质特征
为验证合成不同Cr取代针铁矿过程中,Cr(III)离子是否进入矿物的晶体结构中,及其 Cr的真实取代量,对合成得到的矿物进行化学分析测试。使用0.4 mol·L-1HCl将吸附在固相表面的洗掉,再用浓盐酸完全溶解固体,测定固体中Cr浓度,并计算实际[Cr]/([Cr]+[Fe])比例(图 1)。结果表明,不同Cr取代针铁矿中 Cr的质量分数分别为 19.24、47.82、131.61 以及 152.15 mg·g-1,大部分 Cr离子进入到矿物结构中;同时计算 Cr取代的实际摩尔比例分别为1.4%,3.5%,9.03%以及10.3%,均小于理论计算值2%、5%、16%和32%。这是由于实验合成针铁矿的老化时间有限,Cr(III)离子不能全部进入固相中(Schwertmann et al.,1989)。
为验证合成的矿物结构为针铁矿,对矿物样品进行了XRD结构分析(图2)。通过与粉末衍射标准联合委员会数据库中针铁矿的特征峰进行比较发现,本研究所合成的固体矿物均为针铁矿;且随着针铁矿中越来越多的Fe(III)被Cr(III)取代,矿物XRD图谱中主峰位置(2θ)向左偏移(2θ值越小),晶格参数和晶胞体积都比纯针铁矿小(Hua et al.,2018)。Sileo et al.(2004)研究表明,针铁矿中Fe(III)周围原先被两个独立的FeO3(OH)3配体所包围,而当Fe(III)被Cr(III)取代之后,其周围形成更加对称的 Cr(OH0.5)6的多面体,从而缩小金属离子之间的距离,进一步引起晶格和晶胞参数的变化。

图1 Cr取代针铁矿的比例以及针铁矿中Cr的含量Fig.1 The percentage of mol [Cr]/[Cr+Fe] and the concentration of Cr in the goethite
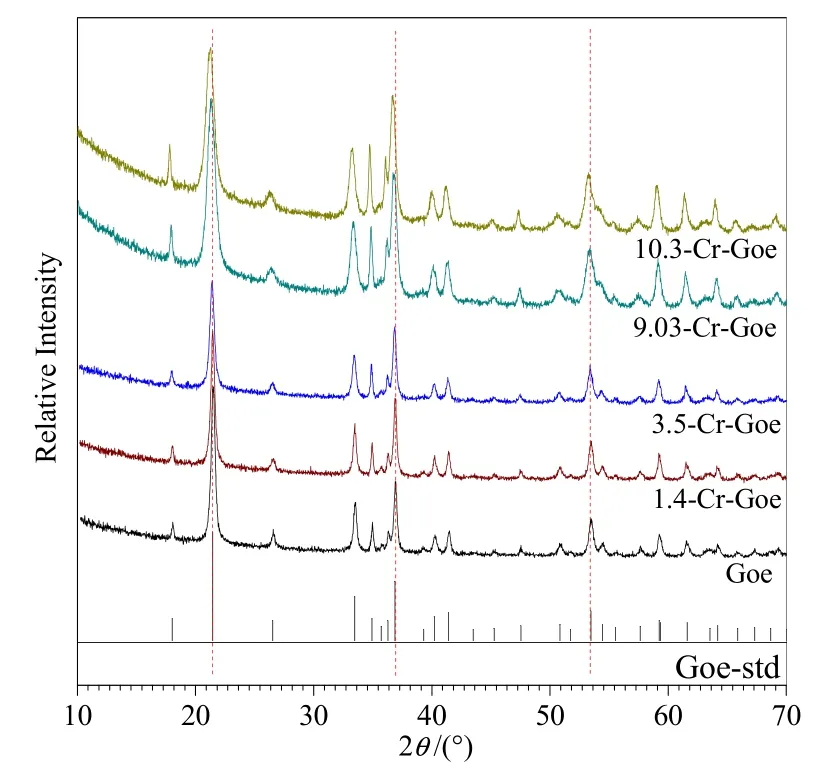
图2 合成的针铁矿及Cr取代针铁矿XRD谱图Fig.2 XRD patterns of the synthesized goethite and Cr substituted goethite
2.2 异化铁还原动力学
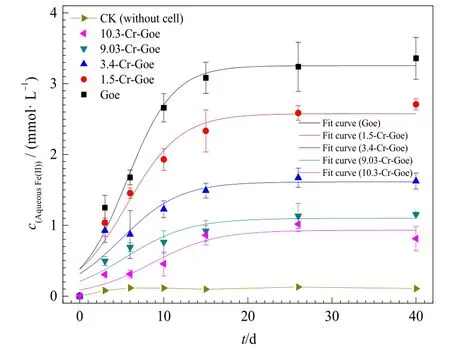
图3 不同Cr取代针铁矿的微生物铁还原动力学及拟合曲线Fig.3 The rate of the total Fe(II) concentration profile for 5 Cr substituted goethite samples using logistic model fitting
体系中不同Cr取代针铁矿的微生物还原动力学如图3所示。不加菌的对照处理(CK)中,基本未检测出Fe(II)的存在,说明没有铁还原菌Shewanella oneidensisMR-1作用时,针铁矿未能发生还原溶解。在添加ShewanellaoneidensisMR-1(针铁矿+菌)处理中,体系中游离态Fe(II)的含量在反应前15 d快速增长,随后出现缓慢增加的趋势。这可能是由于系统中的乳酸钠电子供体被消耗,微生物未能持续快速生长(He et al.,2008;Liu et al.,2001)。在反应40 d 时,约 3.36 mmol·L-1的 Fe(III)被ShewanellaoneidensisMR-1 还原生成 Fe(II)。Liu et al.(2001)利用铁还原菌Shewanellaputrefaciensstrain CN32还原针铁矿发现,在10 mol·L-1乳酸作为电子供体的情况下,反应26 d之后,约11%的针铁矿被还原,生成约 3.8 mol·L-1的 Fe(II)。与之相比,本研究中ShewanellaoneidensisMR-1铁还原菌对针铁矿具有相类似的还原能力。而随着针铁矿中的 Fe(III)被Cr(III)取代,游离态Fe(II)量受到限制,但不同处理异化铁还原动力学仍呈现先快速增长后平缓趋势(图3)。在反应40 d之后,1.5%、3.4%、9.03%以及10.3% Cr取代的针铁矿中分别仅有2.71、1.63、1.15和 0.81 mmol·L-1游离态 Fe(II)生成,说明铁还原菌ShewanellaoneidensisMR-1具有还原Cr取代针铁矿的能力,且铁还原效率呈现 Goe>1.5-Cr-Goe>3.4-Cr-Goe>9.03-Cr-Goe>10.3-Cr-Goe的规律。
2.3 异化铁还原过程中Cr的环境行为
为探究不同 Cr取代针铁矿异化铁还原过程中Cr(III)的赋存状态,本研究同时测定反应过程中游离态和残渣态Cr(III)浓度变化(图4)。由于研究体系的pH值为7.0,在此条件下,Cr(III)未能以溶解态形态存在(Beverskog and Puigdomenech,1997)。结果表明,在反应的前15 d,1.5-Cr-Goe、3.4-Cr-Goe、9.03-Cr-Goe和 10.3-Cr-Goe反应体系中,游离态Cr(III)的浓度呈快速上升的趋势,分别可达到1.22、2.28、21.20以及30.42 mg·g-1(图4a);随后趋向相对稳定,并逐渐下降;最终反应体系中分别有2.49%、3.10%、12.97%和13.69%的Cr(III)被释放到环境中。这表明了在不同 Cr取代针铁矿的异化铁还原过程中,Cr(III)会随着 Fe(III)还原溶解而从矿物结构中释放。然而,不同Cr取代针铁矿异化铁还原过程中残渣态Cr(III)的浓度呈现相反动力学趋势(图4b)。在反应的前15 d,残渣态Cr(III)的浓度快速降低,随后趋向相对稳定,并逐渐上升趋势。前人研究指出,金属取代的铁氧化物在铁还原菌作用下,矿物会发生还原溶解从而释放出重金属离子(Bousserrhine et al.,1999;Li et al.,2016);同时,在矿物进一步二次成矿过程中,游离态的重金属会再次被固定到矿物当中(Burton et al.,2019;Li et al.,2016)。近些年研究也表明,游离态Fe(II)可催化铁氧化物晶相重组,铁氧化物晶体结构中取代的重金属可随矿物的晶相重组过程释放到环境中,形成游离态重金属。同时,游离态重金属离子(如Cd、Al、As、Cr等)在矿物晶相重组过程中,可通过化学键形式吸附固定或者是重金属取代新生成铁氧化物结构中的部分Fe(III)位,被稳定/固定在新生成的矿物结构中(Hua et al.,2018;Liu et al.,2019;刘亚楠等,2018)。而在本研究当中,以10.3-Cr-Goe体系为例,可发现游离态Cr(III)质量分数从0增加到20.84 mg·g-1;而固体中(结构态)Cr(III)的质量分数则从 149.34 mg·g-1降低到 124.55 mg·g-1。其他体系与之类似,其游离态 Cr(III)与结构态Cr(III)浓度变化动力学呈现相反规律,且二者之和呈现稳定不变的趋势(图4c),即游离态Cr(III)增加或减少的量约等于结构态中(III)减少或增加的量。由此可推测,Shewanella oneidensisMR-1还原不同Cr取代针铁矿过程中,结构态Cr(III)逐渐从针铁矿结构中释放,吸附在针铁矿表面,形成游离态Cr(III);随着异化铁还原的进行,游离态Fe(II)可催化针铁矿二次成矿,而释放出来的Cr(III)部分可被重新固定在针铁矿结构中。

图4 不同Cr 取代针铁矿异化铁还原过程中游离态、结构态和总Cr(III)浓度变化动力学Fig.4 The concentrations of (a) extracted, (b) solid, and (c) total Cr(III) during microbial reduction of 0.02 Cr-goethite, 0.05 Cr-goethite,0.16 Cr-goethite, and 0.32 Cr-goethite over 40 d
2.4 矿物结构变化
为考察不同 Cr取代针铁矿异化铁还原过程中矿物结构的变化,本研究采用 XRD对不同反应时间下(10 d和40 d)矿物的结构进行表征(图5)。由图可知,反应中期(10 d)和反应后期(40 d),Goe、1.5-Cr-Goe、3.4-Cr-Goe、9.03-Cr-Goe和10.3-Cr-Goe反应体系中,矿物的XRD图谱中衍射峰均为针铁矿的特征衍射峰,具有较高的结晶度;同时,并未观察到新的矿物特征衍射峰出现。Liu et al.(2001)研究表明,针铁矿在铁还原菌Shewanella putrefaciensstrain CN32作用下可二次成矿生成菱铁矿(FeCO3)和针铁矿。游离态Fe(II)催化针铁矿晶相重组过程,针铁矿晶相重组新生成的矿物仍为针铁矿(Handler et al.,2009;Hua et al.,2018)。由此可推测,本研究中不同 Cr取代针铁矿在铁还原菌Shewanella oneidensisMR-1作用下可能发生二次成矿,新生成的矿物仍为针铁矿。
2.5 Cr取代量对针铁矿稳定性影响

图5 不同Cr取代针铁矿异化铁还原过程中矿物结构XRD图谱Fig.5 XRD patterns of the Cr substituted goethite during microbial reduction
前人研究表明,土壤的微生物铁还原过程符合微生物生长曲线,常采用 Logistic方程(Nt=a/(1+be-kt))进行模拟,以便更准备计算异化铁还原速率等信息(Chen et al.,2014;He et al.,2008)。本研究采用 Logistic方程对铁还原菌Shewanella oneidensisMR-1还原不同Cr取代针铁矿过程进行拟合分析(图3),其中a代表游离态Fe(II)的最大生成量,b是一个拟合参数,k是异化铁还原速率,Nt代表体系中t时刻体系中游离态Fe(II)的含量。拟合数据表明,Goe、1.5-Cr-Goe、3.4-Cr-Goe、9.03-Cr-Goe和10.3-Cr-Goe反应体系中异化铁还原速率k分别为 0.3596、0.3135、0.2866、0.2638以及0.2637 d-1(图6)。与无Cr取代针铁矿相比较,Cr取代针铁矿的铁还原速率显著降低(P<0.05),其生物稳定性提高。对铁还原速率与 Cr的取代量进一步统计分析发现,不同 Cr取代针铁矿的异化铁还原速率与 Cr的摩尔取代量呈指数关系(R2=0.9995,P<0.001)(图 6)。Sileo et al.(2004)对人工合成的 Cr取代针铁矿进行热力学性质分析发现,随着Cr取代量的增加,矿物会形成更加稳定的团聚体,使得针铁矿的结构更加稳定,难以向赤铁矿转化。Wan et al.(2018)利用Shewanella oneidensisMR-1对Cr(VI)-施氏矿物进行还原表明,矿物中附载的Cr(VI)量增高时,施氏矿物表面由原本的粗糙云状变成刺猬状,颗粒团聚变大,从而提高了矿物的生物稳定性。由此推测,在本研究中,随着Fe(III)被Cr(III)取代,针铁矿的结构越来越稳定,其生物稳定性也大大提高。当Cr(III)离子的取代量达到9.03%时,微生物还原Cr取代针铁矿生成Fe(II)的速率趋向稳定,可达0.26 d-1。在不同Cr取代针铁矿异化铁还原过程中,随着 Cr取代量的增加,矿物生物稳定性更高,释放到环境中Cr(III)的浓度将会达到一个最大平衡值。
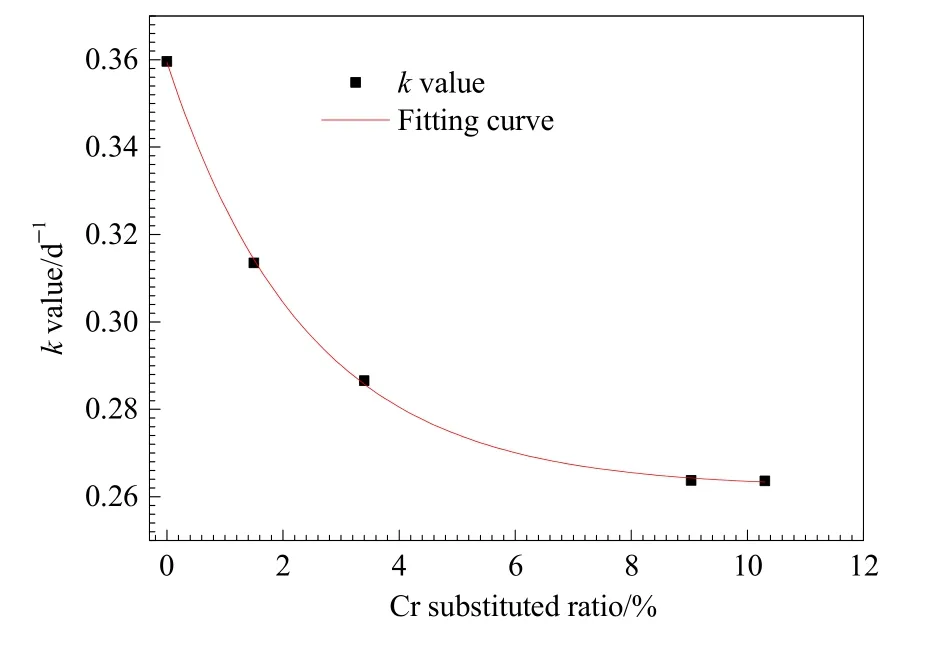
图6 铁还原速率与针铁矿中Cr取代量的关系Fig.6 The relation between iron reduction rate and the mol ratio of Cr substituted in goethite
3 结论
本研究以不同 Cr取代针铁矿为电子受体,以乳酸钠为电子供体,研究铁还原菌Shewanella oneidensisMR-1对不同Cr取代针铁矿的还原作用及过程中Cr(III)的释放固定行为,实验结果表明,ShewanellaoneidensisMR-1对纯针铁矿或Cr取代针铁矿菌均具有还原能力,且随着针铁矿中Cr(III)的取代量增加,还原作用效果越来越弱。在反应时间内,不同Cr取代针铁矿反应体系中,游离态Fe(II)含量呈快速增长后平稳的趋势,且铁还原速率k的大小顺序为 Goe>1.5-Cr-Goe>3.4-Cr-Goe>9.03-Cr-Goe>10.3-Cr-Goe。同时,游离态Cr(III)的含量则呈快速增长后降低的趋势;残渣态中Cr(III)的含量则与游离态 Cr(III)呈相反规律,说明不同 Cr取代针铁矿异化铁还原过程中,矿物结构中的Cr(III)可被释放并重新固定到矿物中。
