菊科植物环肽研究进展
2020-11-23杨勇勋
杨勇勋,颜 瑜
(1.西昌学院 动物科学学院,四川 西昌 615000;2.西昌学院 图书馆,四川 西昌 615000)
植物环肽(Plant cyclopeptides)一般是指高等植物中由非环肽(直链肽)通过酰胺键、醚键、二硫键,或通过一个新的C-C、C-N、N-O或C-S键形成的一类环状含氮化合物。目前发现的植物环肽主要是由2~37个编码或非编码氨基酸,且主要是L-构型的氨基酸组成。到2005年,已从分属26个科、65个属、120个种的高等植物中分离鉴定出约455个植物环肽,其中大部分的植物环肽来自于石竹科Caryophyllaceae和鼠李科 Rhamnaceae植物[1-2]。
菊科为植物界第一大科,广布全世界,约有1 000属,25 000~30 000种,热带较少。我国约有200余属,2 000多种,分布于全国各地[3]。此前一直认为菊科植物环肽只涉及紫菀中的氯化环五肽类,但近期又从菊科其他植物中发现了环肽生物碱以及数十个基因编码的均环肽,即两大类环肽:①均环肽:紫菀氯化环五环肽[1,4-6],基因编码的PDP(PawS-derived Peptides)[7]和PLP(PawL-derived Peptides)环肽[8-9];②杂环肽:绒毛戴星草中的环肽生物碱subfractions Ⅰ和Ⅱ[10-12]。
目前,菊科植物环肽的生物活性、作用机制、生源合成途径等研究方面取得了长足的进展,如最具有代表性的紫菀环肽astins类化合物具有显著的细胞毒性,而且其中的astin B活性最强[5]。构效关系研究显示其细胞毒性与肽链是否成环、氯代,环的构象以及肽脯酰胺键的顺/反式(cis/trans)构象等因素有关[13-15]。研究还显示astin C具有免疫调节活性,紫菀的止咳、祛痰活性与紫菀环肽类化合物有关[16],PDP环肽SFTI-1(27)具有蛋白酶抑制活性等[7]。
鉴于菊科植物广布于全世界,且种类较多,因此从中发现种类繁多的新颖结构的生物活性环肽还存有巨大的潜力。此外,近期研究还在菊科植物中环肽的抗肿瘤活性、免疫抑制的作用机制与作用靶点、生源合成途径、生物技术培养生产等方面取得积极进展。因此,本文对当前菊科植物环肽的来源、分类、合成途径、化学结构、生物活性、作用机制及构效关系等进行全面的综述,以期为菊科植物环肽的深入研究与开发提供参考。
1 化学结构
1.1 第Ⅰ类:均环肽
1.1.1 亚类Ⅰ:紫菀环肽 目前,从紫菀根和根茎中共分离得三类环肽类化合物:第1类为氯化环五肽[5,17-20]、astins A-I(1-9)、K-P(10-15);第2类为第1类紫菀氯化环五肽的水解开环直链肽[21-23]、aster J(16)和asterinins A-F(17-22);第3类为一类结构新颖的具一个Δ2,4脯氨酸侧链的环四肽化合物tataricins A-B[6](23-24),氨基酸组成与第Ⅰ类类似。结构见图1。
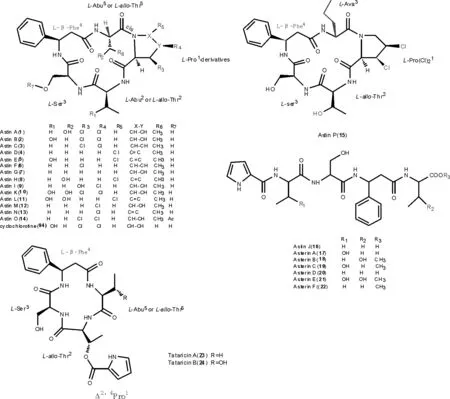
图1 紫菀环肽astins A-I (1-9),K-P (10-15),astin J,asterins A-F(17-22)和tataricin A-B(23-24)的结构(以脯氨酸为第1氨基酸编号)
1.1.2 亚类Ⅱ:菊科PawS基因编码的PDPs环肽 此类环肽由12~21个编码氨基酸头尾环合而成,含2个半胱氨酸,具有1个二硫键。此类环肽首先从向日葵种子中分离得到,如SFTI-1(27)[7,24-26]和SFT-L1 (SFTI-Like1)[27],结构见图2。随后,从菊科多种植物中通过LC/MS/MS技术发现多个与SFTI-1(27)、SFTI-L1(28)结构类似的PDPs环肽,部分结构还通过化学合成途径证实,其具体的名称、氨基酸序列及来源见表1[28],其中,PDP-10、PDP-11为直链肽。
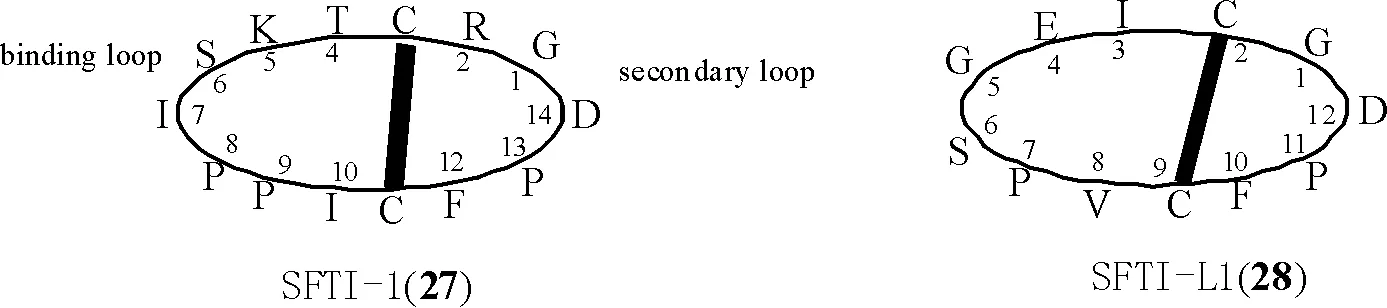
注:文中的编码氨基酸缩写表示如下(下同):A=alanine;C =cysteine;D =aspartic acid;E = glutamic acid;F = phenylalanine;G =glycine;H =hystidine;I= isoleucine;K =lysine;L =leucine;M =methionine;N =asparagine;P = proline;Q =glutamine;R =arginine;S =serine;T = threonine;V = valine;W =tryptophan;Y =tyrosine
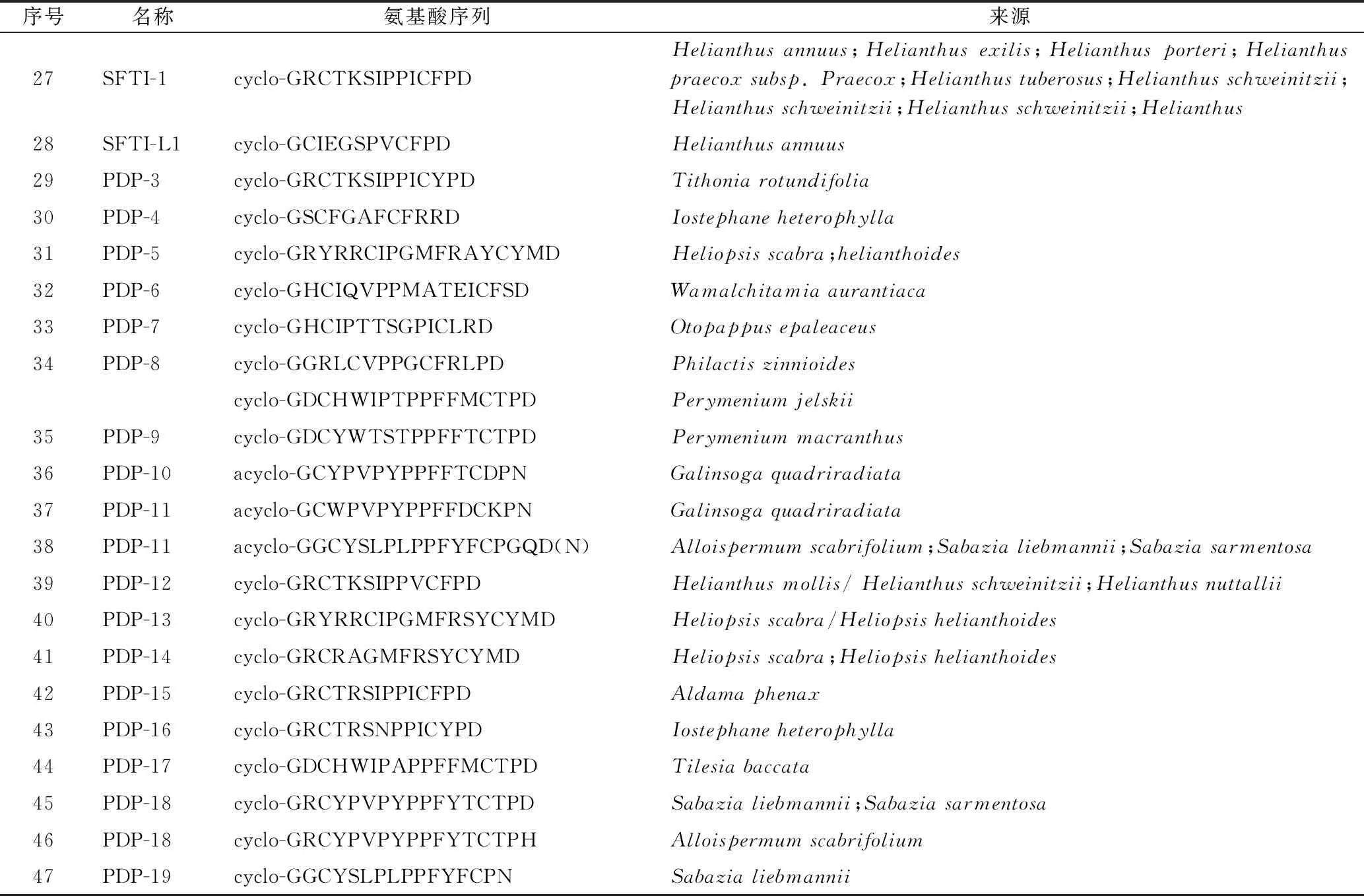
图2 环肽化合物SFTI-1(27)和SFTI-L1(28)的化学结构(粗实线代表二硫键;以甘氨酸为第1氨基酸)
1.1.3 亚类Ⅲ:菊科PawL基因编码的PLPs环肽 此类环肽由5~12个编码氨基酸头尾环合而成,很少含有半胱氨酸(cys),无二硫键,如小百日菊(Zinniahaageana)植物中的 PLP-1 (cyclo-AIIPGLID)(48)和千里光属(Seneciopinnatifoliusvar.maritimus)植物中的PLP-2 (cyclo-DLFVPPID)(49)[8-9]。
到目前为止,共从17种菊科植物中鉴定出46个PLPs型环肽[9]。其具体名称、氨基酸序列、来源见表2,部分结构见图3。
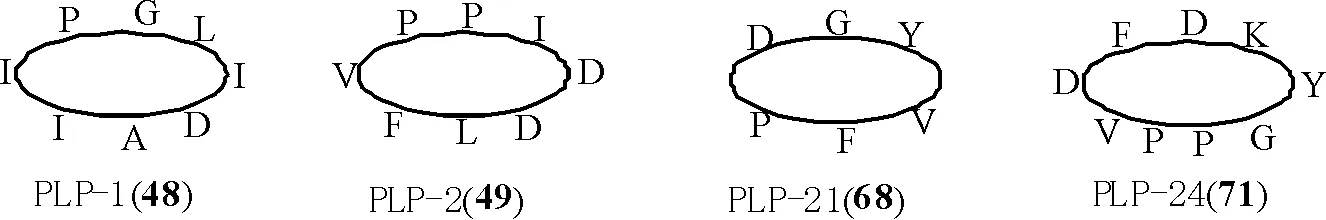
图3 菊科植物中的部分PLPs型环肽结构
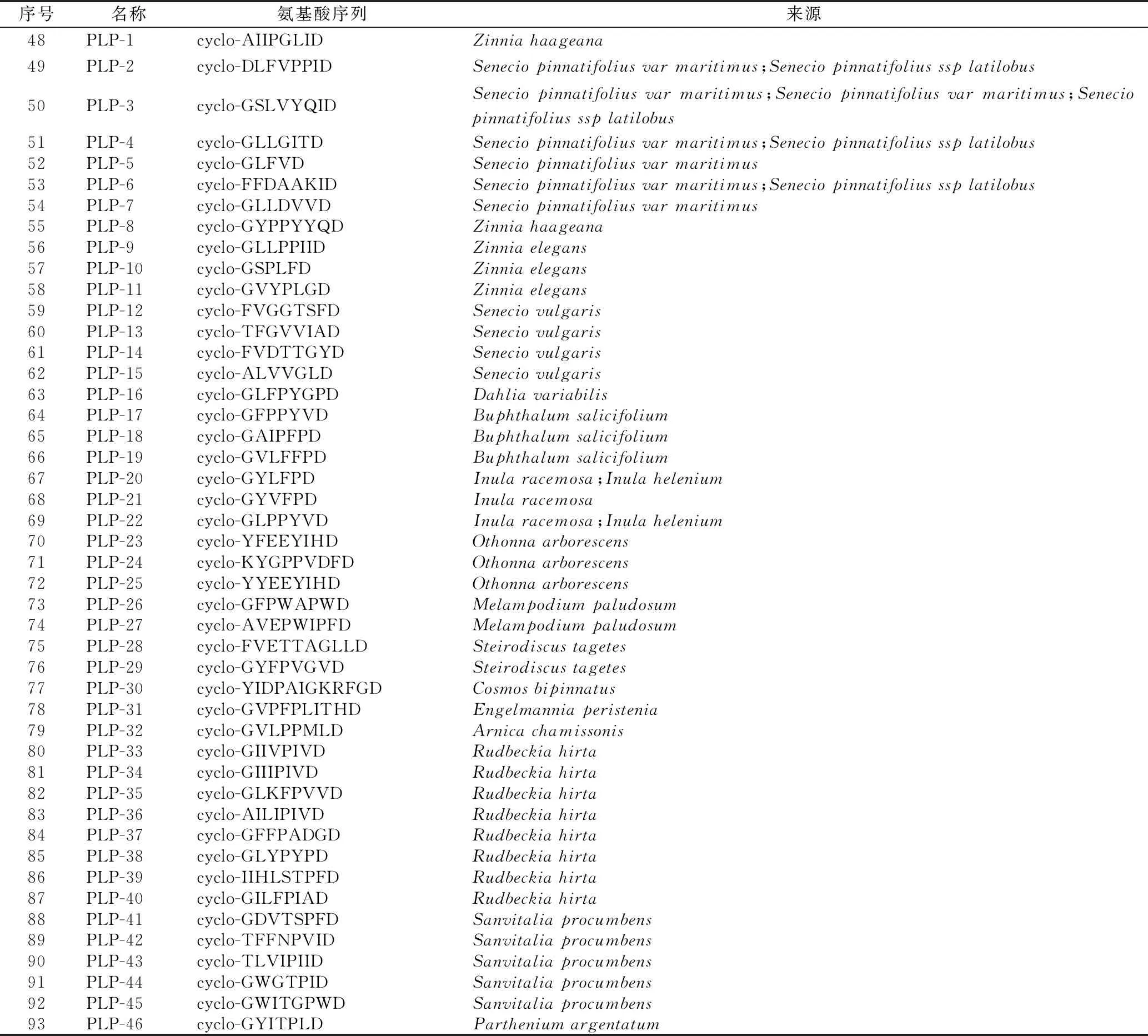
表2 菊科植物中的PLPs环肽
1.2 第Ⅱ类:杂环肽、环肽生物碱、绒毛戴星草环肽
从绒毛戴星草(S.indicus)花[12]中分离得两个生物碱subfractions Ⅰ和Ⅱ(25-26)[29-30],结构见图4。
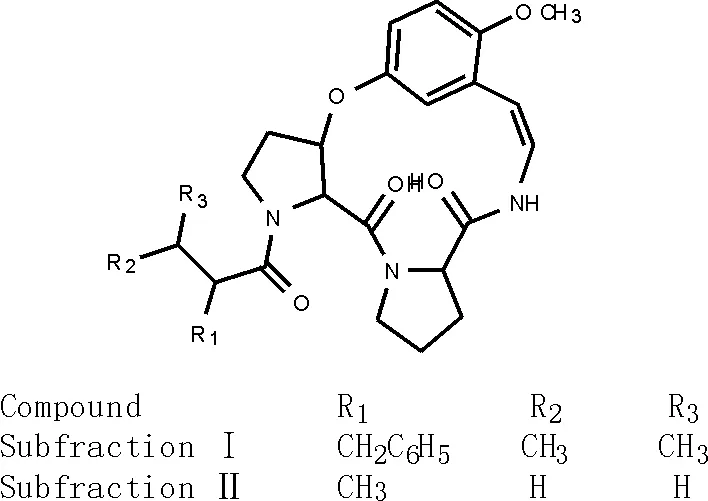
图4 绒毛戴星草环肽subfractions Ⅰ 和Ⅱ(25-26)的化学结构
2 生物活性
2.1 抗肿瘤活性、构效关系及作用机制
Morita H等[5]通过细胞压积法(total packed cell volume method),以小鼠腹水肉瘤180(sarcoma 180 ascites)为模型,以肿瘤细胞生长比GR(%)为评价指标,对紫菀环肽astins A-C(1-3)的抗肿瘤活性进行了研究。研究揭示了astins A和B具有显著的抗肿瘤活性,而且其活性是astinC的10倍。
随后,更多的研究将目光集中于其构效关系上。研究结果显示,环肽的细胞毒活性与肽链是否成环、环的构象,尤其是1,2-肽脯酰胺键的顺、反式结构、氯代、硫酰化、羟基数目多少等有关[20,22,31-36]。
紫菀环肽astins的抗肿瘤活性是通过caspase介导的凋亡机制实现,即astins连续地激活caspases 8和 9信号通路,进而相应地激活caspase 3效应器[37]。
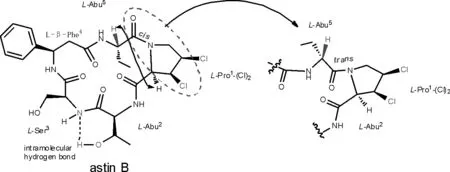
图5 astin B的结构以及关键的NOE相关和分子内氢键
2.2 免疫抑制活性、构效关系及作用机制
1990年,Smirnov等[38]首先报道了astin C (原名asterin 3)具有免疫调节作用,其作用机制与T-细胞免疫调节和T-依赖免疫反应相关。
2011年,Shen等[39]报道astin C在体内、体外的免疫活性研究成果:在来自于Fas-mutated MRLlpr/lpr小鼠的激活T细胞中观察到astin C通过线粒体依赖途径介导T细胞凋亡;在激活的T细胞中,astin C导致caspase 9和caspase 3裂解,下调Bad蛋白的表达以及细胞色素c的释放。此外,给小鼠饲喂astin C对抗TNBS-介导的结肠炎体外实验证实astin C能有效降低血清中TNF-α、IL-4、IL-7水平,诱导活化的T细胞凋亡。实验证明了astin C能有效抑制激活T细胞的增殖,提示其具有治疗结肠炎的潜力。
构效关系研究结果显示:含D-型氨基酸、亲脂长链烷基取代、芳基取代的衍生物比具有亲水氨基酸和短链烷基取代的衍生物活性强。此外,研究结果[40]也显示,3,4-二氯脯氨酸残基对astin C发挥免疫抑制作用起到了关键作用。
进一步的astin C免疫抑制活性的作用机制研究[41]则显示,astin C的作用机制是抑制CGAS-STING信号通路,因此astin C可作为调控STING信号通路介导的临床疾病,如肿瘤、自身免疫性及自身炎症疾病。
2.3 祛痰、止咳与抗炎活性
YU P等[16]将紫菀根的70%乙醇提取物分为3个流分:Fr-0、Fr-50和Fr-95,采用气管酚红分泌法对以上3个流分进行祛痰活性测试,活性最强的部位再采用小鼠酚红分泌、氨水诱发的咳嗽、二甲苯致耳肿胀实验评价其祛痰、止咳及抗炎活性。其还采用HPLC-Q-TOF/MS法对活性部位的化学成分进行分析,研究结果显示紫菀具有止咳、祛痰及抗炎活性,同时也证实了这些活性与紫菀环肽相关。
2.4 蛋白酶抑制活性
SFTI-1(27)具有多种酶抑制活性,其中抑制小牛β-胰蛋白酶的活性最强,为亚纳摩尔级别的抑制活性,即其化学计量比为1∶1,解离常数Ki值为 0.1 nmol/L (100 pmol/L)。SFTI-1(27)还具有抑制组织蛋白酶G(cathepsin G) (Ki~<0.15 nmol/L)、弹性蛋白酶(elastase) [Ki~(105±12)μmol/L]、胰凝乳蛋白酶(chymotrypsin)[Ki~(7.4±1.5)μmol/L],以及凝血酶(thrombin) [Ki~(136±21)μmol/L]的活性,但未观察到对凝血因子Xa (Ki>1 mmol/L)的抑制活性[7]。
2.5 肝毒性
紫菀环肽astins为二氯代脯氨酸环五肽化合物,其与源自于岛青霉菌penicilliumislandicum的代谢产物环氯霉毒素cyclochlorotine(94)的结构非常相似,但目前仅报道asterin (astin C,3)具有肝毒性[4]。而研究认为astin B(2)不具有肝毒性的原因是其结构中的肽脯酰胺键是顺式(cis)构象,而环氯霉毒素(94)中的肽脯酰胺键是反式(trans)构象[13](图5)。但是近年研究证实紫菀环肽,尤其是astin B也具有肝毒性[16-17],因此,紫菀环肽astins的肝毒性应引起重视。
3 紫菀环肽astins的生物合成途径与生物技术生产
紫菀astins环肽的生物合成途径尚未阐明,一般认为其是由紫菀植物代谢产生,通过非核糖体肽合成酶(NRPs)合成,因为astins结构中含有非编码的氨基酸,且NRPSs能够利用大量非蛋白源(非基因编码氨基酸)氨基酸底物合成非核糖体肽[42]。然而,源自岛青霉菌penicillium islandicum的代谢产物环氯霉毒素cyclochlorotine(94)的结构与astins的结构相似性[43]却提示astins可能是源自于真菌的代谢产物。
近期有一项研究[44]显示astins可能源自于真菌:从一株紫菀A.tataricus花序中分离的植物内生真菌Cyanodermellaasteris代谢产生了多个astins类化合物,如asin C(3),但不产生astin A、astin D、astin H等。在未感染植物内生真菌C.asteris的紫菀植物中不会产生astins环肽,而如果紫菀植物再次被感染植物内生真菌C.asteris时又会产生astins环肽,其中包括astin A(1)等,即植物内生真菌C.asteris单独发酵不产生代谢产物。因此,研究结果提示astin A等astins类环肽既不是单独由紫菀植物也不是单独由植物内生真菌产生,而是由植物-真菌二者复合共生交叉代谢产生[45-46]。
鉴于astins环肽在紫菀植物中的含量很低,即astins A-C在植物中的含量分别仅有5.02、2.96和1.03 mg/g[47]。如果采用全合成的方法来合成astins步骤多,合成前体价格昂贵,尤其是二氯脯氨酸不常见,从而阻碍了astins环肽的全合成工业发展。然而,植物内生真菌C.asteris的分离及其代谢产物的分离鉴定使利用生物技术方法大规模生产astins展现出光明的前景。VASSAUX A等[48]采用细胞固定培养技术,在优化的培养条件下,astin C的产量可达植物提取量的5倍(真菌:0.89 mg/g;植物:0.16 mg/g),因此,该生物技术方法生产astin C的效率远远超过工业生产的要求。而且由于采用的是固定化培养技术,下游的分离与纯化工艺更加便利,成本更低。
4 结语
在2006年以前,紫菀中的astins环肽被归类为杂环肽类下的菊科型环肽(Compositae-type cyclopeptides),这是由于当时仅从紫菀中发现了氯化环五肽。而现在,其他植物中也发现了环肽生物碱以及几十个基因编码的PDPs与PLPs环蛋白(均环肽),因此,继续将紫菀植物中的astins类氯化环五肽继续归类为菊科环肽已似有不妥。
紫菀环肽中的astin B具有显著的抗肿瘤活性,astin C具有显著的免疫抑制活性,但不能因为其肽脯酰胺键的cis构象与结构类似的真菌代谢产物环氯霉毒素cyclochlorotine(94)的肽脯酰胺键的trans构象不同而认为它们不具有肝毒性。具有显著活性的astin B和C的构效关系、构毒关系以及作用机制研究应得到重视。
此外,基因编码的PDPs与PLPs环肽在菊科植物中的分布还显示出分类学上的特征[9,28],因此,它们可能在解决菊科分类的困难上发挥作用。
菊科植物众多,且大多数为常用中药,具有广泛的临床应用。因此,继续从中发掘结构新颖的生物活性环肽,并阐明其生物活性、协同增效关系、生物合成途径等,将会是未来研究的热点。
