小儿解表颗粒对发热大鼠的解热作用及机制研究
2020-11-23熊海均甘青霞彭诚艺黄勤挽汤婷婷耿福能
熊海均,甘青霞,彭诚艺,黄勤挽,王 瑾,汤婷婷,耿福能*
(1.成都中医药大学 药学院,四川 成都 611137;2.好医生药业集团有限公司,四川 成都 610031)
小儿解表颗粒是治疗小儿外感风热所致感冒的常用中成药[1],收载于2010版、2015版《中国药典》(一部),由金银花、连翘、炒牛蒡子、蒲公英、黄芩、防风、紫苏叶、荆芥穗、葛根、人工牛黄 10味中药组成[2],其药效较为温和[3],有助于改善患儿的临床发热症状,且不会增加不良反应,具有进一步应用和推广的临床价值[4]。本实验通过利用大鼠复制LPS、2,4-二硝基酚和干酵母3种不同的发热模型,明确小儿解表颗粒的解热作用,并对2,4-二硝基酚发热模型进行解热机制研究,从而为进一步推广小儿解表颗粒的临床应用提供科学的实验依据。
1 材料
1.1 药物
小儿解表颗粒(国药准字Z51021319,批号:180232,四川好医生药业集团有限公司);柴黄颗粒(国药准字Z19993380,批号:180402,四川百利天恒药业股份有限公司);小儿柴桂退热颗粒(国药准字Z20050716,批号:180339,葵花药业集团襄阳隆中有限公司)。
1.2 试剂
2,4二硝基酚(批号:2015110101,成都市科龙化工试剂厂生产);LPS(脂多糖),来源于大肠杆菌O111:B4,货号:L2630,Sigma公司;高活性干酵母粉,安琪酵母股份有限公司;大鼠NO ELISA试剂盒(96T)(批号:YCFTYZ7A44),大鼠PGE2ELISA试剂盒(96T)(批号:6F3FY33UXJ),大鼠GHRL ELISA试剂盒(96T)(批号:4V74BN51TP),武汉伊莱瑞特生物科技股份有限公司;大鼠IL-1β ELISA试剂盒(96T)(批号:A301B80834),大鼠IL-6ELISA试剂盒(96T)(批号:A30680851),大鼠TNF-αELISA试剂盒(96T)(批号:A38280733),大鼠IFN-γ ELISA试剂盒(96T)(批号:A38080214),杭州联科生物技术股份有限公司。
1.3 动物
SPF级SD大鼠,雄性,体重180~220 g,由成都达硕生物科技有限公司提供,动物合格证号:SCXK(川)2015-30。
1.4 仪器
YP30002型电子秤,感量:0.01 g,最大称量:3 000 g(上海越平科学仪器有限公司);医用体温计,型号:MMC-W201,测量范围:32.0~42.0 ℃(北京小米科技有限责任公司);UPH-Ⅰ-10T超纯水器(成都超纯科技有限公司);AUW220D型十万分之一电子天平(日本岛津制作所);L550型台式低速离心机(长沙湘仪离心机仪器有限公司);SHHW21-600型三用电热恒温水箱(天津市泰斯特仪器有限公司);超低温保存箱,型号:DW-86L338(J),海尔集团;10~1 000 μL移液枪,热电(中国)集团;XK96-3型微量振荡器(江苏新康医疗器械有限公司);XW-80A型旋涡混合器(海门市其林贝尔仪器制造有限公司);Emax Plus酶标仪,Molecular Devices,LLC.;S10手持式高速匀浆机(宁波新艺超声设备有限公司)。
2 方法
2.1 小儿解表颗粒对3种不同发热模型的解热作用
2.1.1 分组及给药 取100只大鼠每天早晚各测量肛温1次,连续3 d,筛选得到70只体温恒定大鼠进入实验。将合格大鼠分为7个组,每组动物10只,采用预防给药方式,分别按照以下剂量分别灌胃给药3 d。①空白对照组;②LPS模型对照组;③干酵母模型对照组;④2,4-二硝基酚模型对照组:给予5 mL/kg剂量的生理盐水;⑤LPS模型+给药组;⑥干酵母模型+给药组;⑦2,4-二硝基酚模型+给药组:5 mL/kg剂量的小儿解表颗粒药液(0.5 g/mL)。
2.1.2 监测体温变化 末次给药1 h后进行造模,连续监测造模后几小时的肛温(因为3种致热剂的发热强度、持续发热周期不同,所以检测肛温的时间间隔有所不同)。分别按照以下方式进行造模:2,4-二硝基酚组:在④和⑦组的各鼠背部按5 mL/kg的剂量皮下注射2,4-二硝基酚(30 mg/kg),每隔20 min测量体温,连续监测160 min;LPS组:在②和⑤组按5 mL/kg的剂量进行腹腔注射LPS(100 μg/kg),刚开始每隔1 h测1次体温,后面再隔0.5 h测1次体温,连续监测7.5 h;干酵母组:在③和⑥组的各鼠背部按5 mL/kg的皮下注射干酵母混悬液(20%),刚开始每隔1 h测1次体温,后面再每隔0.5 h测体温1次,连续监测7.5 h;空白对照组:在①组的各鼠背部按5 mL/kg的剂量皮下注射生理盐水,其中,编号1~3的大鼠监测时间与2,4-二硝基酚组进行同步;编号4~7的大鼠监测时间与LPS(脂多糖)组同步;编号8~10的大鼠监测时间与干酵母组同步。
2.2 不同浓度的小儿解表颗粒对2,4-二硝基酚模型的解热机制研究
2.2.1 分组及给药 将体温恒定的合格大鼠随机分为7个组,每组10只,分别为:①空白对照;②2,4-二硝基酚模型对照组;③2,4-二硝基酚模型+小儿解表颗粒高剂量(0.5 g/mL)组;④2,4-二硝基酚模型+小儿解表颗粒中剂量(0.25 g/mL)组;⑤2,4-二硝基酚模型+小儿解表颗粒低剂量(0.125 g/mL)组;⑥2,4-二硝基酚模型+柴黄颗粒(0.25 g/mL)(阳性对照1组);⑦2,4-二硝基酚模型+小儿柴桂退热颗粒(0.75 g/mL)(阳性对照2组)。采用预防给药方式,①~⑦组均连续灌胃给药3 d(其中①~②组灌胃等体积纯水,③~⑦组灌胃相应的药液)。
2.2.2 酶联免疫吸附试验(ELISA)技术检测 末次给药1 h后,②~⑦组进行发热造模,各鼠背部按5 mL/kg的剂量皮下注射2,4-二硝基酚药液(30 mg/kg),在大鼠体温达到最高点时,按1.5 mL/200 g体重腹腔注射20%乌拉坦溶液麻醉,腹主动脉采血,自然凝固2 h,将凝固的腹主动脉血,以3 500 r/min,离心5 min,取上清液得到血清,酶联免疫吸附试验(ELISA)技术检测IL-1β、IL-6、TNF-α、IFN-γ、GHRL和β-EP。处死动物后,解剖取出下丘脑,用生理盐水清洗,用滤纸吸干水分,称重,再用10倍量的生理盐水进行匀浆,得到匀浆液,以16 000 r/min,离心1 min,取上清液,采用酶联免疫吸附试验(ELISA)技术检测cAMP、NO和PGE2。
2.3 统计学方法
数据运用SPSS 20.0统计软件分析,计量资料以平均数±标准差表示,采用多组间单因素方差分析方法,P<0.05表示差异具有统计学意义。
3 结果
3.1 小儿解表颗粒对3种不同发热模型的解热作用
3.1.1 小儿解表颗粒对LPS模型的解热作用 LPS组与空白对照组比较,从造模后2 h,温度有一定的升高,但没有统计学差异,持续到4 h,温度又在降低;较大程度的温度升高从5 h开始,一直持续到7 h,在5.5、6.0、6.5 h的时间点,均能显著地升高大鼠体温(肛温),P均<0.05,其中升温的峰值在6.5 h,说明LPS发热大鼠模型复制成功。
LPS+给药组与LPS组比较,在发热有显著性增高的时间点上(5.5、6.0、6.5 h),给药组有降低大鼠体温(肛温)的作用,其中在升温峰值的6.5 h时间点,能够显著性降低(P<0.05)。结果表明,小儿解表颗粒对LPS导致的发热大鼠具有一定的解热作用。但数据的整体波动较大(体现在标准差偏大),详见表1。

表1 对LPS发热大鼠的体温(肛温)影响
3.1.2 小儿解表颗粒对2,4-二硝基酚模型的解热作用 2,4-二硝基酚组与空白对照组比较,从造模后20 min,一直到140 min,均能显著地升高大鼠体温(肛温)(P<0.05),其中升温的峰值在80~100 min,说明2,4-二硝基酚发热大鼠模型复制成功。2,4-二硝基酚+给药组与2,4-二硝基酚组比较,在造模后20 min,给药组能显著地降低大鼠体温(肛温)(P<0.01);而在后续的时间点中,同样有一定程度的降低大鼠体温(肛温)(P>0.05),差异无统计学意义。结果表明,小儿解表颗粒对2,4-二硝基酚导致的发热大鼠具有一定的解热作用,主要体现在模型复制后的20 min,详见表2。

表2 对2,4-二硝基酚发热大鼠的体温(肛温)影响
3.1.3 小儿解表颗粒对干酵母模型的解热作用 干酵母组与空白对照组比较,从造模后4 h开始,一直持续到本次实验观察的7.5 h,均能显著地升高大鼠体温(肛温)(P<0.05),其中升温的峰值有“双峰”现象,分别在5.5 h和7.0 h,说明干酵母发热大鼠模型复制成功。干酵母+给药组与干酵母组比较,在发热升温最高的“双峰”两个时间点上(5.5、7.0 h),给药组均有一定降低大鼠体温(肛温)的作用(P>0.05),差异无统计学意义。结果表明,小儿解表颗粒对干酵母导致的发热大鼠具有一定的解热作用,但作用不显著,见表3。

表3 对干酵母发热大鼠的体温(肛温)影响
3.2 不同浓度小儿解表颗粒对2,4-二硝基酚模型的解热机制
3.2.1 对下丘脑中cAMP、NO、PGE2的影响 与空白组大鼠比较,模型组大鼠下丘脑中cAMP、NO、PGE2均高于空白组(P<0.01),差异有统计学意义,说明造模成功。与模型组比较,两个阳性组中,柴桂组对NO的降低不明显(P>0.05),差异无统计学意义;不同浓度的小儿解表颗粒均能一定程度降低下丘脑中cAMP、NO、PGE2的含量,但解表中组对cAMP和解表低组对cAMP、NO的降低不明显(P>0.05),差异无统计学意义,cAMP、NO、PGE2解表高组显著降低(P<0.05),差异有统计学意义。说明高剂量的小儿解表颗粒能有效抑制2,4-二硝基酚致大鼠发热引起下丘脑中的cAMP、NO和PGE2值升高,见表4。
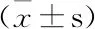
表4 各组大鼠下丘脑cAMP、NO、PGE2含量比较
3.2.2 对血清中IL-1β、IL-6、TNF-α、IFN-γ、GHRL、β-EP的影响 与空白组大鼠比较,模型组大鼠血清中IL-1β、IL-6、TNF-α、IFN-γ、GHRL和β-EP含量均显著高于空白组(P<0.01),差异有统计学意义,说明造模成功。与模型组比较,两个阳性对照组中,柴黄组对TNF-α的降低不明显(P>0.05),差异无统计学意义,柴桂组对IL-6的降低不明显(P>0.05),差异无统计学意义;不同浓度的小儿解表颗粒均不同程度地降低大鼠血清中IL-1β、IL-6、TNF-α、IFN-γ、GHRL和β-EP含量(P<0.05),差异有统计学意义。说明不同浓度的小儿解表颗粒均能有效抑制2,4-二硝基酚致大鼠发热引起血清中IL-1β、IL-6、TNF-α、IFN-γ、GHRL和β-EP值的升高,且较两个阳性药效果更好,见表5。

表5 各组大鼠血清IL-1β、IL-6、TNF-α、IFN-γ、GHRL、β-EP含量比较
4 讨论
发热是机体抵抗入侵病原体的非特异性系统反应。脂多糖(LPS)作用于机体免疫细胞释放致热型细胞因子,其通过体温调节中枢,打破机体的产热和散热平衡而发热[5];2,4-二硝基酚为化学性质热源,其致热机制为通过刺激细胞氧化过程,发热为机体的一种保护机制,在发热情况下能做出有益的反应,机体的免疫功能产生变化[6],其升温后持续时间较短[7];干酵母所致的发热是由于注射部位的局部溃烂引发的剧烈炎症反应[8]。实验结果表明,小儿解表颗粒对3种发热模型均能发挥一定程度的解热效果,与其发热机制密切相关。而对2,4-二硝基酚热源的解热效果最佳,说明小儿解表颗粒具有发挥解热作用迅速的特点。
发热是由发热激活物刺激机体的产内生致热源细胞释放内生致热原(EP),TNF-α是重要的EP之一[9],IL-1β、IL-6也是常见的内源性热原细胞因子,可以直接或间接作用于体温调节中枢的神经细胞,引起体温变化[10-12]。目前比较公认的体温调节中枢介质有PGE2和cAMP[13]。实验结果表明,小儿解表颗粒能有效降低大鼠血清IL-1β、TNF-α、IL-6及下丘脑cAMP、PGE2。IL-1β、TNF-α、IL-6是最常见的致热炎性因子[14-15],由于IL-6为最终的内生致热原[16],因此TNF-α的产生或释放,继而引起了IL-6的改变,使PGE2和cAMP合成减少,从而发挥解热作用。
NO参与机体免疫防御、细菌杀伤、吸收等功能的调节,机体发热时,与体内自由基代谢紊乱有关。因此,当有内外源性损害时机体就会产生发热,机体内NO的含量明显增加[17]。IFN是动物细胞在受到诱生刺激后产生的一组具有抗病毒、参与免疫调节等多种生物活性的细胞因子[18],IFN-γ是一种免疫调节的多效性因子[19]。GHRL具有抑制炎症反应发生、参与神经调节的作用[20]。β-EP是一种具有免疫性作用的内源性阿片肽,当机体内外环境发生巨大改变时,可参与机体各系统功能的调节过程[21]。大鼠在受到2,4-二硝基酚的刺激后,下丘脑中NO和血清中IFN-γ、GHRL、β-EP含量均显著升高,参与机体免疫调节,给药后均有效降低其含量,表明小儿解表颗粒能有效降低大鼠受到的刺激,发挥解热作用。
小儿解表颗粒具有宣肺解表、清热解毒的功效,临床上主要用于小儿外感风热所致的感冒,对不同发热模型均有一定程度的解热作用。各浓度小儿解表颗粒参与免疫调节,抑制2,4-二硝基酚诱导大鼠发热外周细胞因子的释放和中枢升温介质的释放及相关炎症因子含量的升高而发挥解热作用,且通过机制研究发现,小儿解表颗粒解热效果的优势明显。小儿解表颗粒主治发热恶风、头痛咳嗽、鼻塞流涕、咽喉痛痒,解热机制的研究只是其中一部分,为了更好推广小儿解表颗粒的临床应用,还需要更多更进一步的研究。
