“退热六法”对不同月龄幼兔退热效果及TLR4/NF-κB信号通路的影响
2022-07-14刘志凤于天源张英琦王厚融徐亚静
焦 谊,刘志凤,于天源*,张英琦,刘 迪,2,王厚融,徐亚静,官 乾
(1.北京中医药大学,北京 102488;2.北京中医药大学东方医院,北京 100078)
发热作为儿科常见的症状之一,发生率为25.7%,每人每年约0.8次[1]。长期发热或体温过高则会损害机体调节功能,使病情恶化。小儿推拿退热具有安全性和有效性[2],其中以开天门[3]、推坎宫[3]、揉太阳[3]、揉耳后高骨[4]、清天河水[5]、推脊[6]手法最为常用。但小儿推拿退热的最适年龄、最适温度、最适类型等标准,研究不够深入。故选取脂多糖(lipopolysaccharide,LPS)模型模拟临床细菌性发热,选取不同月龄幼兔模拟不同年龄患儿,明确推拿退热的最适年龄,并进一步选取最适年龄幼兔探究推拿退热的机理。
视前区-下丘脑前部(POAH)是体温调节的基本中枢,也是最重要的体温调节中枢,LPS作为Toll样受体4(TLR4)公认的配体,能刺激机体产生炎症反应,核转录因子kappaB(NF-κB)参与机体免疫调节、炎症反应、感染、细胞周期调控、细胞分化及凋亡等[2],发热过程以炎症介质如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素IL-1β(interleukin-1β,IL-1β)最为重要,故以退热六法为例,设计实验进行深入研究。
1 材料及方法
1.1 实验动物及分组
清洁级1、3月龄新西兰雄兔各16只,2月龄新西兰雄兔24只,肛温(39.00±0.50)℃,购自北京隆安实验动物养殖中心[合格证号为SCXK(京)2019-0006]。饲养于北京中医药大学动物实验室,温度(25±0.5)℃,相对湿度(65±5)%,12h/12h明暗周期,自由饮食饮水。适应性饲养3天,排除肛温波动大于0.4℃的新西兰兔。随机将1、3月龄幼兔分为模型组8只、推拿组8只,2月龄幼兔随机分为正常组8只、模型组8只、推拿组8只。实验程序经北京中医药大学动物使用和管理委员会批准,符合动物福利与伦理原则。
1.2 主要器材及试剂
1.2.1 主要器材及仪器 MultiSkan3酶标仪(美国THERMO公司);冷冻离心机(德国EPPENDORF公司);BL-420N(成都泰盟软件有限公司);Bio Drop (Biochrom公 司);T100TM Thermal Cycler PCR仪、CFX ConnectTMReal-Time System定 量PCR仪、ChemiDoc MP成像仪(美国BIO-RAD公司)。
1.2.2 主要试剂 大肠杆菌内毒素脂多糖(美国Sigma公司;批号055:B5 L2880);BCA蛋白浓度测定试剂盒、细胞核蛋白提取试剂盒、PMSF、RIPA裂解液(北京索莱宝科技有限公司);TLR4抗体(批号:bs-20594R)、NF-κB p65抗体(批号:bs-0465R)、GAPDH抗体(批号:bsm-0978M);HRP二抗(批号:ZB-2301、ZB-2305);高灵敏度化学发光检测试剂盒(北京康为世纪生物科技有限公司);HiPure Total RNA Micro Kit(批号:R4114-02);RevertAid First Strand cDNA Synthesis Kit(美国THERMO公司;批号:K1622)。
1.3 模型制备
清醒状态下,模型组和推拿组耳缘静脉注射浓度为0.5 μg·mL-1LPS,注射量为1 mL·kg-1,注射后1h内肛温上升超过0.6℃为造模成功,正常组不予处理[3-4]。
1.4 分组处理
推拿组由推拿学科专业人员操作,且都为同一人干预。造模后1 h干预1次。1)开天门。定位:两眉骨内侧中点至神庭(前正中线,额顶骨缝交界处)[10],操作:用拇指自下而上交替直推200次,2 min[11];2)推坎宫。定位:睛明(内眼角,上下眼睑交界处)直上至丝竹空(眶上突外端)[10],操作:用两拇指桡侧自眉心向眉梢做分推200次,2 min[11];3)揉太阳。定位:太阳(外眼角后上方颞窝中)[10],操作:用两拇指桡侧推运200次,2 min[11];4)揉耳后高骨。定位:寰椎翼前缘直上方凹陷处[10],操作:用两拇指或中指端揉24次掐3下,2 min[11];5)清天河水。定位:腕横纹至肘横纹[10],操作:用食中指指面自腕推向肘,推500次,5 min[12]。6)推脊。定位:大椎(背中线上,第7颈椎与第1胸椎棘突间)至尾根[10],操作:用食中二指自上而下直推300次,作5 min[11]。正常组和模型组正常饲养。
1.5 取材及指标检测
1.5.1 肛温监测 采用BL-420N监测肛温变化。肛温探头涂上适量石蜡油,插入肛门固定为5 cm,待稳定后读数,作为幼兔的肛温,之后每隔20 min记录1次肛温,连续监测6 h。
1.5.2 ELISA检测血浆、下丘脑TNF-α、IL-1β含量选取二月龄幼兔,于造模后3 h(即推拿后2 h)腹主动脉取血5 mL,置于绿色真空采血管中,室内保存20 min内进行离心,4℃ 3 000 r·m-1离心20 min,取上清置于EP管保存,按ELISA试剂盒方法测定血浆、下丘脑中TNF-α、IL-1β含量。
1.5.3 Western Blot检测下丘脑组织 TLR4、NF-κB p65蛋白表达 选取二月龄幼兔,于造模后3 h腹腔注射10%水合氯醛(0.35 mL·100 g-1),抽取腹主动脉血后取出下丘脑组织约200 mg,将组织分成两部分,一部分用于提取细胞核蛋白,另一部分提取细胞膜蛋白。BCA蛋白试剂盒进行蛋白定量。配置10%分离胶和5%浓缩胶,上样后稳定电泳浓缩胶60V、分离胶80 V,冰上电转100 V 70 min,10%脱脂奶粉封闭2 h,一抗(TLR4 1:2 000,NF-κB p65 1:2 000,GAPDH 1:2 000)室温摇床孵育1 h后4℃冰箱过夜,孵育二抗(羊抗兔IgG 1:10 000,羊抗小鼠 IgG 1:10 000),成像仪显影,Image Lab图像分析软件分析目的条带,定量分析各蛋白条带灰度值。
1.5.4 PCR检测下丘脑组织TLR4、NF-κB、TNF-α、IL-1β mRNA表达按 HiPure Total RNA Micro Kit试剂盒和RevertAid First Strand cDNA Synthesis Kit试剂盒操作步骤提取总RNA,逆转录成cDNA。GAPDH上游引物:ACTCTGGCAAAGT GGATGTTGTCG,下游引物:CCGTGGGTGG AATCATACTGGAAC;TLR4上游引物:GAGGAG GCTGTTGGTGGAAGTTG;下游引物:GCACACT GAATACTGACACGCTAATG,NF-κB上游引物:GCATCACAGCAGGCGAACTCTC;下游引物:TGCTTCTCGGCTACCACTGACTC,TNF-α上游引物:CGCCATGAGCACTGAGAGTATGATC; 下 游引物:CAGCCACGAGCAGGAAAGAGAAG;IL-1β上游引物:GGCAGGTCTTGTCAGTCGTTGTG,下游引物:GCAGAGGACGGGTTCTTCTTCAAAG。所有cDNA样品扩增,分别收集内参GAPDH以及目的基因的Cq值,根据2-△△Cq公式计算相对表达量。
1.6 统计学方法
所有数据录入SPSS 26.0软件进行分析,数据符合正态分布且方差齐性,以均数±标准差(±s)表示,数据均呈正态分布并且方差齐,以单因素方差分析(one-way ANOVA)进行组间比较,组间两两比较以LSD检验。以P<0.05为差异有统计学意义。
2 实验结果
2.1 各月龄幼兔模型组肛温基础线比较
见图1、表1。
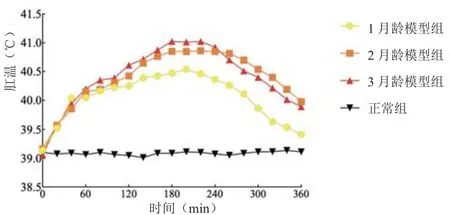
图1 各月龄模型组幼兔肛温曲线图(±s )(8只兔/组)
表 1 各月龄模型组幼兔肛温6 h变化表(±s,n = 8) ℃

表 1 各月龄模型组幼兔肛温6 h变化表(±s,n = 8) ℃
注:与正常组比较,# P<0.05;与1月龄模型组比较,△P<0.05
组别 造模前 造模后1 h 造模后2 h 造模后3 h 造模后4 h 造模后5 h 造模后6 h正常组 39.10±0.23 39.06±0.16 39.05±0.14 39.09±0.11 39.08±0.16 39.11±0.14 39.11±0.12 1 月龄模型组 39.14±0.33 40.05±0.12# 40.25±0.26# 40.48±0.37# 40.36±0.31# 39.86±0.45# 39.41±0.43 2月龄模型组 39.16±0.23 40.15±0.40# 40.43±0.50# 40.85±0.67# 40.85±0.56#△ 40.54±0.52#△ 39.98±0.49#△3月龄模型组 39.06±0.39 40.20±0.29# 40.35±0.29# 41.03±0.58#△ 40.93±0.57#△ 40.40±0.60#△ 39.89±0.39#△
2.2 1月龄幼兔退热情况
见表2、图2。
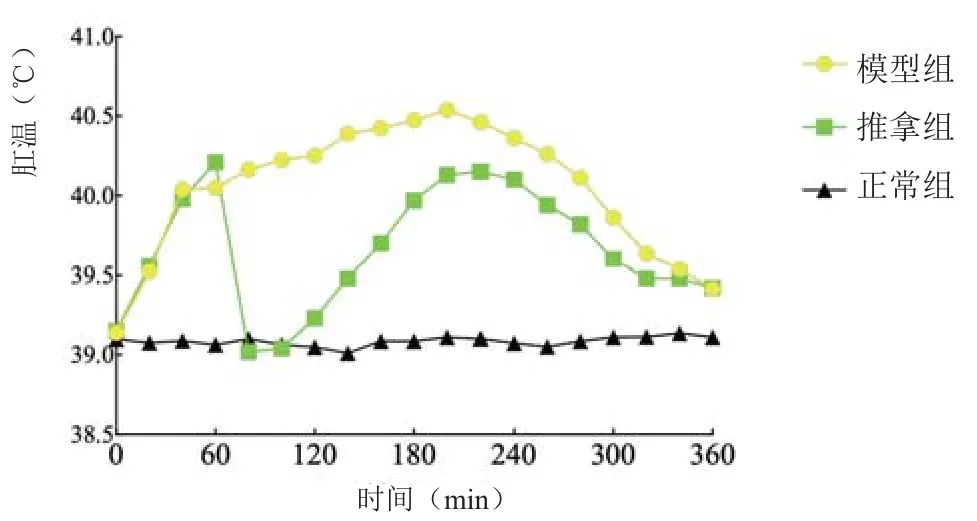
图2 1月龄幼兔肛温变化曲线图(±s )
表 2 1月龄幼兔肛温变化表(±s,n = 8) ℃
表 2 1月龄幼兔肛温变化表(±s,n = 8) ℃
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组别 造模前 造模后1 h 造模后2 h 造模后3 h 造模后4 h 造模后5 h 造模后6 h正常组 39.10±0.23 39.06±0.16 39.05±0.14 39.09±0.11 39.08±0.16 39.11±0.14 39.11±0.12模型组 39.14±0.33 40.05±0.12# 40.25±0.26# 40.48±0.37# 40.36±0.31# 39.86±0.45# 39.41±0.43推拿组 39.15±0.27 40.21±0.38# 39.23±0.54△ 39.97±0.66#△ 40.10±0.46# 39.60±0.29# 39.42±0.43
2.3 2月龄幼兔退热情况
见表3、图3。
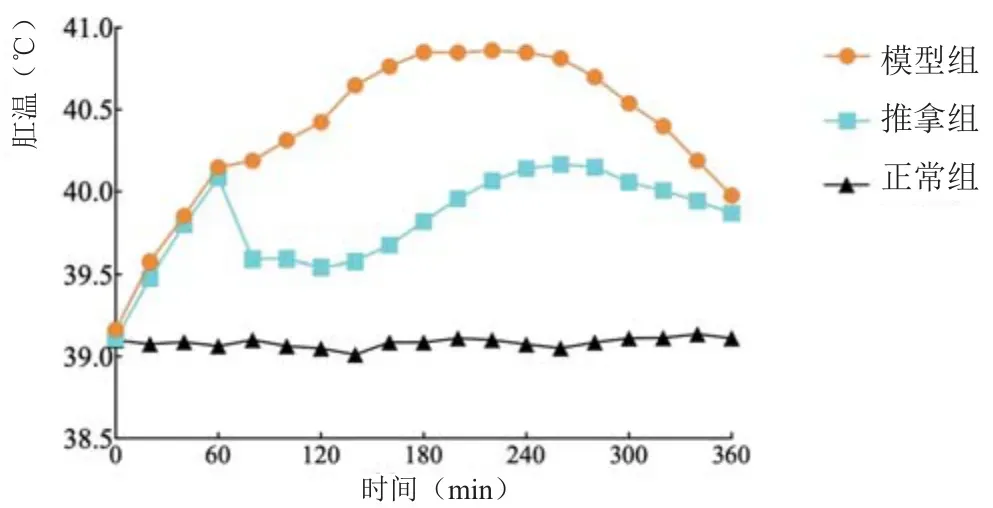
图3 2月龄幼兔肛温变化曲线图(±s )
表3 2月龄幼兔肛温变化表(±s,n = 8) ℃
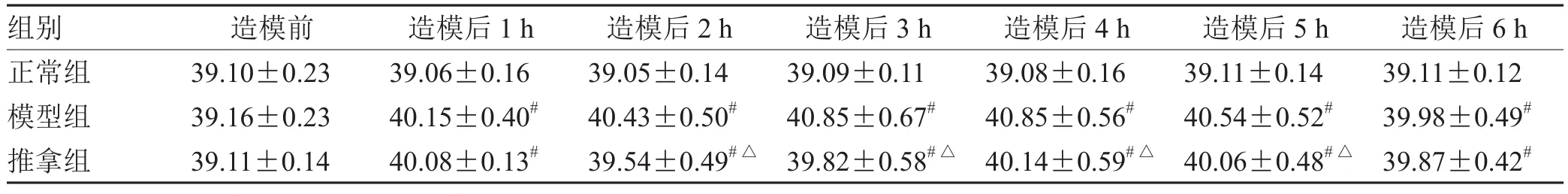
表3 2月龄幼兔肛温变化表(±s,n = 8) ℃
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组别 造模前 造模后1 h 造模后2 h 造模后3 h 造模后4 h 造模后5 h 造模后6 h正常组 39.10±0.23 39.06±0.16 39.05±0.14 39.09±0.11 39.08±0.16 39.11±0.14 39.11±0.12模型组 39.16±0.23 40.15±0.40# 40.43±0.50# 40.85±0.67# 40.85±0.56# 40.54±0.52# 39.98±0.49#推拿组 39.11±0.14 40.08±0.13# 39.54±0.49#△ 39.82±0.58#△ 40.14±0.59#△ 40.06±0.48#△ 39.87±0.42#
2.4 3月龄幼兔退热情况
见表4、图4。

图4 3月龄幼兔肛温变化曲线图(±s )
表4 3月龄幼兔肛温变化表(±s,n = 8) ℃

表4 3月龄幼兔肛温变化表(±s,n = 8) ℃
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组别 造模前 造模后1 h 造模后2 h 造模后3 h 造模后4 h 造模后5 h 造模后6 h正常组 39.10±0.23 39.06±0.16 39.05±0.14 39.09±0.11 39.08±0.16 39.11±0.14 39.11±0.12模型组 39.06±0.39 40.20±0.29# 40.35±0.29# 41.03±0.58# 40.93±0.57# 40.40±0.60# 39.89±0.39#推拿组 39.08±0.14 40.21±0.27# 39.69±0.81#△ 40.11±0.79#△ 40.36±0.58#△ 40.16±0.34# 39.94±0.28#
2.5 3个不同月龄幼兔的退热情况
见表5。
表5 3个不同月龄幼兔的退热情况(±s,n= 8)

表5 3个不同月龄幼兔的退热情况(±s,n= 8)
注:与1月龄比较,# P<0.05;与2月龄比较,△P<0.05
不同月龄 造模1 h肛温/℃ 推拿后最低肛温/℃ 推拿降低肛温最大幅度/℃ 推拿抑制发热时程/min 1 月龄 40.21±0.38 38.88±0.58 1.33±0.5 57.50±29.15 2 月龄 40.08±0.13 39.28±0.54 0.80±0.51# 192.50±93.77#3 月龄 40.21±0.27 39.47±0.53# 0.74±0.43# 74.29±55.03△
2.6 2月龄幼兔血浆和下丘脑中炎症因子的表达情况
见表6。
表6 2月龄LPS致热幼兔血浆和下丘脑中炎症因子表达情况(±s,n = 8) ng·mL-1

表6 2月龄LPS致热幼兔血浆和下丘脑中炎症因子表达情况(±s,n = 8) ng·mL-1
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组别 血浆下丘脑TNF-α IL-1β TNF-α IL-1β正常组 231.72±8.93 66.48±2.83 228.21±7.02 50.13±3.42模型组 268.00±15.57# 71.50±2.89# 256.13±12.35# 56.38±1.27#推拿组 242.17±6.30△ 66.87±1.83△ 233.24±6.95△ 51.21±2.30△
2.7 2月龄幼兔下丘脑中TLR4/NF-κB p65 蛋白含量表达情况
见图5、表7。
表7 2月龄LPS致热幼兔下丘脑TLR4/NF-κB p65含量表达情况(±s,n= 8)

表7 2月龄LPS致热幼兔下丘脑TLR4/NF-κB p65含量表达情况(±s,n= 8)
注:与正常组比较,# P<0.05;与模型组比较,△P<0.05
组别 相对灰度值TLR4/GAPDH 细胞核 NF-κB p65/GAPDH正常组 0.25±0.12 0.15±0.07模型组 0.47±0.08# 0.88±0.45#推拿组 0.34±0.13△ 0.29±0.20△

图5 2月龄LPS致热幼兔下丘脑TLR4/NF-κB p65条带图
2.8 2月龄幼兔下丘脑中TLR4、NF-κB、TNF-α、IL-1β mRNA表达情况
造模后3 h,模型组下丘脑中TLR4、NF-κB、TNF-α、IL-1β mRNA高于正常组(P<0.05);推拿组下丘脑中TLR4、NF-κB、TNF-α、IL-1β mRNA低于模型组(P<0.05)。见图6。
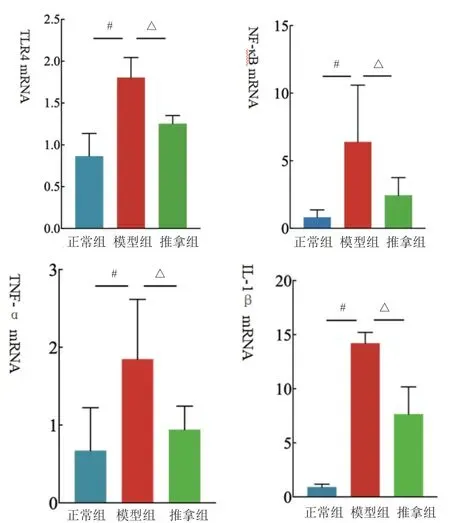
图6 各组2月龄下丘脑相关mRNA表达情况
3 讨论
3.1 “退热六法”对不同月龄幼兔的退热效果
实验选取1月、2月、3月龄幼兔模拟临床发热易感的3个年龄段[13-14],即婴儿期(28天~1岁)、幼儿期(1岁~3岁)、学龄前期(3岁~6岁),从而初步得出小儿推拿退热的最适年龄。
研究结果发现,“退热六法”干预1月龄幼兔降温幅度最大,2月龄次之;“退热六法”干预2月龄幼兔降温最稳定,3月龄次之。所以,临床上年龄越小的退热效果可能短时间内较好,长时间可能会出现体温反复,可增加治疗次数,对于年龄较大的患儿,降温效果比较稳定,短期降温效果虽不如1月龄,但体温波动较小,从整个退热过程来看,推拿都起到了正向调节作用。根据结果显示,选取2月龄幼兔作为后续研究退热机制的实验动物。
3.2 “退热六法”对LPS致热幼兔可能的退热机制
临床上推拿退热效果显著,推拿能下调发热患儿外周血清TNF-α、IL-6、IL-8等炎症因子水平[15]。因此,本研究探讨了推拿对炎症性发热的影响,结果提示推拿能明显抑制发热体温,抑制炎症反应,可能是通过TLR4/NF-κB p65信号通路实现。
根据研究发现,耳缘静脉注射0.5 μg·kg-1的LPS,造模后1 h肛温明显升高,造模后3 h肛温达最高峰,与基础肛温相比,约上升1.3~2.0℃,随后肛温逐渐下降,持续约6 h,与研究[9]相符。选取“退热六法”作为干预方式,其中头面四大手法属于“和法”,可调节阴阳,天人相应,天河水倍受历代医者的推崇,均认为清天河水是“清法”的重要代表,在各种热证下均可施用,脊椎占督脉近三分之二的循行部位,推脊对督脉气机有调节作用。
发热是体温调节系统紊乱的表现,是反应炎症性疾病的重要标志,TLR4介导的信号转导参与了慢性和急性炎症反应[16],其中TLR4/NF-κB信号通路是引起发热的重要传导途径[17]。炎性细胞因子能影响免疫反应,并对各种组织或器官造成损伤[18],TNF-α、IL-1β参与调节早期免疫反应[19],是发热的关键介质。有研究[20]表明注射TNF-α血清抗体只能影响发热的早期阶段,这与推拿后能即刻降低体温相似。脂多糖是一种典型内毒素,作为配体可以激活细胞膜上的TLR4,通过一系列反应诱导NF-κB p65入核,启动下游炎症反应,上调促炎细胞因子。
综上所述,“退热六法”能下调外周血中炎症因子的表达,同时下调中枢中TLR4的表达,以及细胞核NF-κB p65的表达。说明推拿可能是通过抑制TLR4/NF-κB信号通路起到抗炎解热作用。
