绿原酸通过影响自噬及耐药蛋白表达逆转5-氟尿嘧啶结肠癌细胞的耐药性
2020-11-23胡承莲邓贵柳
熊 刚,邹 华,胡承莲,吴 丹,邓贵柳
(恩施土家族苗族自治州中心医院急诊科,恩施 445000)
由于人类生活方式及饮食结构的改变,消化道疾病的发病率及病死率也不断受到高度重视。结直肠癌是消化道常见的恶性病变,其发生率仅次于胃癌、食管癌和肺癌等癌症,并且流行病学发现其致死率位居第3位[1]。对于恶性肿瘤的治疗仍然依靠手术,而术前、术后的辅助化疗也是必不可少的环节,但是临床上常发现患者出现肿瘤复发或肿瘤细胞转移,出现这种现象的主要原因是肿瘤细胞对多种化疗药物产生多药耐药[2-3]。于是,肿瘤细胞的耐药问题是目前急需解决的难题,早期研究已提出中药也具有较好的抗肿瘤活性,而且还具有毒性作用小的特点[4]。绿原酸(ChA)是植物体中重要的次生代谢产物,主要分布于杜仲、金银花等多种植物中,ChA在抑制肿瘤细胞增殖方面也具有较好的药理活性[5-6],其中包括能够抑制结肠癌细胞的侵袭及转移[7],而且还能逆转肿瘤细胞的耐药性[8]。前期报道跨膜转运蛋白、细胞自噬均与肿瘤细胞的耐药性相关[9]。因此,文章考察了转运蛋白P-糖蛋白(P-gp)、肺抗药性相关蛋白(LRP)及自噬蛋白Beclin1、高迁移率足蛋白B1(HMGB1)在结肠癌HCT116细胞耐5-氟尿密啶(5-FU)中的作用,还观察了ChA对P-gp、LRP、Beclin1、HMGB1 蛋白表达的影响。
1 材料与方法
1.1 主要材料 结肠癌HCT116细胞株购自武汉巴菲尔公司(来自美国ATCC细胞库);绿原酸(大连金港制药有限公司,批号:HSP20170211);DMEM高糖培养基、胎牛血清购自美国Gibco公司;胰蛋白酶购自Thermo Scientific公司;5-FU(深圳玩乐药业有限公司,批号:SY20161107);CCK8试剂盒购自日本同仁公司(批号WST-78);RIPA裂解液购自上海吉诺公司;BCA试剂盒购自北京百奥公司;β-actin、P-gp、LRP、Beclin-1、HMGB1、p- 蛋 白 激 酶 B1(Akt1)、Akt1及mTOR抗体购自英国Abcam公司;HRP标记羊抗兔免疫球蛋白(Ig)G购自上海谷歌公司;ECL 试剂盒(美国 Pierce,批号:32106)。
1.2 主要仪器 BBS-DDC超净工作台(山东博科科学仪器有限公司);LRH-150 BOD CO2细胞培养箱(上海印溪仪器表有限公司);Victor31420Multilable Counter酶标仪(DX540,美国);DYCZ-24DN 凝胶电泳仪(北京六一仪器厂);成像系统(BIO-RAD,美国)。
1.3 HCT116细胞培养 HCT116细胞培养在含10%FBS的DMEM培养液中,在37℃恒温培养箱中培养,CO2浓度为5%。5-FU耐药的HCT116细胞系(HCT116-R)利用反复高浓度冲击结合逐步递增药物剂量法[10]。具体步骤如下:将对数期HCT116细胞用5 mg/L 5-FU干预24 h,用不含Ca2+、P3-的磷酸盐缓冲液D-Hanks清洗1遍,并加入不含药物的完全培养液继续培养7~10 d,反复用5-FU冲击处理,同时逐渐增大 5-FU 剂量(5、10、15、20、25、30、35、40 mg/L),经过8次冲击后构建成5-FU耐药细胞系(HCT116-R)。待细胞恢复生长后将其维持培养于10 mg/L 5-FU完全培养液中,酶2~3 d传代1次,停药2周后进行后续实验。
1.4 ChA影响5-FU对HCT116细胞增殖抑制实验 把对数期的HCT116细胞制备成悬液,按每孔1×104个细胞接种于96孔板中,待细胞贴壁生长后,加入不同浓度(0、100、200、400 mg/L)的 ChA 及不同剂量(0、10、40、80、120、160、200 mg/L)的 5-FU 干预细胞48h后,除去旧培养液,每孔加入10μLCCK8溶液,再继续培养细胞2 h,采用酶标仪在450 nm处测定细胞吸光度OD值,计算细胞活力,计算公式为:细胞活力(%)=细胞活力(%)=OD药物组/OD对照组×100%。
1.5 实时荧光定量逆转录聚合酶链反应(RT-PCR)检测ChA对HCT116-R细胞系中自噬、耐药相关基因的影响 将对数生长期细胞接种于6孔板进行实验,待细胞贴壁生长24 h后,采用100、400 mg/L剂量ChA干预细胞48 h后,收集细胞加入Trizol提取细胞总RNA,并对核酸进行浓度及纯度法测定。吸去1 μg总RNA逆转录cDNA,程序设定为 30 ℃(10 min)→42 ℃(50 min)→85 ℃(10 min)→4℃(5 min)。根据试剂说明书,RT-PCR体系为20μL,cDNA2μL,引物4μL,2×FastFireqPCRPreMix 10 μL dd H2O 4 μL。扩增条件设置为:94 ℃(10 min),94℃(15 s),60℃(1 min),循环 40次。以 β-actin作为内参,基因引物序列见表1。
1.6 蛋白免疫印迹法(Western Blot)检测ChA对HCT116-R细胞系中相关蛋白表达的影响 将对数生长期细胞接种于6孔板进行实验,待细胞贴壁生长24 h后,采用100、400 mg/L剂量ChA干预细胞48 h后,收集细胞冰上充分裂解30 min。收集细胞匀浆,4℃、离心半径20cm,12000r/min离心13min,收集上清液,并采用BCA试剂测定总蛋白浓度;在蛋白电泳过程中,每孔蛋白上样量为50 μg,浓缩胶70 V恒压电离30 min,分离胶120 V恒压电离90 min;然后将蛋白在275 mA恒流条件下转至NC膜;5%脱脂牛奶封闭条带1 h后,加入β-actin、LRP、Beclin-1、HMGB1、p-Akt1、Akt1 及 mTOR 抗体(稀释比1∶1 000)4℃孵育过夜,洗膜后HRP标记羊抗兔IgG室温孵育1 h,洗膜3次,ECL显色曝光,分析蛋白含量。

表1 引物序列Tab.1 Primer sequences list
1.7 统计学方法 采用SPSS 24.0软件进行统计分析,实验数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD 法,若方差不齐采用 Dunnett’s T3 法。P<0.05 为差异有统计学意义。
2 结果
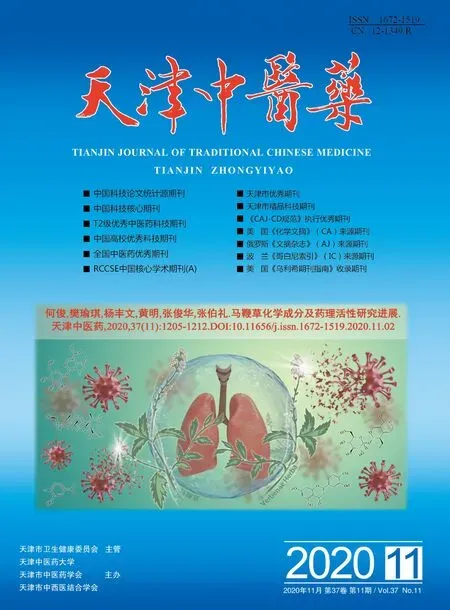
2.1 ChA增强5-FU对HCT116细胞系增殖的抑制效应 应用不同浓度ChA及5-FU共同处理HCT116细胞系后,采用CCK8法考察ChA是否增强5-FU对HCT116细胞系增殖的抑制作用,见图1。当5-FU浓度保持不变时,随着ChA剂量的增高,HCT116细胞活力明显降低;当ChA浓度保持不变时,较高浓度的5-FU能够诱导HCT116细胞增殖活力的明显降低。提示5-FU呈浓度依赖性抑制HCT116细胞增殖,并且ChA能够促使5-FU对HCT116细胞的抑制作用。
2.2 HCT116、HCT116-R 细 胞 系 中 P-gp、LRP、Beclin-1及HMGB1蛋白表达比较 为了考察自噬及耐药蛋白表达在HCT116细胞耐5-FU的作用,因此采用Western Blot分析了HCT116、HCT116-R细胞系中P-gp、LRP、Beclin-1及HMGB1蛋白表达水平,见图2。HCT116-R细胞系中P-gp、LRP、Beclin-1及HMGB1蛋白表达量相对于HCT116细胞均显著升高,差异比较有统计学意义(P<0.05),提示自噬及耐药相关蛋白表达量的增高可能是HCT116细胞耐5-FU的机制。
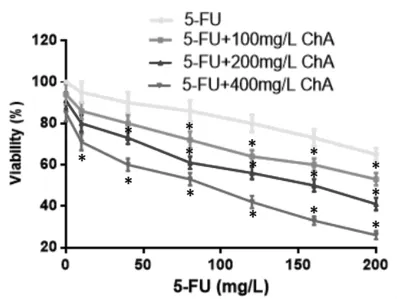
图1 ChA对呈浓度依赖性增强5-FU对HCT116细胞的抑制效应Fig.1 ChA enhanced the inhibitory effect of 5-FU on HCT116 cells in a dose-dependent manner
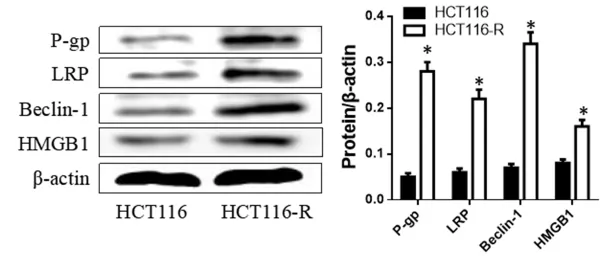
图2HCT116、HCT116-R细胞系中自噬及耐药相关蛋白表达Fig.2 Expression of autophagy and drug resistance related proteins in HCT116 and HCT116-R cell lines
2.3 RT-PCR检测 HCT116-R细胞 P-gp、LRP、Beclin-1及HMGB1 mRNA表达 采用低、高剂量ChA干预HCT116-R细胞后,提取总RNA,检测P-gp、LRP、Beclin-1及HMGB1 mRNA表达水平发现,ChA呈剂量性的抑制了HCT116-R细胞中P-gp、LRP、Beclin-1及HMGB1 mRNA表达,与对照组相比差异具有统计学意义(P<0.05)。见表 2。
表2RT-PCR分析HCT116-R细胞P-gp、LRP、Beclin-1及HMGB1 mRNA表达Tab.2 Expression of P-gp,LRP,Beclin-1 and HMGB1 mRNA in HCT116-R cells by RT-PCR detection
2.4 Western Blot检测HCT116-R细胞P-gp、LRP、Beclin-1及HMGB1蛋白表达 采用低、高剂量ChA干预HCT116-R细胞后,提取总蛋白,检测P-gp、LRP、Beclin-1及HMGB1蛋白表达水平发现,ChA呈剂量性的抑制了HCT116-R细胞中P-gp、LRP、Beclin-1及HMGB1蛋白表达,与对照组相比差异具有统计学意义(P<0.05)。见图 3。
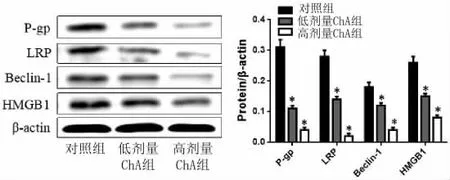
图3Western Blot分析HCT116-R细胞P-gp、LRP、Beclin-1及HMGB1蛋白表达Fig.3 Expression of P-gp,LRP,Beclin-1 and HMGB1 protein in HCT116-R cells by Western Blot detection
2.5 Western Blot检测HCT116-R细胞中Akt1-雷帕霉素靶蛋白(mTOR)分子通路蛋白 采用低、高剂量ChA干预HCT116-R细胞后,提取总蛋白,检测自噬相关调节通路Akt1、mTOR蛋白表达水平发现,ChA呈剂量性的抑制了HCT116-R细胞中p-Akt1、Akt1、mTOR蛋白表达,与对照组相比差异具有统计学意义(P<0.05)。见图 4。
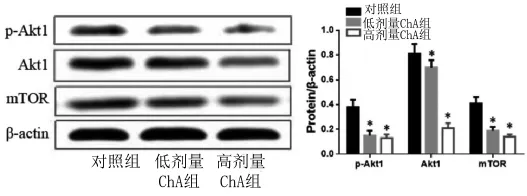
图4 Western Blot分析HCT116-R细胞p-Akt1、Akt1、mTOR蛋白表达Fig.4 Expression of p-Akt1,Akt1 and mTOR protein in HCT116-R cells by Western Blot detection
3 讨论
肿瘤患者在接受化疗治疗中,较多患者都会出现耐药现象,导致化疗效果的降低,产生医疗资源浪费。于是,更多的国内外研究人员集中于探索肿瘤耐药机制及其治疗方案。当前虽然在逆转肿瘤细胞耐药性方面已取得较大进步,但是因为大多数逆转药物存在毒副作用导致临床上限制其应用。中医立足于辨证论治,以低毒、多靶点等优势常用于逆转肿瘤细胞的耐药,可以显著改善肿瘤细胞对化疗药物的敏感性。近期研究报道ChA可通过抑制PI3K/Akt信号传导进而下调跨膜转运体P-gp、MRP1蛋白表达,从而有效逆转人白血病细胞株的多药耐药[8]。于是,本研究探讨了ChA对耐5-FU的HCT116细胞系的耐药逆转作用及相关作用机制。
肿瘤细胞耐药主要集中于跨膜转运体上,其中P-gp可介导多数化疗药物外排,由于肿瘤细胞中P-gp表达水平的上调,导致P-gp介导化疗药物外排的活性增高,引起细胞内有效药物浓度降低。其中P-gp、肺抗药性相关蛋白(LRP)属于细胞膜转运蛋白,抗肿瘤药物可由细胞膜上的转运蛋白介导外排增多,进而降低了药物在细胞中积累,抑制了化疗药物的抗肿瘤活性。Levatic J等[11]报道Akt信号通路介导的耐药性也许与激活P-gp蛋白表达有关,在多种肿瘤细胞中,P-gp能够利用腺嘌呤核苷三磷酸(ATP)提供的能量介导药物的外排升高而导致肿瘤细胞产生耐药性。LRP蛋白主要表达于体腔上皮、巨噬细胞、血脑屏障及分泌性器官[12],通过减少细胞内DNA损伤药物含量,进而减弱药物对DNA的损伤作用,导致顺铂、烷化剂及5-FU的耐药。已有研究报道LRP在肺腺癌细胞中表达明显上调[13],进而诱导耐药现象的产生。本研究发现ChA可以诱导5-FU对结肠癌HCT116细胞增殖活力的抑制作用,还能抑制HCT116-R细胞中P-gp、LRP mRNA及蛋白的表达。表明ChA能够逆转HCT116细胞对5-FU的耐药,可能与降低细胞膜上P-gp、LRP蛋白表达,进而提升化疗药物在肿瘤细胞中的积累有关。
相关研究也发现细胞自噬与耐药性密切相关,证实通过抑制肿瘤细胞自噬,可提升患者对抗肿瘤药物的敏感性。研究发现通过下调自噬相关基因的表达可逆转乳腺癌细胞对多柔比星的耐药性[14]。Bieri等[15]也证实抑制自噬基因Beclin-1表达可逆转肿瘤细胞对顺铂的耐药性。文章研究发现ChA干预HCT116-R细胞,自噬相关蛋白Beclin-1、高迁移率族蛋白B-1(HMGB1)呈药物剂量依赖性表达降低,降低了肿瘤细胞的自噬过程。Akt1/mTOR信号通路可介导细胞增殖、耐药及自噬,并且该信号传导激活与肿瘤的发生发展关系密切[16]。并且早期研究还发现姜黄素可通过阻滞Akt1/mTOR信号传导抑制肿瘤细胞增殖,通过降低Akt1、mTOR信号分子表达水平提升化疗药物的杀伤效果[17]。研究观察到在HCT116-R细胞系中ChA能够降低Akt1、mTOR基因表达,进而抑制Akt1/mTOR信号通路的活性,抑制结肠癌细胞的增殖,然而ChA是否直接与Akt1/mTOR信号通路分子发生相互作用来改变耐药基因及自噬基因的表达,有待进一步深入研究。