蛋白质酶解物预防动脉粥样硬化研究进展
2020-11-23刘慧李博
刘慧,李博
(中国农业大学 食品科学与营养工程学院,北京,100083)
据2017年世界卫生组织发布的数据显示,全球每年有1770万人死于心血管疾病,约占全球死亡总数的31.5%[1],《中国心血管病报告2018》指出,我国心血管病患病率处于持续上升阶段,占城乡居民总死亡原因的首位,推算心血管疾病患病人数约2.9亿,其中冠状动脉粥样硬化性心脏病1 100万[2]。动脉粥样硬化(atherosclerosis,AS)是一种慢性血管炎症疾病,其发生发展是一个复杂的多因素、多细胞参与的过程,涉及血管内皮细胞损伤、单核细胞浸润、血管炎症、泡沫细胞形成、血管平滑肌细胞(smooth muscle cell,SMC)增殖和迁移及动脉粥样硬化斑块的形成[3]。AS是引起血栓、周围血管疾病、冠心病、中风、脑梗死等心血管疾病的主要原因[4],因而在AS阶段的预防干预显得尤为重要。目前,阿司匹林和他汀类药物等被视作预防AS的有效方法。但是已有临床报告显示,对于尚未出现心血管疾病的人来说,长期服用上述药物对疾病的抑制作用不足以抵消其带来的副作用,如大出血、肌痛等[5-6]。因此,亟需更安全有效、可长期服用的天然功能活性物质应用于AS的一级或二级预防。本文就近年来发现的多种天然蛋白质酶解物预防AS的体内外研究进行综述,并提出了现有研究中仍待解决的问题,以期为蛋白质酶解物的进一步研究及其作为膳食补充剂促进健康、减少心血管疾病的风险提供有益借鉴。
1 AS的发病机制
AS是一种慢性血管炎症疾病,包括血管内皮细胞功能紊乱、单核巨噬细胞形成泡沫细胞、SMC增殖和迁移、脂质斑块破裂等一系列生理过程[3]。到目前为止,AS的发病机制仍未完全清楚,涉及多种危险因素,存在多种病理学说,其中常见的学说有脂质代谢紊乱学说、氧化损伤学说、内皮损伤学说、炎症反应学说、血栓形成学说等。高脂血症是AS的重要危险因素,总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)浓度过高会使血管内皮细胞受损,血管内膜下聚集沉淀脂质,是导致AS的主要诱因之一。而活性氧(reacti e oxygen species,ROS)的异常增加导致氧化型低密度脂蛋白(oxidized LDL,ox-LDL)的产生,ox-LDL也会诱导血管内皮细胞损伤并诱发巨噬细胞发生炎症反应,同时经清道夫受体不断进入巨噬细胞,导致泡沫细胞形成;促进血管SMC不断增殖并向外迁移,在血管内壁形成斑块[7]。可以看出,内皮功能受损也是AS发生的重要环节。内皮损伤学说认为多种有害刺激引起内皮损伤,使之分泌趋化因子,如血管细胞黏附分子-1( ascular cell adhesion molecule-1, CAM-1)、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)等,并吸引单核细胞黏附于内皮[8]。单核细胞迁入内皮下间隙,随后分化为巨噬细胞,摄取脂质,形成脂质条纹。同时内皮细胞的凋亡与脱落促使血液中血小板大量黏附与聚集[9]。功能紊乱的内皮细胞、巨噬细胞和血小板分泌产生大量生长因子和多种血管活性物质,刺激中膜SMC不断增生并进入内膜,使血管损伤处血管壁增厚。这种损伤应答本身也是一种炎症反应,近年来炎症反应学说被越来越多的学者重视和认同,炎症反应贯穿AS的起始、发展以至动脉斑块的破裂,是多种AS致病机制的共同环节或通路。内皮细胞、巨噬细胞、SMC等均会产生炎症因子,如白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),这些炎症因子又会进一步刺激细胞因子、炎性介质、蛋白酶的释放以及T细胞的活化增殖,加快AS的病变进展[8-9]。SMC还产生间质胶原和弹性蛋白等,并形成覆盖斑块的纤维帽。纤维帽使脂质池稳定,但由于一系列蛋白酶的活性表达及炎症因子的作用,如基质金属蛋白酶(matrix metalloproteinase,MMPs)的释放,细胞外基质过度降解,导致斑块破裂[8],增加发生动脉粥样硬化血栓的风险。
根据AS的不同病理学说,研究者分别从降胆固醇、抗氧化、防止内皮细胞损伤、抗炎以及抑制SMC增殖迁移等方面研发延缓AS的膳食补充剂。近年来,科研人员从蛋白质酶解物中分离、鉴定了抗氧化肽、抗炎肽、降胆固醇肽、抗血小板肽等多种活性肽,这些活性肽均能在AS的不同进展阶段起到抑制效果[10],因此与其他食源性成分相比,蛋白质酶解物在预防AS方面可能具有更大的优势。许多研究者基于细胞和动物模型,进行了蛋白质酶解物预防AS的研究,研究方向如图1所示。
2 基于不同细胞模型的研究
2.1 抗氧化及抑制泡沫细胞形成
在AS的初发阶段,ROS介导的氧化应激是AS发生发展的关键影响因素,涉及LDL氧化对巨噬细胞的一系列病变及血管内皮细胞的氧化损伤。ox-LDL不受控制的被巨噬细胞摄取,过量的胆固醇酯化和胆固醇外排减少导致胞内胆固醇酯(cholesteryl ester,CE)积累随后引发泡沫细胞的形成[7],这也是早期AS病变的主要标志。因此,研究常用ox-LDL诱导的RAW 264.7巨噬细胞源泡沫细胞评价蛋白质酶解物调节细胞胆固醇代谢、抑制泡沫细胞形成的功效[7,11],还通过检测巨噬细胞和内皮细胞中氧化应激相关生物标志物的表达,如ROS、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等,来判断蛋白质酶解的抗氧化作用。

图1 蛋白质酶解物预防动脉粥样硬化研究方向图Fig.1 The research direction of protein hydrolysate to pre ent atherosclerosis
研究除以油红O染色观察巨噬细胞泡沫化形态学变化外,还以CE/TC>50%定量判断细胞泡沫化。刘东泽[11]以80 μg/mL ox-LDL诱导了泡沫细胞(胞内CE/TC为62.12%),通过胰蛋白酶和胃蛋白酶酶解制备水蛭酶解物,研究发现当给药浓度为150 μg/mL时,胞内CE/TC降至42.86%,并表现出剂量依赖性,由此可知水蛭酶解物具有抑制泡沫细胞形成的作用,但其在药效强度方面不如阳性对照辛伐他汀(胞内CE/TC降至29.63%)。进一步研究发现,水蛭酶解物正向反馈调节胞内胆固醇酰基转移酶A1(cholesterol acyltransferase A1,ACAT1)上调,其抑制泡沫细胞形成的机制是依赖于自噬过程,与促进胆固醇外排作用无关。同时,研究还发现水蛭酶解物可以减弱ox-LDL诱导的细胞核内DNA氧化断裂,具有一定的抗氧化作用[11]。类似的,中国林蛙皮肤抗菌肽F DLKKIANIINSIFGK及其衍生肽F KLKKIANIINSIFKK、F KLKKILNIINSIFKK也被证实可以降低100 μg/mL ox-LDL诱导的泡沫细胞中TC、CE含量,作用机制是通过抑制巨噬细胞摄入胆固醇的主要受体CD36,从而抑制巨噬细胞的泡沫化,也与促进胆固醇外排作用无关[7]。
不同蛋白质酶解物之间的抗氧化或抑制泡沫细胞形成作用存在差异。如霍艳姣[12]建立了巨噬细胞诱导LDL氧化模型,发现不同电荷性质的酪蛋白抗氧化肽组分均可减少细胞中MDA的生成量,抑制LDL氧化,但碱性组分比酸性组分表现出更强的抑制效果。巨噬细胞从开始吞噬脂质到形成泡沫细胞之前,通常认为是荷脂细胞,酪蛋白抗氧化肽组分还能显著减少ox-LDL诱导的荷脂细胞内TC、TG、游离胆固醇(free cholesterol,FC)含量,并且随着正电荷的增加,表现出较强的抑制泡沫细胞形成作用[12]。还有研究表明,多肽的抗氧化活性取决于其分子量,1~3 kDa的多肽具有最高的抗氧化活性[13-14];同时,不同蛋白水解酶的酶解作用会导致不同肽序列的形成,影响蛋白质酶解物的抗氧化活性[15]。
另外,据报道,内源性抗氧化防御系统在保护血管内皮细胞免受氧化应激损伤中发挥重要作用,血红素加氧酶-1(heme oxygenase-1,HO-1)的上调就是其中一种内在防御机制,目前此类研究也较少。多肽Lunasin是一种大豆来源的含43个氨基酸的肽,GU等[16]首次发现Lunasin可通过激活PI3K/Akt/Nrf2/ARE途径来刺激HO-1的表达,从而减少H2O2诱导的EA.hy 926内皮细胞中ROS的产生,减轻内皮细胞的氧化损伤。
2.2 防止内皮细胞损伤
内皮细胞损伤和功能障碍是AS病变过程中的一个重要特征,主要特征表现为NO释放量和生物利用度降低,黏附因子和趋化因子的表达增加等[17]。目前,内皮损伤模型的细胞常用人脐静脉内皮细胞(human umbilical ein endothelial cells,HU ECs)及其细胞株EA.hy926[17-19],也有研究直接提取培养了SD大鼠胸主动脉内皮细胞[20]。在内皮细胞中TNF-α会激活NF-αB信号通路,引起NO表达量减少, CAM-1和ICAM-1的表达量增加[21],因此,常以TNF-α为诱导因子,建立内皮细胞损伤模型。赵欣[17]通过胰蛋白酶酶解制备了水蛭酶解物,发现其在200 μg/mL时对10 ng/mL TNF-α诱导的EA.hy926具有保护作用,作用机制为通过抑制NF-κB信号通路,使细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS) mRNA表达上调,ICAM-1、MCP-1的蛋白和mRNA的表达下降。WANG等[22]也发现一种直接购买的水蛭酶解物可通过阻断NF-κB亚基p65转运至细胞核,下调TNF-α诱导的EA.hy926细胞中ICAM-1和MCP-1的表达。另外,由于单核细胞黏附内皮细胞是必不可少的AS的发展过程,有研究利用THP-1和U 937两个模型探究了蛋白质酶解物对细胞间黏附的影响。LIANG等[18]发现玉米蛋白水解物可以抑制EA.hy926内皮细胞中ICAM-1、 CAM-1的表达,并通过荧光染色法观察到玉米蛋白水解物的添加显著降低了U 937单核细胞对EA.hy926细胞的黏附力。类似的,水蛭酶解物也被证实可以抑制THP-1单核细胞对EA.hy926内皮细胞迁移、黏附率[17,22]。
2.3 抗炎
巨噬细胞是最早侵入AS病变的炎性细胞,它们也是AS斑块的主要成分。由巨噬细胞产生的促炎细胞因子,如IL-6、TNF-α等,可进一步推动AS病变;同时,巨噬细胞还分泌抗炎细胞因子,如IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)等,可促进AS晚期斑块的稳定性[8]。巨噬细胞对脂多糖(lipopolysaccharide,LPS)刺激具有高度的敏感性,LPS会诱导炎症基因表达和释放一些与AS发展相关的生物标志物[23],因此,研究常用LPS诱导的巨噬细胞炎症模型探究蛋白质酶解物的抗炎效果。常用的巨噬细胞有THP-1、U 937、RAW 264.7[24],其中RAW 264.7来源广泛、性质稳定、贴壁易养,广泛应用于炎症研究中。
目前,关于蛋白质酶解物抗炎作用的研究相对较多,不同的蛋白质酶解物,甚至同一种蛋白质不同处理方式得到的酶解物,其功效也有差异。蛋白酶的种类、多肽氨基酸组成、分子量大小以及极性等均会影响酶解物的功效。CHENG等[25]用碱性蛋白酶和风味酶分别酶解煮熟的金枪鱼汤汁,发现碱性蛋白酶酶解物的抗炎效果更佳。陈月华[26]利用胰蛋白酶水解大米蛋白,对抗炎活性最高的RPHs-C组分再进一步通过离子交换色谱,对比发现获得的5个组分抗炎活性均有差异。KIM等[27]获得了分子量分别为<1 kDa、1~5 kDa和>5 kDa的贻贝水解物肽段,通过LPS诱导的RAW 264.7巨噬细胞模型,发现它们的NO抑制活性分别为72.66%、70.12%和92.35%,且抑制效果均比未处理的贻贝水解物好。用>5 kDa的组分进一步研究发现,其可使炎性巨噬细胞中前列腺素E2、TNF-α、IL-1β及IL-6水平降低,诱导型-氧化氮合酶(induced NOS,iNOS)、环氧化酶2(cyclooxygenase-2,COX-2)蛋白和mRNA的表达下调,从而发挥抗炎作用。Lunasin[28]和小麦谷蛋白水解物[29]也被证实可以降低这些炎症因子的表达,具有类似的抗炎功效。
当前,大多数研究仅证实了蛋白质酶解物可调节下游信号通路中蛋白的表达而达到抗炎效果,如通过抑制了IκBα的降解、p65的核移位进而抑制NF-κB,有效地降低巨噬细胞炎症过程;或通过抑制了JNK、ERK、p38 MAPK的磷酸化,降低IL-6等炎症因子的水平而发挥了抗炎功效[27-31]。但完整分子机制的研究仍处于初步探索阶段,仅有少数研究明确了蛋白质酶解物的具体活性成分,合成了活性肽,并进一步研究了活性肽抗炎的分子信号通路。JONES等[32]从苦瓜种子中分离出的一种纯肽BG-4,与LPS单独处理组相比,用BG-4和LPS联合处理THP-1巨噬细胞后,细胞分泌的TNF-α、IL-6等促炎细胞因子减少,胞内ROS的产生减少,p65的核易位被抑制,ERK1/2 MAPK和STAT3磷酸化降低,表明BG-4是通过STAT3/MAPK/NF-κB信号通路而发挥抗炎作用及其分子调控机制。LIANG等[33]通过CO-IP及Pulldown实验证实水稻八肽KHNRGDEF在HU EC的作用靶点为TLR4,通过改变TLR4的结构来调节下游TRIF和IKKβ的蛋白水平降低p65的磷酸化,抑制NF-κB活化,从而影响caspase-3的释放,抑制细胞凋亡,保护HU EC免受H2O2引起的氧化损伤和炎症反应。
2.4 抑制SMC增殖
SMC主要参与AS后期病变中,常通过人、兔主动脉SMC模型评价蛋白质酶解物对SMC增殖迁移的影响,总体上关于此方面的研究较少。水蛭素是从中药水蛭中提取的活性多肽,有研究表明,水蛭素可以抑制血管SMC增殖。李红梅等[34]直接将水蛭素作用于体外培养的人冠状动脉SMC,通过MTT法检测细胞生长增殖情况,发现6.25 mg/mL水蛭素对细胞增殖产生较明显的抑制作用,抑制率达44.6%。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、血小板衍生生长因子(platelet deri ed growth factor,PDGF)对SMC增殖的调控起关键作用,当两者表达被抑制时,能够有效降低增生内膜的厚度[35-36],故常作为SMC增殖的生物标志物。凝血酶可使SMC进入增殖期的细胞数明显增多,而水蛭素已被证实可以通过抑制PDGF和PCNA的表达而抑制凝血酶诱导的SMC增殖[19]。
2.5 蛋白质酶解物的多重抑制作用
已有研究分离、纯化并鉴定了蛋白质酶解物中的部分活性肽序列,并证实了单一活性肽也具有多重生物活性(表1)。MONTOYA等[37]发现苋菜蛋白经体外胃蛋白酶、胰酶模拟消化后的3条肽段均具有抗氧化、抗炎、抑制细胞间黏附反应的多重功效。其中,肽HGSEPFGPR的IC50值最低,与凝集素样氧化低密度脂蛋白受体1(lectin-like oxidized low-density lipoprotein receptor 1,LOX-1)晶体结构的相互作用更好,对相关生物标志物的抑制效果也最好。但是3种多肽联合应用的效果并不优于单独应用,这也提示了活性肽的生物活性优于肽组分。类似的,50 μg/mL的GEQQQQPGM、50 μg/mL的YYGGEGSSSEQG、25 μg/mL的SESEM也被证实具有抑制细胞凋亡、抗氧化和保护内皮细胞的功效,从而表现出预防AS的潜力。它们的物质的量浓度相似,这可能解释了它们具有相似的活性[31,38]。
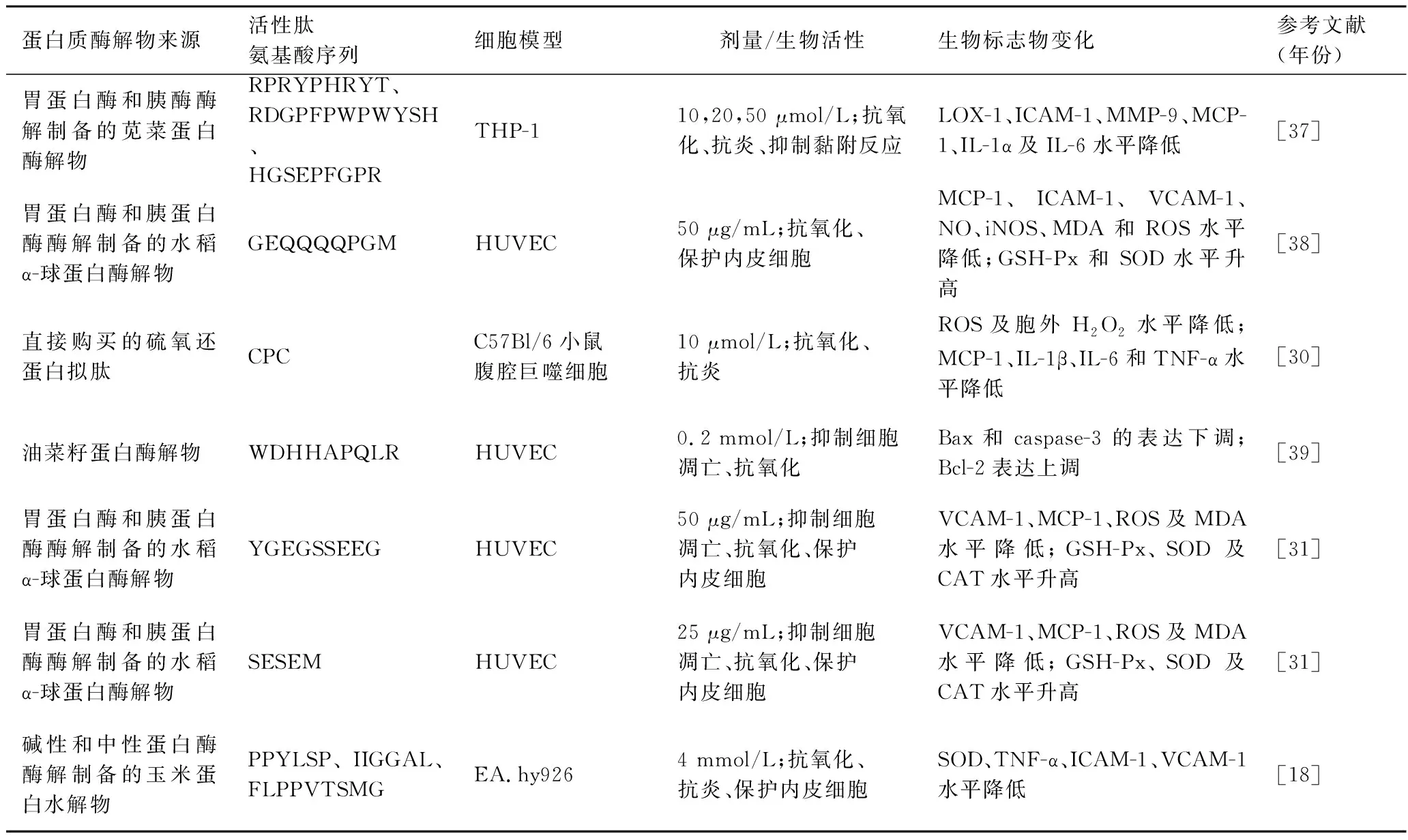
表1 活性肽基于细胞模型的多重抑制作用Table 1 Multiple inhibition of bioacti e peptides based on cell model
纵览已有研究,大部分蛋白质酶解物成分不明确、分子量较大,它们在体内具有不稳定性或半衰期较短,生物利用率及能否以完整形式吸收仍然未知,是否在吸收过程经肽酶等水解释放了活性更高的物质也待证实。针对已明确活性成分的蛋白质酶解物,其活性肽在细胞中发挥作用的靶点和分子信号通路也需要深入研究。同时,具有降胆固醇、抗氧化、防止内皮细胞损伤、抗炎或抑制SMC增殖作用的蛋白质酶解物,表现出了预防AS的潜力,但其对AS的有效抑制作用仍需要进一步的体内研究来阐明。
3 基于动物模型的功效评价
除临床试验外,动物模型是用来评价蛋白质酶解物体内功效最直观的手段。已有许多研究在前期细胞实验的基础上,通过动物模型评价验证了蛋白质酶解物表现出的预防AS的能力。如WANG等[22]发现购得的水蛭酶解物在体外具有保护内皮细胞的生物活性,也可以减少ApoE-/-小鼠的AS斑块,综合细胞和动物模型,验证了该水蛭酶解物具有抑制AS的功效。TANG等[40]前期研究发现胶原酶型蛋白酶消化猪皮肤I型胶原得到的胶原三肽(collagen tripeptide,Ctp)片段通过下调PCNA表达,抑制了体外培养的人主动脉SMCs的增殖和迁移,且减少Ctp组AS病变中HHF35阳性SMCs的数量,可能对AS具有调节作用。进一步验证表明,Ctp可显著降低高胆固醇血症家兔的主动脉粥样硬化斑块面积和血清TC水平,进而抑制炎症过程,包括抑制巨噬细胞和SMCs的增殖,减少ROS诱导的氧化应激,可稳定AS斑块[41]。Lunasin也被证实在高脂饲料喂养的ApoE-/-小鼠中可以有效保护血管内皮细胞免受氧化损伤,抑制AS斑块的发展[16]。可以看出,蛋白质酶解物在动物体内的功效更倾向于对AS的多重抑制作用,而不仅局限于其在细胞模型中表现出的单一抑制作用。
动物模型的功效评价指标主要包括模型的疾病表型及生物标志物变化。动脉粥样硬化指数(atherogenic index,AI)由总胆固醇和高密度脂蛋白胆固醇(high density liptein cholesterol, HDL-C)计算得来,AI=[(TC-HDL-C)/HDL-C]是国际公认的动脉粥样硬化指标,它的正常数值<4,数值越小动脉硬化的程度就越轻,引发心脑血管病的危险性就越低;如果AI≥4就说明已经发生了动脉硬化,数值越大动脉硬化的程度就越重,发生心脑血管病的危险性就越高[42]。许多研究通过动物模型的AI值来判断模型是否产生AS病变及蛋白质酶解物在体内的抗AS作用效果,作为AS早期预防的参考。另外,实验动物主动脉内出现明显的斑块也可作为判断AS建模成功的重要病理表型,通过蛋白质酶解物作用前后斑块面积大小的改变来初步评价其作用效果。由于AS复杂、多因素的形成过程,脂质积累、细胞间黏附、炎症、氧化应激、血管内皮保护等因素也形成了一系列生物标志物,如TC、 CAM-1、IL-6、MDA、iNOS等,对蛋白质酶解物预防AS功效评价,即通过生物标志物的上调或下调来判断其是否具有良好效果,这也与基于细胞模型的研究相符。
近年来,在实验动物的选择方面,SD大鼠、Wistar大鼠及C57BL/6 ApoE-/-小鼠最为常用。随着AS发病机制的深入研究,AS动物模型的构建也已从单纯高脂饲料喂养法发展为混合饲料喂养法、炎症免疫法、内皮损伤法、血液流变学法及基因工程法等多种造模方法。高脂饲料喂养法及基因工程法具备造模时间短、造模简单的优点,成为建立高效、简便、理想的AS动物模型常用方法[43]。
3.1 基于高脂饲料喂养法建立的AS动物模型
脂质沉积是AS发生发展的关键因素,高脂状态的建立是复制AS模型的基础。表2汇总了近年来多种蛋白质酶解物在高脂饲料法建立的AS动物模型体内的预防AS功效的研究。其中,燕麦多肽展示出较优的抑制AS功效[44]。还有研究通过设置阳性药物对照组,发现了效果与一定剂量药物相当的蛋白质酶解物。如龚吉军等[42]发现油茶粕多肽高剂量组(1 000 mg/kg BW)和降脂药物组(辛伐他汀片0.30 mg/kg BW)的AI值没有显著差异;WANG等[22]发现高剂量水蛭酶解物[0.5 g/(kg·g)]可以显著减少9.29%的AS斑块面积,这与阳性对照辛伐他汀组[10 mg/(kg·g)]减少11.6%的效果相近。但是在AS动物实验方面,目前关于蛋白质酶解物与预防类药物的功效多集中于降血脂药物,未来仍需进一步探究其与其他预防类药物效果的异同,如抗血栓药物阿司匹林等。同时,还需要根据蛋白质酶解物在实际应用时人体服用的剂量来合理优化实验动物的灌胃剂量。
另外,有研究证实了蛋白质酶解物预防AS的功效可能优于蛋白质本身。如油茶粕蛋白也具有一定的降AI效果,虽然效果不如油茶粕多肽高剂量组,但与中剂量组相比没有明显差异[42];类似的,TONG等发现水稻α-球蛋白经消化吸收后的功能性肽片段功效优于相同剂量的水稻α-球蛋白[31,45]。

表2 蛋白质酶解物基于动物模型(高脂饲料喂养法)的预防AS功效评价Table 2 E aluation of the efficacy of protein hydrolysates on pre ention of AS based on animal model(high fat feed method)
3.2 基于基因工程法建立的AS动物模型
随着转基因技术的成熟,有研究者[49]用基因改良的小鼠分别对炎症、高血压、蛋白酶、细胞外基质、糖代谢及免疫系统等相关的基因进行敲除或者过度表达,如以ApoE-/-小鼠、LDLR-/-小鼠、MCPI-1-/-小鼠作为动物对象,结合高脂饮食加快建模。已有研究明确了蛋白质酶解物中的活性成分,通过给予ApoE-/-小鼠合成的活性肽,探究了活性肽在体内预防AS的功效(表3)。研究发现,活性肽也可以从抗炎、降血脂、保护内皮细胞、抗氧化等多个靶点发挥作用,从而抑制ApoE-/-小鼠的AS病变。虽然如前文所述,有研究显示纯肽的功效优于蛋白质酶解物组分,但是NAKAMURA等[50]分别灌胃给予ApoE-/-小鼠含有 PP和IPP的发酵乳、含有 PP和IPP的酪蛋白水解产物、合成的 PP和IPP,结果发现,4组小鼠主动脉斑块面积的减少程度相差不大,而低剂量的合成的 PP、IPP组甚至与空白对照组相比无显著性差异[50]。这可能是由于发酵乳和酪蛋白水解物中含有多种多肽和氨基酸,包括了其他未知活性成分。另外,考虑到合成的活性肽是非天然产物,需以药物的标准进行全面的安全评价,在实际应用中仍提倡以蛋白质酶解物作为膳食补充剂。
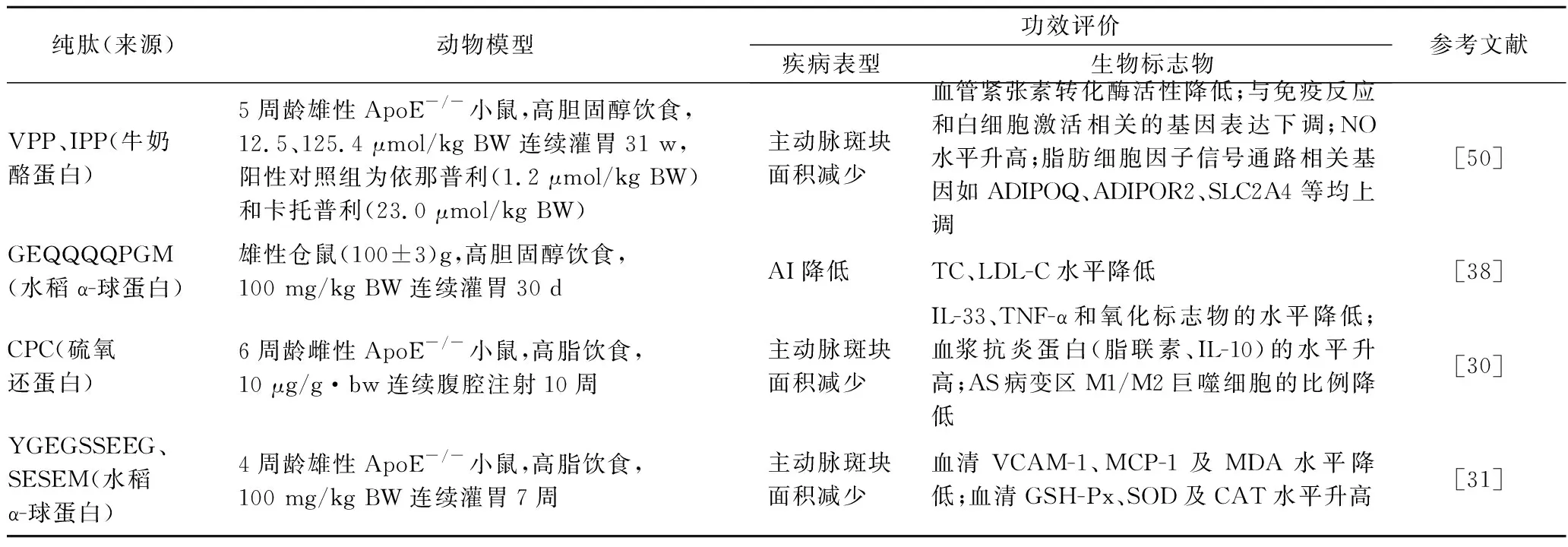
表3 纯肽基于动物模型(基因工程法)的预防AS功效评价Table 3 E aluation of the efficacy of pure peptide on pre ention of AS based on animal model(genetic engineering method)
值得注意的是,由于不同的AS模型具有不同的生物学特性,应根据具体的实验目的选择合适的实验动物及造模方法。如TONG等[45]发现水稻α-球蛋白(100 mg/kg BW)可促进高胆固醇饮食喂养的SD大鼠粪便中中性固醇的排泄,表明水稻α-球蛋白通过抑制胆固醇在肠道中的吸收来降低大鼠的血清胆固醇浓度。然而,以同样剂量灌胃雄性ApoE-/-小鼠时,水稻α-球蛋白虽然显著减少了AS斑块区域,但不能显著降低血液胆固醇浓度,推测ApoE参与了水稻α-球蛋白的降胆固醇过程。因此,TONG等[31]在进一步实验中发现水稻α-球蛋白抑制ApoE-/-小鼠AS病变是通过抗氧化、抗炎途径,并非是调节了胆固醇代谢。
综上,由蛋白质酶解物基于动物模型预防AS的功效评价可知,蛋白质酶解物具有调节血清胆固醇浓度、改善氧化应激、抑制促炎细胞因子的释放和相关蛋白的表达、改善NO系统相关的内皮功能障碍及调节免疫等多种功能,可作用于多靶点以发挥其复杂多效的预防AS作用,同时营养、安全无毒副作用,有开发为预防AS的功能性食品的潜力。然而,蛋白质酶解物在人体内的稳定性、生物利用度和功效等方面与细胞、动物模型仍有较大差异,因此,在蛋白质酶解物实际应用之前,还需要进行大量的临床人体实验。
4 结语及展望
AS所致心脑血管疾病在人类死亡总数所占比例逐渐增大,其防治方法已成为国内外研究的热点。目前,科学家已做了大量的研究工作,取得了一定成效,证实了蛋白质酶解物抑制AS病变的有益作用,但仍存在一些问题亟需解决:
(1)目前的研究多集中于蛋白质酶解物在降脂、抗炎、抗氧化、降血压、降血糖等单一方向,而以AS动物模型为基础,探究蛋白质酶解物多重预防作用的研究仍然较少。(2)虽然蛋白质酶解物从细胞到动物实验均表现出良好的预防AS潜力,并且涉及多个机制,可针对AS的不同病理环节同时发挥作用,但目前对活性肽准确的作用靶点及可能具有的多靶向作用机制有待进一步阐明。(3)目前,关于活性肽在巨噬细胞等AS相关细胞中发挥作用的下游MAPK及NF-κB信号通路的研究较成熟,而其上游作用靶点及完整的信号传导仍需深入探究。(4)随着AS发病机制的深入研究,有关表观遗传修饰如DNA甲基化、组蛋白修饰以及mi RNA等可作为生物标志物,以更加全面的评价蛋白质酶解物及活性肽是否具有抗AS功效,为AS的预防提供新的策略和靶点。(5)许多研究并未分离、纯化并鉴定具有预防AS功效活性肽的氨基酸序列,且相关活性肽的结构特征和构效关系还有待深入研究,这些研究将为AS预防食品或辅助药物的开发应用提供重要的理论依据。(6)目前,在具有预防AS功效的蛋白质酶解物开发成商业产品前,还需较长时间的临床观察和实验研究,以保证其安全有效性。同时,此类蛋白质酶解物的市场需求及产业化研究也有待进行,为其常态化生产提供基础。对蛋白质酶解物的深入研究,将有益于蛋白质酶解物类膳食补充剂应用于AS的一级或二级预防中,促进人类健康。
