成年男性内脏脂肪面积与腰椎骨密度相关性研究
2020-11-22赵宇宙马蒲阳陈晓静张平方
赵宇宙,马蒲阳,陈晓静,张平方
作者单位:华北石油总医院骨一科,河北 沧州062552
骨质疏松症是指机体由于骨量低下和骨微结构损坏,增加了机体骨脆性,容易发生骨折的一类全身性骨病[1]。其特征主要表现为骨折风险性强、骨强度低,属于骨骼系统性疾病,目前骨质量和骨密度(BMD)是用于反映骨强度的主要方面,其中继发性和原发性骨质疏松是其主要的两种形式,原发性的主要发生人群为绝经妇女和高龄男性[2]。骨质疏松作为一个世界范围内较为严重的一类疾病,在国内统计资料中显示,在60~70岁之间的女性病人高达50%以上,男性占30%左右。而目前随着人口老龄化的增加,骨质疏松症病人的数量和比率也在逐年增加,同时巨额医疗费和骨折也成为社会的广泛关注,仅美国的骨折发生率每年就达150 万[3]。成年男性腰椎骨折确诊率低于髋部骨折确诊率,此外,发生骨质疏松的可能影响因素也包括骨关节病。骨关节病牵扯到骨密度增加和骨增生,因此当发生骨关节病时,骨密度的增加也可能会诱导产生腰椎骨质疏松症。脂肪组织作为人体的重要储能部位,同时也是人体主要的分泌器官。已知,脂肪细胞因子可用于分泌多种生物活性分子,而这些活性分子,如脂联素、瘦素、肿瘤坏死因子等与骨代谢具有明显的相关性[4]。骨密度测量是目前诊断骨质疏松的主要依据[5]。而目前对于成年男性腰椎骨密度的影响因素的相关性尚不明确。本研究通过检测志愿者的体质指数(BMI)、骨密度值、腹部脂肪及皮下脂肪量(SAT)、腹部皮下脂肪面积(SFA)、内脏脂肪量(VAT),并利用多元线性分析研究机体相关参数与骨密度的相关性,进一步探究男性腰椎骨密度与内脏脂肪面积(VFA)相关性。
1 资料与方法
1.1 一般资料 收集 2017年 5月至 2017年 8月入华北石油总医院体检男性共1368 例,年龄(50.91±0.30)岁,年龄范围为25~65 岁。实验开始前需对受试者进行营养和健康状况检查,并按照纳入标准和排除标准进行受试者筛选。纳入标准:成年男性;健康受试者及在临床已被拟诊为骨质疏松病人;年龄在18 周岁以上;受试者对实验检测类型知情并同意参与实验,实验开始前签订同意书。排除标准:患有代谢性疾病;具有肿瘤、糖皮质激素、腰椎、骨折病史;体质量高于80 kg 或身高在1.9 m 以上;试验期间意外骨折或突发意外事件者。研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 定量CT(QCT)法检测腰椎骨密度 利用Toshiba 64 排螺旋CT,根据腰椎QCT 的扫描方案进行设定后开始螺旋扫描,其中设定床高65 cm,电流150 mA,电压120 kV,D-Fov设定400,将校准体模放于受试者的腰下,并紧贴病人腰部,并将实验的扫描范围设定在L1~L2 椎体范围内。测量时,将CT的容积数据转移至QCT 工作站,利用三平面定位,并将椎体的中心层面设定为兴趣区,兴趣区尽量包含松骨质。
1.3 分组 根据欧洲骨密度标准:当骨密度测定值在80~120 mg/cm3范围内时判定为低骨量;当骨密度在120 mg/cm3为正常骨量,即为正常健康人体的骨密度;当骨密度值低于80 mg/cm3判定为骨质疏松。因此可根据以上标准对受试者进行检测判定,进而可根据测定结果,将受试者分为正常骨量组、低骨量组及骨质疏松组。
1.4 体质参数测定 在实验测试当天,各受试者需要保持在空腹状态下,由2 名以上的调查员完成对其体质量、腰围的测量。身高测量标准:受试者在开始测量前需脱去鞋、帽等厚重衣物,随后靠墙站立在平整地面,并保持挺直腰背与滑侧板垂直,且成立正姿势,同时脚跟相互靠拢,脚尖成60 ℃夹角分开,双膝并拢,保持手臂自然放于身体两侧,受试者掌心朝内,并保证脚跟、臀部、肩胛骨成三点一线,测量者读数时,实验员的眼睛和数值需要保持在同一水平面内;体质量指标测量标准:受试者需脱去鞋帽及外套等厚重衣物和挂饰,只穿单层衣服,并无任何物质携带于身上,随后保持立正状态站立在体质量秤上方,且两脚对称站立在体质量秤中央,并让身体呈放松状态,待读数平稳后开始计数;腰围测量标准:以受试者两侧腋下中线弓下缘为中心点,测试者沿中心点开始测量,并保持皮尺与水平面保持平行,与地面成垂直状态,测量员读数时保持目光和皮尺刻度线保持水平,即可开始计数。
1.5 统计学方法 利用SPASS 20.0 分析软件对实验数据进行分析处理,并可对成年男性腰椎的骨密度值与受试者的年龄、BMI、VFA、SFA 进行多元性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组骨密度值及分组 利用QCT法测得L2椎体的骨密度值。根据骨密度范围标准进行判定和分类,将1 368例受试者分为正常骨量组、低骨量组和骨质疏松组三组,其中正常骨量组805例,骨密度值(160.25±17.58)mg/cm3;低骨量组449 例,骨密度值(98.49±9.12)mg/cm3;骨质疏松组114 例,骨密度值(58.02±10.75)mg/cm3。
2.2 三组脂肪量比较 根据QCT 软件中的组织成分功能测定L2椎体所在层面的VAT和SAT含量,结果见表1。根据含量大小也可进行VFA 和SFA 比较。由表1 可知,正常骨量组和骨质疏松组SAT、SFA值相近,但均略高于低骨量组;低骨量组和骨质疏松组VAT和VFA值均高于正常骨量组,同时骨质疏松组VAT、VFA 值明显高于低骨量组,差异有统计学意义(P<0.05)。
2.3 三组体质参数比较 由表2可知,正常骨量组和低骨量组身高、体质量、腰围并无明显差异;而正常骨量组和低骨量组的身高和体质量值均低于骨质疏松组,腰围均高于骨质疏松组。三组受试者的身高、体质量、腰围的测量结果见表2。
表1 定量CT(QCT)法检测体检成年男性1 368例脂肪量比较/
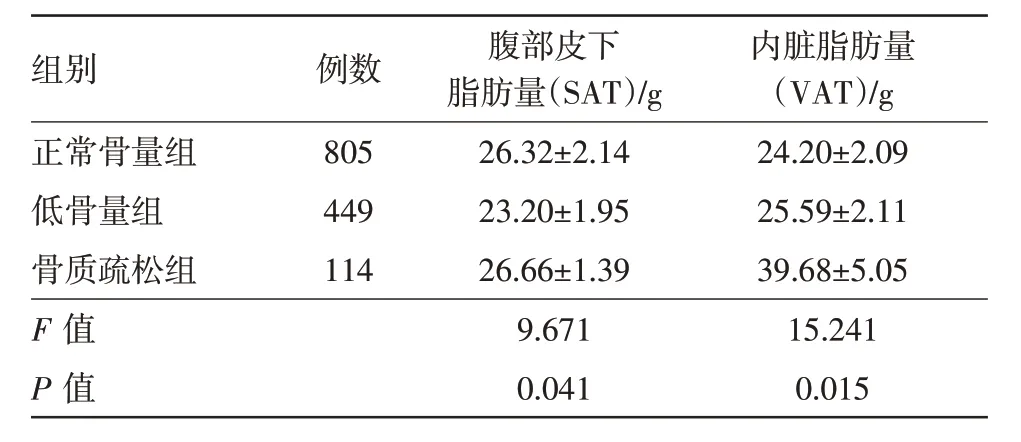
表1 定量CT(QCT)法检测体检成年男性1 368例脂肪量比较/
内脏脂肪量(VAT)/g 24.20±2.09 25.59±2.11 39.68±5.05 15.241 0.015例数805 449 114组别正常骨量组低骨量组骨质疏松组F 值P 值腹部皮下脂肪量(SAT)/g 26.32±2.14 23.20±1.95 26.66±1.39 9.671 0.041
表2 体检成年男性1 368例三组身高、体质量、腰围比较/
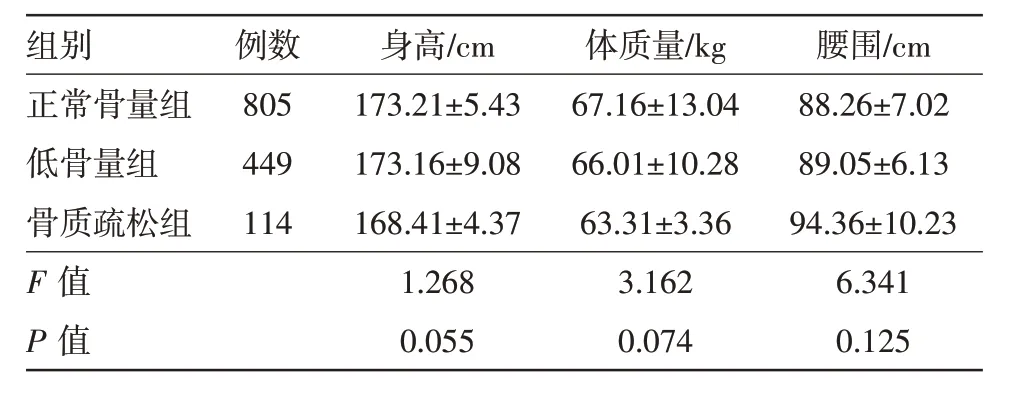
表2 体检成年男性1 368例三组身高、体质量、腰围比较/
腰围/cm 88.26±7.02 89.05±6.13 94.36±10.23 6.341 0.125例数805 449 114组别正常骨量组低骨量组骨质疏松组F 值P 值身高/cm 173.21±5.43 173.16±9.08 168.41±4.37 1.268 0.055体质量/kg 67.16±13.04 66.01±10.28 63.31±3.36 3.162 0.074
2.4 三组年龄及BMI 比较 根据受试者身高、体质量、腰围等数据结果计算得到各组受试者BMI 值及对应年龄的统计结果见表3。低骨量组和骨质疏松组年龄均高于正常骨量组,BMI 值均明显低于正常骨量组;同时,骨质疏松组受试者年龄高于低骨量组,BMI值低于低骨量组。
表3 体检成年男性1368例三组对应年龄及体质指数(BMI)结果/
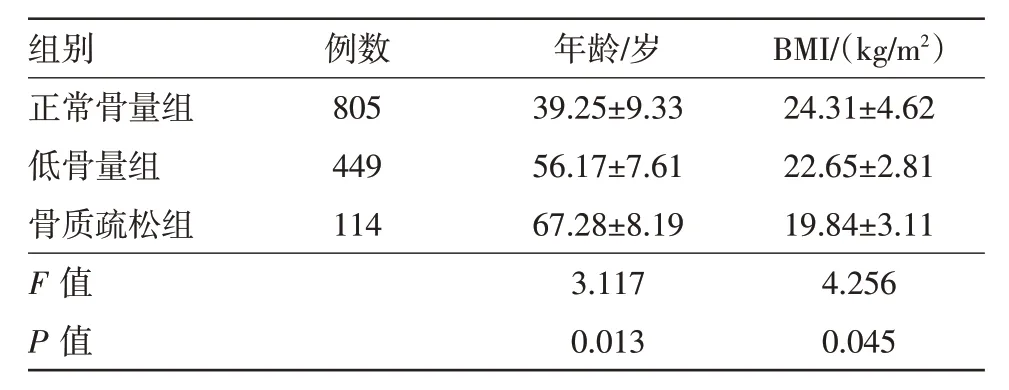
表3 体检成年男性1368例三组对应年龄及体质指数(BMI)结果/
例数805 449 114组别正常骨量组低骨量组骨质疏松组F 值P 值年龄/岁39.25±9.33 56.17±7.61 67.28±8.19 3.117 0.013 BMI/(kg/m2)24.31±4.62 22.65±2.81 19.84±3.11 4.256 0.045
2.5年龄、BMI、VFA、SFA与腰椎骨密度的相关性分析 受试者年龄、BMI、VFA、SFA 指标与腰椎骨密度的相关性分析结果见表4。由表4可知,腰椎骨密度与年龄、VFA 有明显的相关性(P<0.05),并根据各组受试者VFA和骨密度的测定结果可知,男性腰椎骨密度与VFA呈明显的负相关性(P<0.05)。
2.6 VFA、SFA与腰椎骨密度的相关性分析 受试者VFA、SFA 指标与腰椎骨密度的相关性分析见表5。由表5可知,当控制受试者年龄及BMI值因素后,男性腰椎骨密度与VFA 仍具有显著的相关性(P<0.05)。
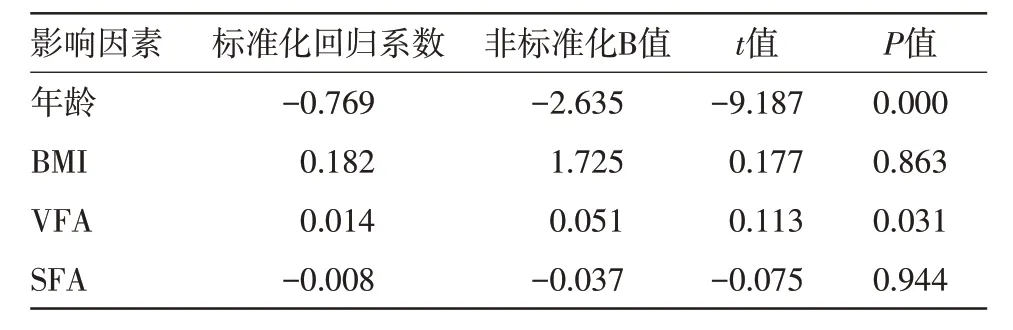
表4 多种因素与腰椎骨密度的相关性分析
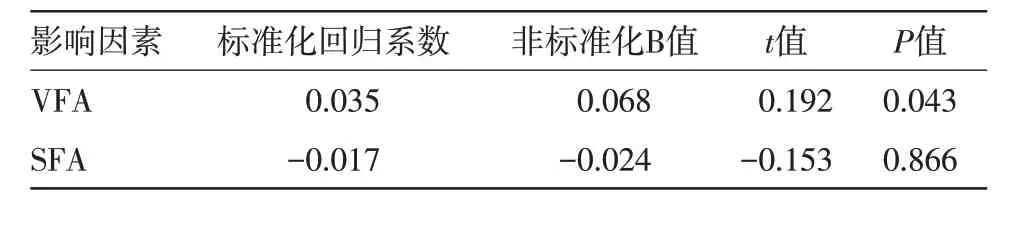
表5 内脏脂肪面积(VFA)、腹部皮下脂肪面积(SFA)与腰椎骨密度的相关性分析
3 讨论
研究表明,正常的成年人骨吸收量和骨形成量保持在动态平衡范围内,每10年骨骼基本可完全更新一次,而随着人体的衰老,其动态平衡被打破,进而发生骨丢失,最终导致人体形成骨质疏松症。腰椎骨折在成年人群中属于比较常见的一种骨质疏松类骨折,其患病率和死亡率具有关联性,且男性腰椎骨折死亡风险高于女性。骨密度可用于反映70%的骨强度,同时世界卫生组织也以此作为诊断骨质疏松的主要指标[6]。QCT是一种较双能量X射线吸收法(DXA)更准确的用于反映骨密度变化的测量方法[7]。
近年来,随着功能不断升级的CT 扫描机使用,利用螺旋CT 功能进行骨密度测量已逐渐成为一种常用检查方法,主要用于股骨近端、脊柱、胫骨、前臂等部位的骨密度检测。QCT 具有独特的功能,可将松质骨和皮质骨分开测量,并能反映小梁结构和几何学信息。BMI 是反映人体健康素质的综合指标,大量研究报道,低BMI 是诱导骨质疏松发生的重要危险因素,增加了机体发生骨折的概率[8]。增加体质量可加强人体骨骼强度,降低骨质疏松发生,但过低或过高都将会引发严重的后果,因此,BMI和骨折部位均可作为重要的考虑因素[9]。大量学者认为内脏脂肪、体质指数、皮下脂肪等与肥胖相关的参数与骨密度具有相关性。内脏脂肪组织主要分布在人体的肠系膜和大网膜,拥有较为丰富的神经分布和血流供应,可通过门静脉进入肝脏,同时具有多种代谢活性。脂肪组织能通过改变机体骨骼代谢和机械负荷来影响机体骨密度,而内脏脂肪较体质参数、BMI 等与骨质疏松骨密度具有不一样的相关性[10]。诊断人体是否患有骨质疏松的重要依据为骨密度测量值[11-12]。
本研究发现低骨量组和骨质疏松组年龄、VFA均高于正常组,BMI低于正常骨量组,男性腰椎骨密度值与其VFA具有明显的负相关性。目前,临床上对于骨密度测定主要有QCT和DXA两种方法,其中QCT 能用于三维骨密度的测量,且受血管钙化、脊柱退变、体位、口服对比剂等的影响较小,因此被认为是定量评价人体骨质疏松程度方法中较为准确的一种,且在国际上也得到广泛的应用和认可。研究发现,女性在50 岁以上极易产生骨质疏松症状,且72.73%在60 岁以上,而在男性骨质疏松中60 岁以上仅占42%,但骨密度和BMI、性别、腹部脂肪之间的关系一直以来存在着较大争议[13]。张晓东等[14]发现腰椎骨密度和BMI 之间并无显著关系。研究发现,人体臀部和腹部脂肪是影响男性骨密度的重要因素,其中腹部脂肪与老年女性的骨密度之间具有明显的负调节作用[15]。Choi等[16]研究发现,女性腰椎骨密度和内脏脂肪具有负相关性,且男性腰椎骨密度与内脏脂肪亦具有相关性,但其具体的相关性问题仍需进一步验证。已知内脏脂肪较SAT、腰围等更能有效地反映人体骨密度的变化与脂肪含量关系[17]。研究发现,人体脂肪组织不但可作为机体能量的储存站,且能分泌多种炎症因子,具备强大的分泌功能,分泌的炎症因子可用于介导骨间和脂肪的联系,基因表达部位也具有明显特异性[18]。目前,研究认为心脏脂肪和腹部脂肪在功能和形态上具有较大差异,因此对骨的效用也不同[19]。研究表明,腹部和腰部脂肪并不能确切反映内脏脂肪的含量,因此用于分析骨密度和肥胖之间的关系也并不准确,但QCT可准确测量出人体内脏脂肪和腹部脂肪,可作为骨密度与心脏脂肪评估的主要方法[20],并有研究表明,男女性的腰围和内脏脂肪对其腰椎骨密度有明显差异性[21]。Campos等[22]研究发现,人体内脏脂肪含量多少与肥胖女性的骨密度之间具有密切关联,同时Ackerman等[23]亦证实女性骨密度和其皮下脂肪具有正相关性,与内脏脂肪具有负相关性(r=0.55,P=0.0002)。在对127 例骨质疏松病人的研究中发现,骨密度和BMI、体质量、皮下脂肪均含正相关性,与内脏脂肪呈现负相关性[24]。
综上所述,男性腰椎骨密度与内脏脂肪组织呈负相关,内脏脂肪组织可为临床腰椎骨质疏松性骨折诊治提供理论依据。
