血清降钙素原和C反应蛋白对肝硬化腹水自发性细菌性腹膜炎的诊断价值
2020-11-21刘淑荣赵文静
刘淑荣 刘 薇 赵文静
吉林省肝胆病医院,吉林长春 130062
腹水是肝硬化最突出的临床表现,75%以上肝硬化失代偿期患者有腹水[1],自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)是肝硬化腹水患者常见而严重的并发症,SBP可迅速发展为感染性休克和肝肾功能衰竭,诱发肝性脑病,是终末期肝病患者的主要死亡原因之一[2-3]。未经及时治疗SBP患者病死率接近50%~60%[4],早期诊断和治疗对改善SBP患者预后至关重要[5-6]。SBP的诊断主要依据诊断性腹水穿刺后腹水细胞学及病原学检查,即多形核细胞(polyremorphonuclear,PMN)计数和腹水培养[7]。在临床实践中多数SBP患者临床表现不典型,临床表现又常因肝功能异常突出表现而被忽视。腹水培养阳性率低,耗时长,腹水PMN计数仍是目前临床诊断SBP重要而常用的指标。但腹水PMN计数容易受腹水稀释、腹腔穿刺损伤等诸多因素影响,SBP早期易被漏诊、误诊而延迟治疗,影响疾病的转归[8-9]。降钙素原(procalcitonin,PCT)和C反应蛋白(C-reactive protein,CRP)作为感染性炎症标志物已广泛应用于感染性疾病的快速筛查或早期诊断[10]。本研究回顾分析86例肝硬化腹水患者的临床资料,探讨血PCT与CRP在肝硬化腹水并SBP中的诊断价值,用于指导SBP的早期诊断和治疗。
1 资料与方法
1.1 一般资料
收集吉林省肝胆病医院肝病科2 0 1 6年1月~2018年12月收治住院的315例肝硬化腹水患者的临床资料,年龄18~70岁,其中男209例,女106例。纳入标准:(1)临床资料完整,且入院后同时进行血PCT、CRP、腹水常规和腹水培养检测;(2)符合SBP诊断标准:①临床症状表现为不同程度的发热、腹胀、少尿;②腹膜炎症状或体征;③腹水PMN≥250×106/L,血常规白细胞总数或分类升高;④腹水培养发现致病菌;符合③或④条为SBP确诊标准。排除标准:①合并其他部位感染的患者,如肺部、泌尿系统、口腔、胆道,或发生继发性腹腔感染;②结核性、癌性腹水;③糖原蓄积病。315例肝硬化腹水患者,按照排除标准排除且严格参照2010年EASL制定的肝硬化腹水临床实践指南诊断标准筛选,最终纳入86例肝硬化腹水患者,根据患者是否发生SBP分成两组:52例肝硬化腹水患者并发腹水感染(SBP组),34例非感染性腹水患者(非SBP组)。诊断标准:肝硬化腹水诊断参照2011年《肝硬化腹水的中西医结合诊疗共识意见》[11];SBP诊断参照欧洲肝病研究会(european association for the study of the liver,EASL)肝硬化腹水临床实践指南[7]。
1.2 临床资料收集
本研究收集的患者临床资料包括患者性别、年龄、肝硬化病因;腹水检测包括腹水细菌培养、腹水PMN计数、血清PCT和CRP检测。收集的相关检测项目的时间点为患者腹水标本采集当天。住院期间多次检测或同日内多次检测则取首次检测结果。
1.3 血清PCT和CRP的检测方法
电化学发光法检测血清PCT,仪器为罗氏COBAS-E601全自动免疫分析仪,参考范围为0~0.05ng/mL;免疫透射比浊法检测血清CRP,仪器为OLYMPUS 7100全自动生化分析仪,试剂购自宁波美康生物科技有限公司,参考范围为0~6mg/L。
1.4 统计学分析
采用SPSS20.0统计学软件对数据进行统计分析,正态分布计量资料以()表示,组间比较采用t检验;非正态分布资料采用四分位数M(P25~P75)表示,组间比较采用两独立样本秩和检验;计数资料以百分比(%)表示,采用χ2检验,P<0.05为差异有统计学意义;血清PCT、CRP单独和联合检测对肝硬化腹水并SBP的预测价值采用受试者工作曲线(ROC)分析。
2 结果
2.1 两组患者一般资料比较
两组患者一般资料见表1。SBP组血清PCT、CRP均高于非SBP组,差异有统计学意义(P<0.05)。
2.2 SBP患者腹水细菌培养结果
52例SBP患者进行腹水培养,13例培养出致病菌,阳性率为25.0%,其中PMN≥250×106/L的SBP患者中6例腹水培养阳性,阳性率为13.3%。腹水细菌培养的结果分布为:革兰阴性菌9例,占69.2%,其中大肠埃希菌4例、肺炎克雷伯菌3例、鲍曼不动杆菌1例、气单胞菌1例;革兰阳性菌4例,占30.8%,其中肺炎链球菌2例,表皮葡萄球菌1例,金黄色葡萄球菌1例。

表1 两组患者一般资料比较
2.3 血清CRP、PCT、CRP+PCT水平对肝硬化腹水并SBP的预测价值
采用ROC曲线分别评估血清PCT、CRP单独检测和联合检测的诊断效能,结果显示,CRP的最佳截断值为46.3mg/L;PCT的最佳截断值为0.54ng/mL。综合分析的ROC曲线下面积AUC值和约登指数,CRP+PCT联合检测的预测价值优于两项指标单独检测。见图1~3,表2。

图1 血清CRP预测肝硬化腹水并SBP的ROC曲线
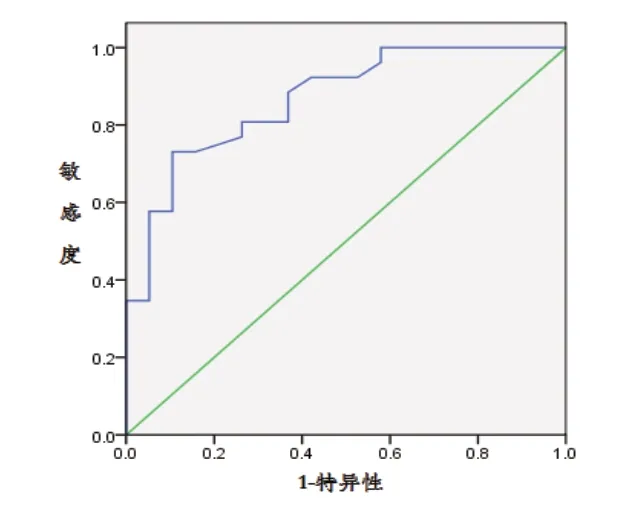
图2 血清PCT预测肝硬化腹水并SBP的ROC曲线

图3 血清CRP和PCT联合预测肝硬化腹水并SBP的ROC曲线
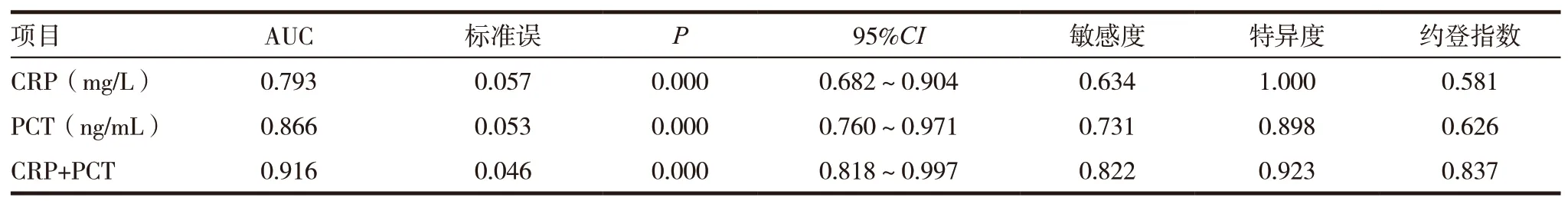
表2 血清CRP、CPT、CRP+PCT对肝硬化腹水并SBP的预测价值
3 讨论
肝硬化失代偿晚期患者易产生腹水,腹水的产生标志着患者肝脏代偿能力减低,机体免疫力低下极易发生感染。SBP是肝硬化腹水患者常见的感染性疾病之一[12]。SBP发病机制复杂多样,门脉高压引起肠壁水肿继而通透性增加,肠黏膜功能受损,肠道菌群紊乱、有害细菌异常增殖、菌群失调移位进入腹腔,以及机体防御机能减弱是其发病的重要环节[13]。肝硬化腹水患者一旦发生SBP,可能引起感染性休克,或造成肝、肾功能衰竭,对患者预后影响非常大,死亡率明显增加[14],SBP的早期诊断治疗是防止肝硬化腹水患者病情继续恶化的有效手段。腹水细菌培养是诊断SBP的金标准[15],但研究表明,肝硬化SBP患者腹水细菌培养耗时长且阳性率低,严重影响了SBP的早期诊断和治疗。本组资料显示,52例SBP患者腹水细菌培养仅13例阳性,阳性率为25.0%,PMN≥250×106/L的SBP患者中6例腹水细菌培养阳性,阳性率为13.3%,必须建立快速、准确、易于临床实施的SBP诊断指标,早期诊断,早期抗感染治疗,降低死亡率。
CRP是一种急性时相蛋白,由肝脏合成,在急性感染或组织损伤时,CRP的合成在4~6h内迅速增加,36~50h达峰值,峰值为正常值的100~1000倍,体内半衰期为19h[16]。血清CRP水平是指示细菌感染的一项敏感而客观的指标,不受年龄、性别、贫血、妊娠等因素影响[17]。PCT是降钙素前体,正常情况下由甲状腺细胞产生,在细胞内全部酶解为降钙素和其他片段,健康人血液中几乎检测不到(<0.1ng/mL)。研究发现,机体细菌感染后,在内毒素和炎症细胞因子等作用下,PCT在各个组织、器官大量形成并释放进入血液循环系统,血中PCT可升高至10~100ng/mL,此时的PCT主要来源于甲状腺外组织[18]。研究认为,血清CRP与PCT是判断细菌性感染的有效指标,在细菌感染性疾病诊断中均有一定价值,有助于实现快速筛查或诊断细菌感染性疾病。本研究回顾性分析52例SBP患者和34例非SBP患者血清CRP和PCT水平,结果显示SBP组患者血清PCT和CRP分别为1.37(0.83 ~ 3.93)和68.2(26.25 ~ 127.10),明显高于非SBP组的0.17(0.12 ~ 0.24)和8.4(6.10 ~ 22.8),差异有统计学意义(P<0.05)。采用ROC曲线分别评估血清CRP、PCT、CRP+PCT对肝硬化腹水并SBP的预测价值,研究结果显示ROC曲线下面积均>0.60,总体预测效果良好。CRP的AUC值为0.793,最 佳 截 断 值 为46.3mg/L,95%CI(0.682~0.904);PCT的AUC值为0.866,最佳截断值为0.54ng/mL,95%CI(0.760~0.971);CRP和PCT联 合 诊 断AUC值 为0.916,95%CI(0.818~0.997),CRP+PCT的ROC曲线下面积AUC值和约登指数优于两项指标单独检测。
综上所述,血清 CRP和PCT检测快速简便,在肝硬化腹水并SBP患者明显升高,且二者联合检测对肝硬化腹水并 SBP 的诊断预测价值较高,早期检测血清CRP和PCT水平对肝硬化腹水并SBP的早期诊断、治疗具有一定的临床价值。本研究为回顾性分析,且样本量较小,今后还需扩大样本量进行前瞻性研究进一步探讨。
