PELP1在胃癌中的致瘤作用*
2020-11-21颜洪竹孙燕玲孙元鹏刘于思韦先明刘尚勤肖武汉宁志丰刘复兴
颜洪竹, 孙燕玲, 吴 喆, 孙元鹏, 刘于思, 韦先明, 马 梓, 刘尚勤, 肖武汉, 宁志丰△, 刘复兴△
1湖北医药学院基础医学院,十堰 442000 湖北科技学院 2基础医学院 3临床医学院,咸宁 437100 武汉大学中南医院 4中医科 5血液科,武汉 430070 6中国科学院水生生物研究所鱼类低氧生物学学科组,武汉 430072
胃癌是全球最常见的癌症之一,也是癌症致死的主要原因[1]。在中国,由于老龄化以及不健康的生活方式,如盐的摄取过多、吸烟、酗酒、幽门螺杆菌感染率高等,导致胃癌的发病率位列肿瘤发生率第2位[2]。近年来,虽然胃癌的发病机制正在被逐步阐明,治疗方法也得到进一步改善,但进展期胃癌患者的5年生存率和总生存时间依然徘徊在较低水平,复发和转移仍然是胃癌患者死亡的主要原因。
脯氨酸-谷氨酸-亮氨酸富集蛋白1(proline-,glutamic acid-,and leucine-rich protein 1,PELP1)是雌激素受体非基因组作用的调节剂和雌激素受体的共调节剂,其基因定位于17号染色体的p13.2区域,编码长度为1130氨基酸的蛋白质。编码的蛋白质氨基端为10个LXXLL基序(motif)(X为任意氨基酸残基)组成的核受体结合区,羧基端为富含谷氨酸的结构域,并含有2个富含脯氨酸的结构域。作为多种转录因子的共激活因子,PELP1参与许多生理[3-5]和病理过程[6],生物学功能广泛。研究表明,PELP1是激素依赖性肿瘤如乳腺癌[7-8]、卵巢癌[9]、子宫内膜癌[10-11]和前列腺癌[12]的原癌基因,此外,在激素非依赖性肿瘤如脑肿瘤[13]、肺癌[14]和结直肠癌[15-16]中亦有作用。本研究探讨了PELP1与胃癌的关系,现报道如下。
1 材料与方法
1.1 细胞系和培养方法
人胃腺癌细胞(AGS细胞和NCI-N87细胞)购自中国科学院(中国上海)典型培养物保藏中心,正常人胃上皮细胞(GES-1细胞)购自美国典型培养物保藏中心(Manassas,VA,美国)。上述细胞均培养于含10%胎牛血清(Gibco公司)、100 U/mL青霉素和100 μg/ mL链霉素的RPMI 1640培养液中,置于37℃、5%CO2的饱和湿度细胞培养箱中培养。
1.2 PELP1通路信息预测及筛选
从Oncomine(http://www.oncomine.org)和CCLE(Cancer Cell line Encyclopaedia)获得PELP1在不同癌症组织、不同类型胃癌组织以及正常胃黏膜组织中mRNA表达情况。利用Biocarta数据库预测人类细胞中的PELP1通路信息并筛选出Src-Erk通路,该通路是PELP1调节雌激素受体活性的重要通路(https://cgap.nci.nih.gov/Pathways/BioCarta_Pathways)。
1.3 组织芯片及免疫组化技术检测PELP1蛋白在胃癌及癌旁组织的表达
胃癌及癌旁组织芯片(tissue microarray,TMA)购自谷歌生物公司。该芯片包括36组胃癌组织及其相应正常癌旁胃黏膜组织标本,并含有全部36例患者的临床病理资料和随访资料。所有标本均经4%甲醛固定、常规组织脱水处理、石蜡包埋。采用手工组织芯片点样仪制作组织芯片。制备好的芯片以PELP1多克隆抗体(稀释度1∶100,ABclonal,货号A13414)进行免疫组织化学染色。组织芯片的免疫组织化学染色结果由病理医师遵循双盲原则进行评判,在200倍光学显微镜下随机计数5个视野,统计阳性细胞所占百分比。统计计分从两个方面来评价,①染色阳性细胞数:<5%为0分,5%~为1分,25%~为2分,>50%为3分;②染色强度:无细胞着色计0分,呈淡黄色着色计1分,棕黄色着色计2分,深褐色着色计3分。将每例两项得分相加即为该肿瘤阳性表达得分。最低得分为0分,最高得分为6分;≤2分为阴性或弱表达,3~4分为中度阳性,5~6分为强阳性。阳性表达包括中度阳性及强阳性。同时每张切片取5个随机视野,通过分析软件(Image-pro plus 6.0)测定图片的平均吸光度作为PELP1染色强度,以此半定量PELP1的组织表达水平。
1.4 Western blot检测细胞中PELP1的蛋白表达水平
收集细胞,使用RIPA缓冲液[1%Triton X-100,50 mmol/L Tris-HCl(pH 7.2),0.1%SDS和1 mmol/L EDTA,150 mmol/L NaCl,1%脱氧胆酸钠]提取总蛋白,使用二辛可宁酸定量。每个蛋白样品取20~25 μg,经SDS-PAGE凝胶电泳分离蛋白,将蛋白条带转移至硝酸纤维素膜上,以含有5%牛血清白蛋白的TBST缓冲液洗膜约1 h,与下列一抗在4℃下孵育过夜:兔抗-PELP1抗体(稀释度1∶1000,ABclonal,货号A3189),抗c-Src抗体(稀释度1∶1000,ABclonal,货号A0324),抗Phospho-Src-Y529抗体(稀释度1∶500,ABclonal,货号AP0185)和小鼠多克隆GAPDH抗体(稀释度1∶1000,Santa Cruz,货号SC-47724)。一抗孵育结束以TBST洗膜,室温下将膜与辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(稀释度1∶5000,Proteintech)或山羊抗小鼠IgG二抗(稀释度1∶20000,Proteintech)孵育,显影。利用Fujifilm LAS4000微型发光图像分析仪和Multi Gauge V3.0图像分析软件(FujiFilm公司,日本)分析显影条带,以GAPDH为内参。
1.5 实时定量PCR检测细胞中PELP1 mRNA表达水平
按照文献[16]的方法提取细胞RNA并进行实时定量PCR(qRT-PCR)。收集细胞,用Trizol试剂从细胞中提取总RNA,定量后利用M-MLV反转录试剂盒合成cDNA。随后以cDNA为模板,使用QuantiTectSYBR®GreenRT-PCR试剂盒进行qRT-PCR扩增。以GAPDH为内参,采用2-ΔΔCt方法计算相对表达量。特定引物的序列见表1。
1.6 PELP1-siRNA转染细胞
利用Ambion网站设计3对PELP1-siRNA(表2),分别为PELP1-siRNA1、PELP1-siRNA2、PELP1-siRNA3,其阳性对照和阴性对照购自GenePharma公司(中国上海)。通过鉴定,选择干扰效果最好的PELP1-siRNA1进行后续转染实验。将密度为1×106/孔的AGS细胞接种于6孔板,37℃、5%CO2培养24 h,直至细胞融合达到70%~90%,使用Lipofectamine 2000(Invitrogen公司)进行转染。转染48 h后,收集AGS胃癌细胞为实验组,未作处理的AGS胃癌细胞为对照组,进行后续实验。使用的PELP1-siRNA序列见表2。
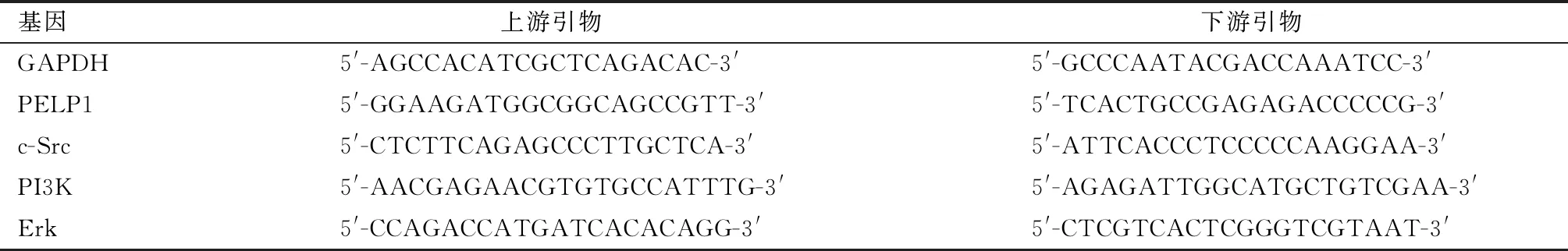
表1 qRT-PCR引物序列Table 1 Primers for qRT-PCR

表2 PELP1-siRNA序列Table 2 PELP1-siRNA sequence
1.7 CCK-8检测细胞增殖
将细胞以1×103/孔的密度接种在96孔板中,培养24 h,分组处理48 h后吸去培养上清,加入10 μL CCK-8(Dojindo,日本),孵育4 h,分光光度仪(Molecular Devices,澳大利亚)测量450 nm波长处的吸光度值(A450 nm)。
1.8 平板克隆形成实验
将细胞接种于6 cm平板(Costar),调整密度分别为50、100、200个细胞/板,以完全培养液、37℃、5%CO2培养约7 d。PBS洗涤细胞2次,甲醇固定15 min,0.1%结晶紫染色20 min,在光学显微镜下(×100)计数直径超过50 μm的细胞克隆数。以克隆形成率表示细胞的增殖能力,克隆形成率=克隆数/接种细胞数×100%。
1.9 划痕实验
选取对数生长期细胞植入6孔板中,每孔5×103个细胞,以无血清培养液培养过夜。换完全培养液,以10 μL加样枪头于皿底部中间划痕,分别于0、12、24 h在倒置相差显微镜下观察划痕区域并拍照,利用Image J软件计算划痕面积和伤口愈合百分比。
1.10 EdU细胞增殖活性测定
将处于对数生长期的细胞以1×106个细胞/孔的密度接种于6孔板中的盖玻片上,分组处理后将细胞与完全培养液和50 μmol/L EdU在37℃下孵育2 h。孵育结束以预冷的PBS洗涤盖玻片,并在室温下以4%甲醛水溶液固定30 min。固定后的细胞用100 μL Apollo染色溶液处理30 min,随后在0.4%Triton X-100中洗涤3次,以100 μL Hoechst33342孵育30 min,PBS洗涤细胞3次后在荧光显微镜(×200,×400)下采用图像分析软件Image-pro plus 6.0进行拍照和荧光强度分析,每个样本至少选取5个视野,取其平均值。
1.11 流式细胞术检测细胞周期
将细胞在4℃的70%乙醇中固定30 min,用磷酸盐缓冲盐水(PBS)洗涤后,将细胞用0.1%Triton 100(Sigma),20 μg/mL RNase A(Sigma)和10 μg/ mL碘化丙啶(Sigma)染色30 min,FACScan流式细胞仪检测细胞周期。
1.12 Transwell侵袭和迁移实验
细胞用无血清培养液以1×106/孔接种在Transwell小室(8 μm,BD Biosciences)上室[迁移实验不铺基质胶,侵袭实验用基质胶(BD biosciences)填充上室的底部],下室中加入含有10%FBS的RPMI 1640培养液500 μL,培养16~24 h,用棉签除去未迁移或侵入孔的细胞,固定膜下表面的迁移细胞,0.1%结晶紫染色。显微镜下取5个不同视野计数膜底部的细胞,并计算平均值。
1.13 统计学分析
2 结果
2.1 PELP1在人胃癌组织中显著表达上调
首先利用Oncomine数据库评估不同癌症组织、不同类型胃癌组织以及正常胃黏膜组织中PELP1 mRNA表达情况(图1),结果表明,相对于正常胃黏膜组织,PELP1 mRNA在胃癌组织中显著表达上调。接着我们利用组织芯片对36例胃癌患者的胃癌组织及癌旁正常胃黏膜组织中PELP1的表达进行免疫组织化学染色及半定量分析,结果(图2)表明,PELP1在胃癌组织中的表达显著高于癌旁组织[平均吸光度值(0.346±0.017)vs.(0.235±0.012),P<0.05]。
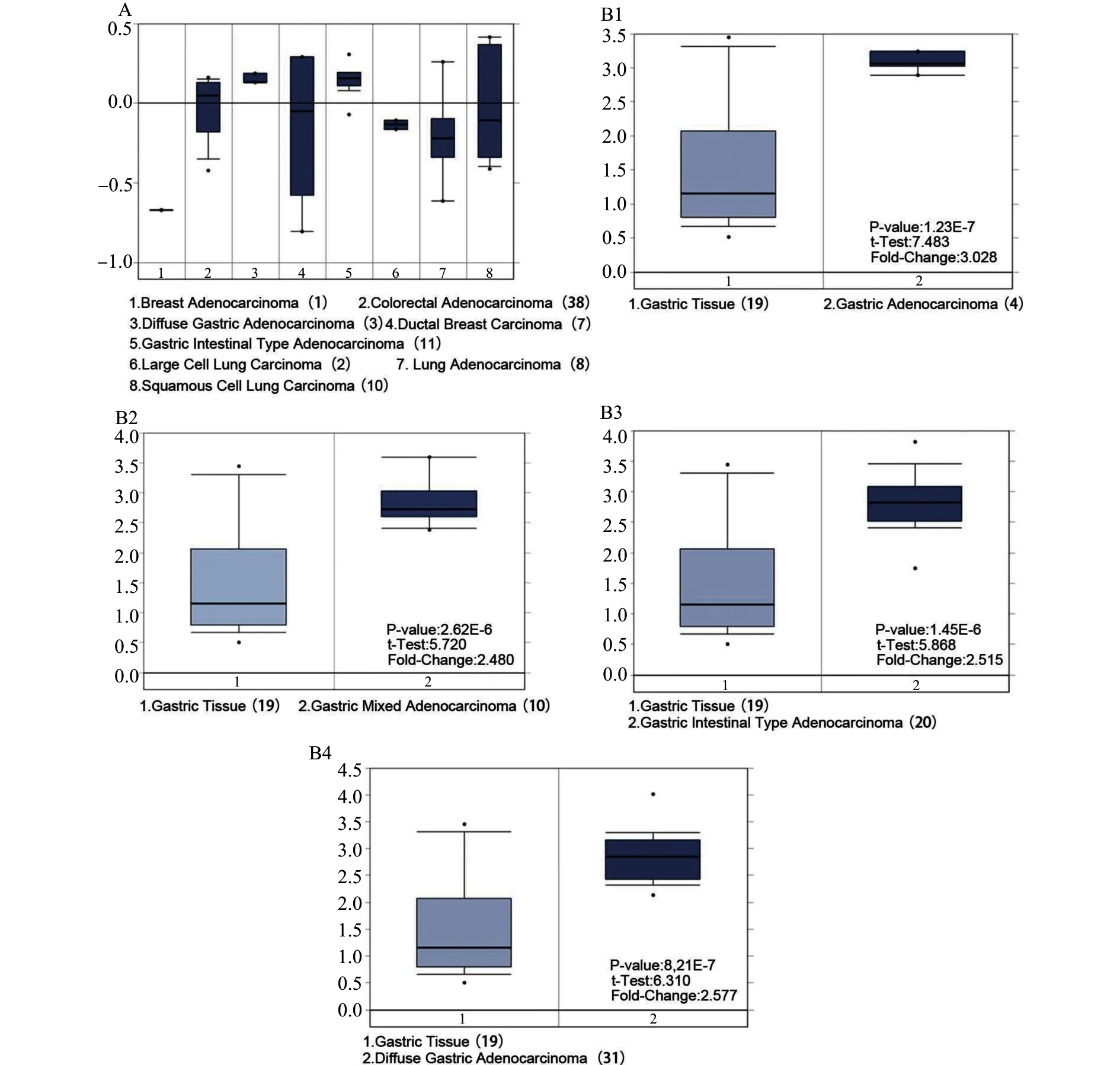
A:PELP1 mRNA在不同癌组织中的表达;B1~B4:PELP1 mRNA在正常胃组织与不同类型胃癌组织中的表达图1 Oncomine数据库评估不同癌症组织、不同类型胃癌组织以及正常胃黏膜组织中PELP1 mRNA表达Fig.1 Expression of PELP1 mRNA in different cancer tissues,different types of gastric cancer tissues and normal gastric mucosa tissues evaluated by Oncomine database
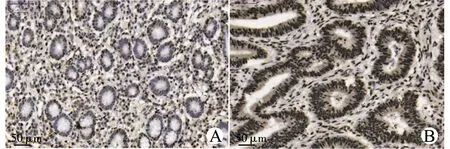
A:癌旁胃黏膜组织;B:胃癌组织图2 免疫组织化学染色检测组织芯片中胃癌组织及癌旁正常胃黏膜组织中PELP1的表达Fig.2 Detection of the expression of PELP1 in gastric cancer tissues and normal gastric mucosa tissues adjacent to cancer by immunohistochemical staining
2.2 PELP1表达与胃癌患者临床病理特征及预后的关系
将组织芯片提供的患者临床病理资料与其胃癌组织PELP1表达情况进行相关分析(表3),结果提示胃癌组织中PELP1的表达与肿瘤分期和分级正相关(均P<0.05),而与患者年龄、性别、肿瘤大小均无明显相关。
为了明确PELP1表达与胃癌预后之间的关系,进一步分析来自Oncomine的生物信息学数据。生存分析结果表明,PELP1表达水平较低患者的总生存期(overall survival,OS)优于PELP1表达水平较高的患者(图3A)。Box图数据进一步显示PELP1水平与胃癌患者的肿瘤分级密切相关(图3B)。对组织芯片提供的36例胃癌患者的临床随访资料进行生存期分析,结果也提示PELP1表达较低的患者有更长的总生存期(图3C)。
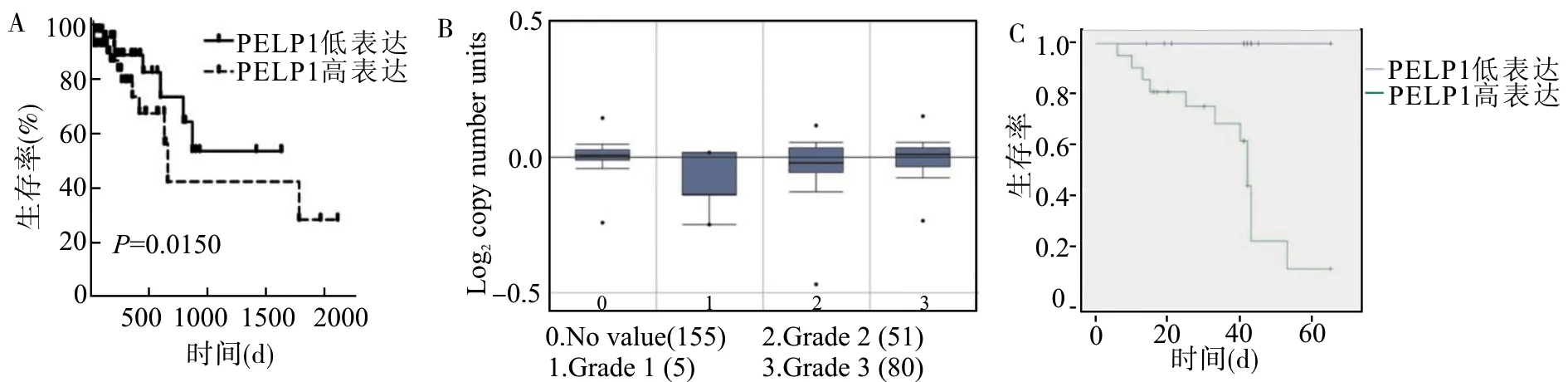
A:利用Oncomine数据库资料生成的生存曲线;B:利用Oncomine数据库获得胃癌等级箱形图显示PELP1的表达与肿瘤分级的关系;C:根据组织芯片提供的36例胃癌患者临床随访资料绘制的生存曲线图3 PELP1表达与胃癌患者生存预后的关系Fig.3 Correlation of PELP1 expression and prognosis of gastric cancer patients
2.3 PELP1在不同胃细胞系中的表达
通过CCLE数据库得到PELP1 mRNA在不同胃细胞系中的表达情况(图4)。进一步选择胃腺癌细胞系AGS、NCI-N87以及正常人胃上皮细胞GES-1,以Western blot和qRT-PCR分别检测其中PELP1蛋白和mRNA的表达,结果表明AGS细胞中PELP1的蛋白和mRNA表达均较正常胃上皮细胞GES-1显著升高(图5)。
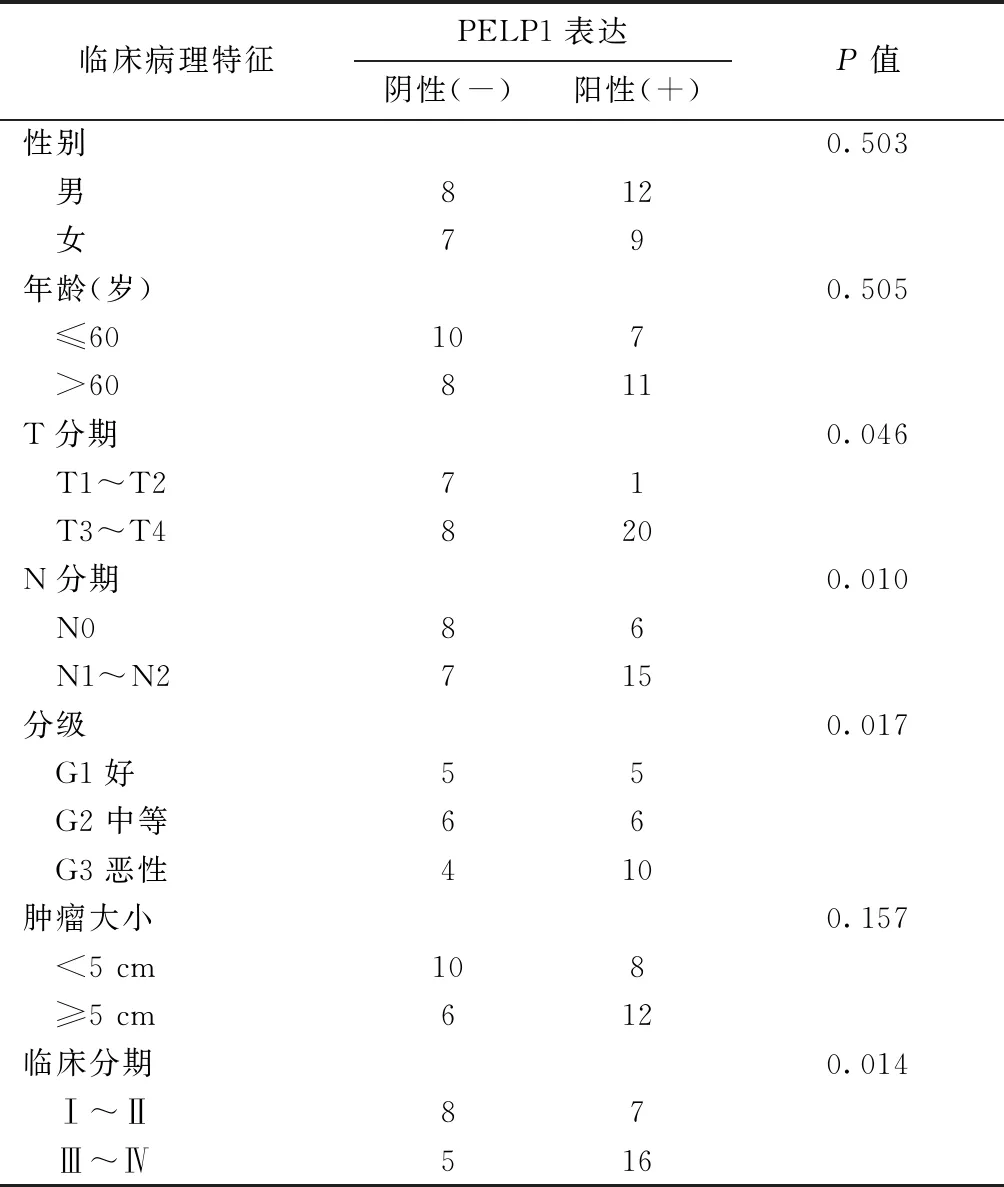
表3 利用组织芯片资料分析PELP1表达与胃癌 患者临床病理特征的关系(例)Table 3 The relationship between PELP1 expression and clinicopathological characteristics of gastric cancer patients using tissue microarray data(n)
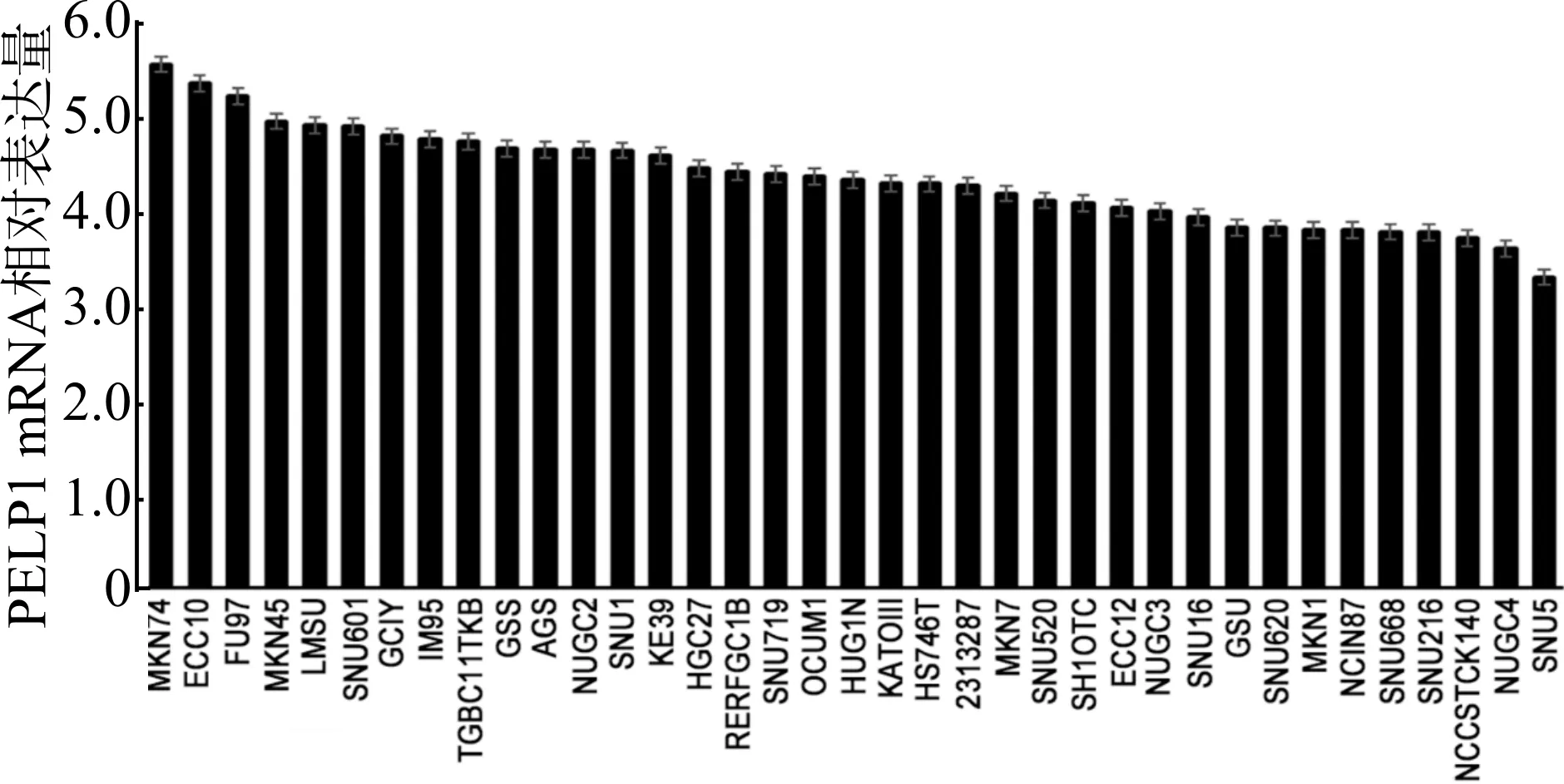
图4 CCLE数据库中PELP1在不同胃细胞系的表达Fig.4 Expression of PELP1 mRNA in different gastric cell lines in CCLE database
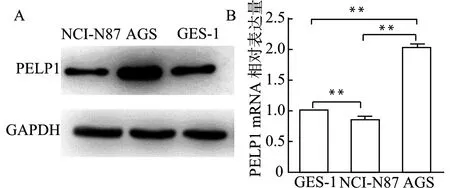
A:Western blot检测PELP1蛋白表达;B:qRT-PCR检测PELP1 mRNA表达,**P<0.01图5 PELP1在正常胃上皮细胞及不同胃癌细胞株中的表达Fig.5 Detection of PELP1 expression in normal gastric epithelial cells and different gastric cancer cell lines
2.4 沉默PELP1在体外抑制胃癌细胞的生长、迁移和侵袭
为确定PELP1的表达变化对胃癌细胞生长、迁移和侵袭等生物学特征的影响,我们设计合成了3个PELP1-siRNA干扰AGS细胞中PELP1的表达,其中PELP1-siRNA1干扰效率最高,Western blot和qRT-PCR结果均显示PELP1-siRNA1转染可显著下调AGS细胞中PELP1的表达(图6)。
CCK-8实验结果显示,敲低PELP1表达的AGS细胞(实验组,PELP1-siRNA组)较未转染的AGS细胞(对照组,PELP1-control组)细胞增殖明显减少(P<0.01,图7);流式细胞术检测显示实验组S期细胞占比显著高于对照组(P<0.05,图8),提示PELP1敲低可阻止细胞周期从S期进展到M期;EdU细胞增殖检测的结果显示实验组细胞平均荧光强度较对照组降低(P<0.05,图9),提示敲低PELP1表达后AGS细胞DNA复制减缓、增殖活性降低;平板克隆实验同样证实敲低PELP1的表达抑制AGS细胞的增殖(图10)。
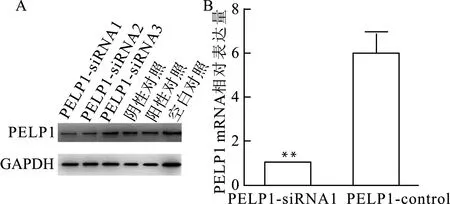
A:Western blot检测siRNA转染后PELP1的蛋白表达;B:qRT-PCR检测siRNA转染后PELP1 mRNA的表达,与对照组(PELP1-control)比较,**P<0.01图6 PELP1-siRNA干扰AGS细胞中PELP1的表达Fig.6 Expression of PELP1 in AGS cells interfered by PELP1-siRNA
划痕实验显示敲低PELP1表达抑制了AGS细胞的迁移(图11);Transwell细胞迁移和侵袭实验也证明敲低PELP1表达减弱了AGS细胞的迁移和侵袭能力(图12)。
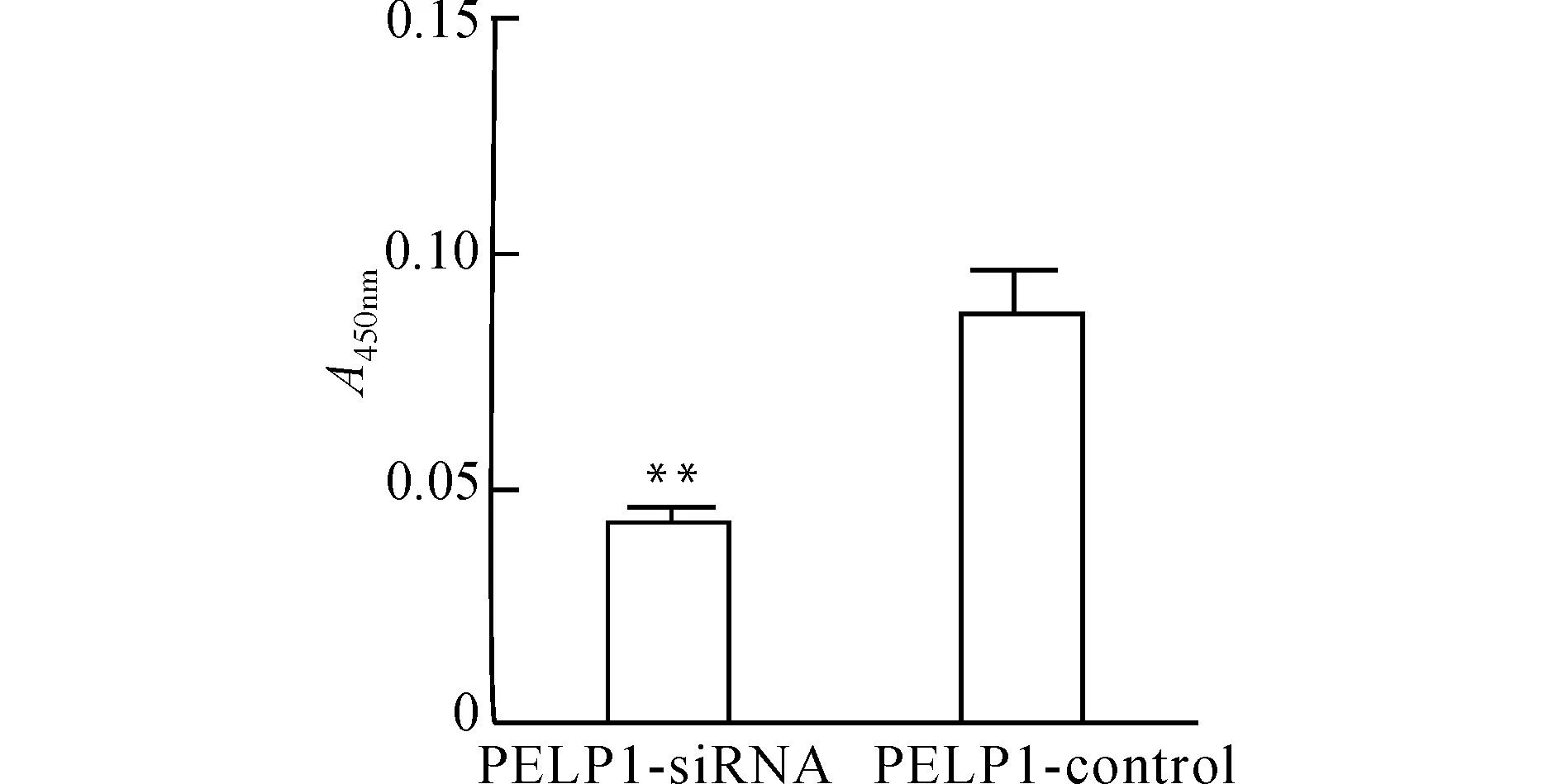
与对照组(PELP1-control)比较,**P<0.01图7 CCK-8实验检测细胞增殖Fig.7 Detection of cell proliferation by CCK-8
2.5 PELP1靶向Src、PI3K和Erk
利用Biocarta数据库预测人类细胞中的PELP1通路信息并筛选出Src-Erk通路。通过siRNA敲降AGS细胞中PELP1表达后,采用qRT-PCR和Western blot检测Src-Erk通路相关信号分子的表达。结果显示,实验组细胞c-Src和p-Src的蛋白表达水平降低(图13A),c-Src、PI3K和Erk的mRNA表达水平也较对照组明显降低(均P<0.01,图13B、C、D)。
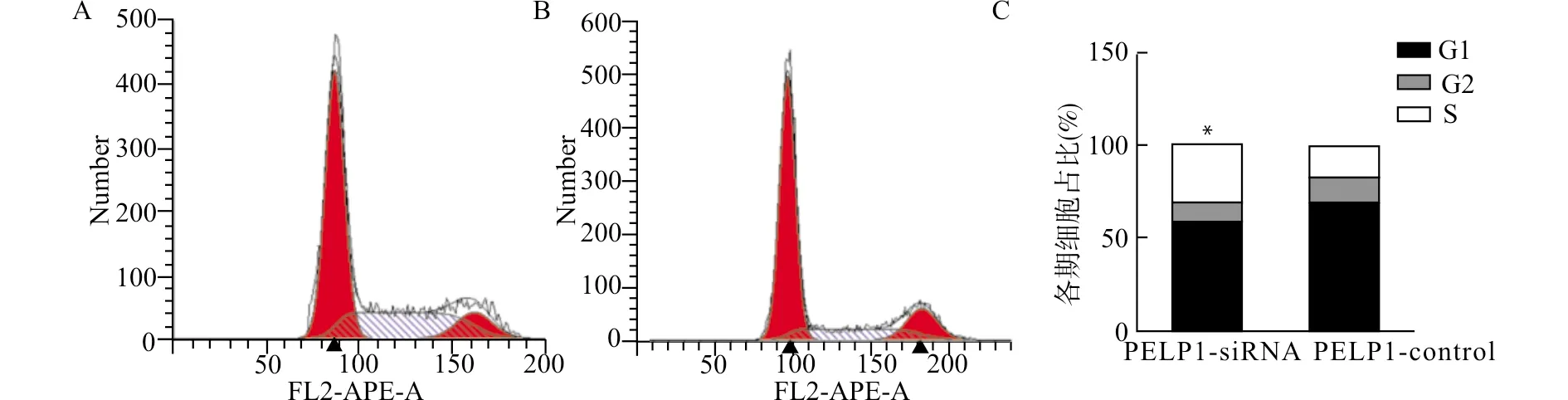
A:PELP1-siRNA组流式代表图;B:PELP1-control组流式代表图;C:细胞周期各时期细胞占比直条图,与对照组(PELP1-control)比较,*P<0.05图8 流式细胞术检测细胞周期Fig.8 Cell cycle analysis by flow cytometry

A:荧光显微镜下代表图;B:平均荧光强度直条图,与对照组(PELP1-control)比较,*P<0.05图9 EdU细胞增殖活性测定Fig.9 Detection of EdU cell proliferation
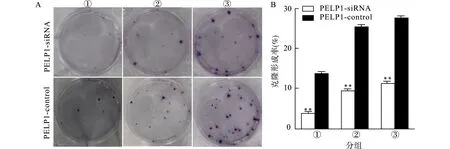
①接种50个细胞;②接种100个细胞;③接种200个细胞;A:不同接种密度的平板克隆形成情况;B:克隆形成率统计,与对照组(PELP1-control)比较,**P<0.01图10 平板克隆形成实验Fig.10 Colony formation assay

A:倒置相差显微镜下划痕典型代表图(×100);B:划痕面积统计;C:伤口愈合百分比统计图11 细胞划痕实验Fig.11 Wound healing assay
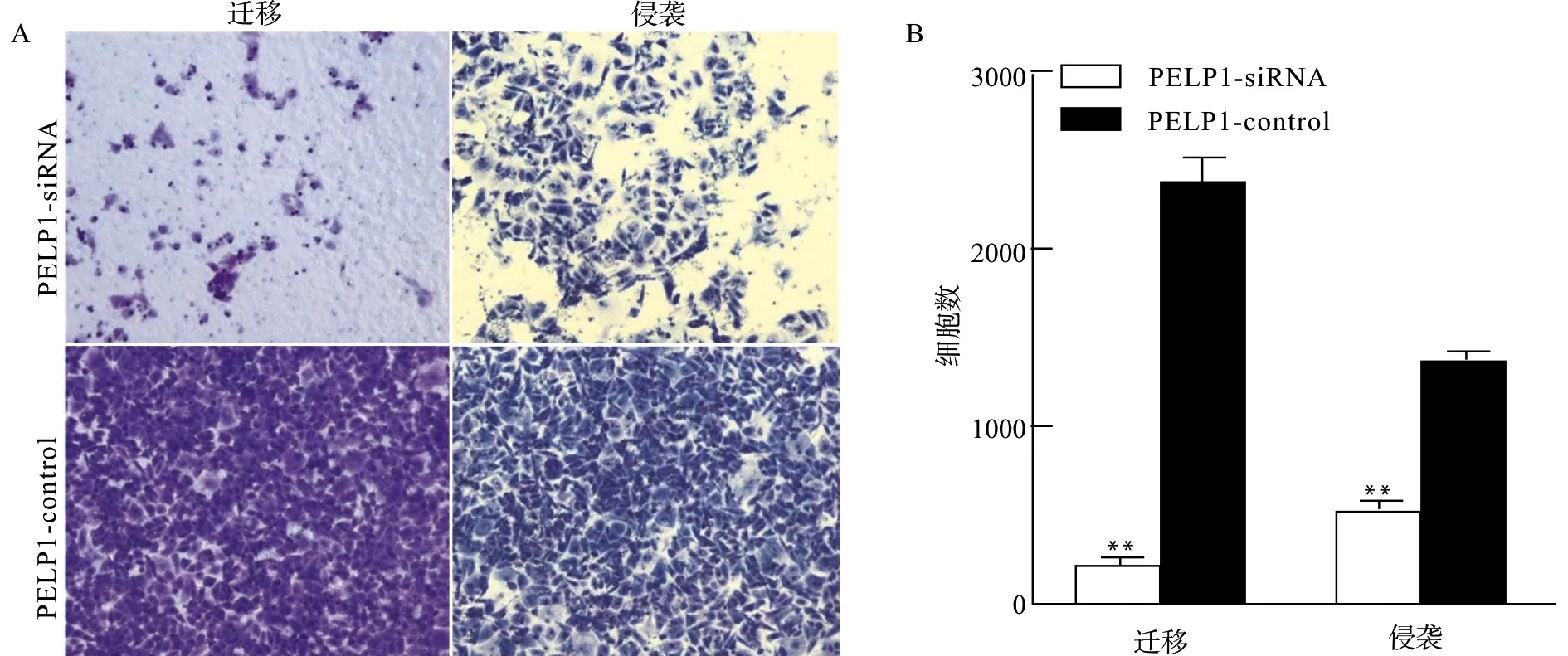
与对照组(PELP1-control)比较,**P<0.01图12 Transwell检测细胞迁移和侵袭Fig.12 Detection of cell migration and invasion by Transwell assay
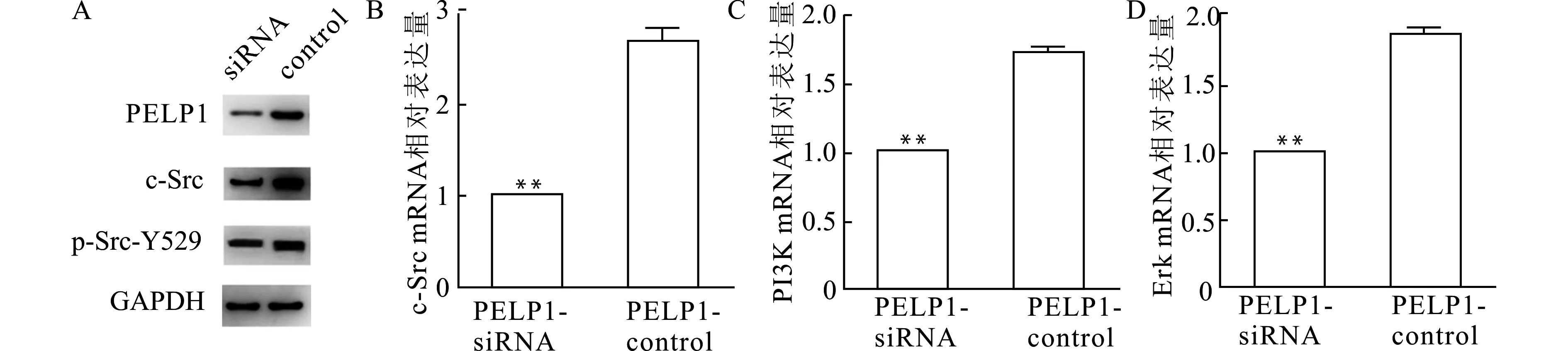
A:Western blot检测PELP1、c-Src、p-Src-Y529的表达;B~D:qRT-PCR检测c-Src(B)、PI3K(C)和Erk(D)的mRNA表达图13 敲降AGS细胞中PELP1表达后其下游通路基因的表达变化Fig.13 Changes of downstream gene expression after knockdown of PELP1 in AGS cells
3 讨论
胃癌是在全球范围内最常见的恶性肿瘤之一[17]。雌激素受体(ERs)是类固醇激素受体,研究证实其可调节胃癌的许多生理和病理过程[18-19],但是ERs在胃癌进展过程中的确切作用以及胃癌患者中雌激素受体失调的临床相关性尚未完全阐明。在本研究中,我们探讨了雌激素共调节因子PELP1在胃癌恶性生物学行为中的作用。我们发现PELP1在胃癌细胞的增殖、侵袭和转移中起促进作用。我们的研究结果为胃癌的发病机制提供了独特的视角[20-22]。
PELP1是一种原癌基因,可作为一种关键的ERα共调节蛋白,促进癌细胞的生长[23-25]。早期研究证实PELP1在激素依赖性癌症中过度表达,Cortez等[26]利用转基因小鼠在其乳腺中过表达PELP1,发现可激发体内致癌潜力及有助于乳腺癌的进展。随后的研究发现PELP1致癌信号传导涉及多种癌症的进展,包括乳腺癌、子宫内膜癌、卵巢癌、唾液腺癌、前列腺癌、肺癌、胰腺癌和结肠癌等[11,15-16,27-32]。新近研究表明,ERs存在于胃肿瘤中,尤其是ERβ[33]。此外,对1162名侵袭性乳腺癌患者的组织活检结果证明PELP1表达是特异性乳腺癌生存不佳的独立预测因子,其表达可用于评估ESR1阳性乳腺癌患者的预后[34]。PELP1表达也被证明对转移性三阴性乳腺癌(TNBC)具有诊断价值,肿瘤中PELP1/ Ki-67双高表达是预测三阴性乳腺癌患者预后不良的独立因素[15,35]。对卵巢肿瘤组织阵列芯片的研究表明,PELP1在60%的卵巢肿瘤中过度表达2~3倍[29]。PELP1还被认为可能在星形细胞肿瘤的进展中起作用,其表达水平可作为预测预后的生物标志物[13]。PELP1也被证实在非癌症疾病如小儿哮喘发病中发挥重要作用[36]。本研究从多个角度证明了PELP1在胃癌中的致癌作用。
肿瘤侵袭和转移的过程复杂,详细的分子机制仍有待阐明[37]。在非基因组途径中,新出现的证据表明ERs与几种途径中的一些其他信号分子相互作用,例如PI3K/Akt或丝裂原活化蛋白激酶(MAPK)信号传导途径。ERα和ERβ在基因组和非基因组途径中发挥不同的作用,其中ERβ在亚饱和激素水平下作为ERα转录活性的反式显性抑制剂/竞争剂起作用[38]。此外,最新研究表明,乳腺癌细胞中的c-Src可作为ERα介导的双相雌激素信号传导途径和STAT5/EGFR途径的转导信号[39]。据报道ERα也可与Src/Shc/EGFR复合物相互作用[40-41]。可见c-Src在乳腺癌中的作用方式与ERα阳性胃癌相似。
本研究表明,在胃癌细胞系中沉默PELP1表达后,其迁移和侵袭性减弱,说明PELP1在胃癌的迁移和侵袭中发挥着关键作用。进一步实验发现沉默PELP1表达后Src-Erk通路相关信号分子表达降低,推测PELP1在胃癌中的作用机制可能与Src-Erk通路有关,其具体的分子机制将是我们下一步的研究方向。
