氢氧根对半水硫酸钙晶体形貌的影响机理
2020-11-21王宇斌毛欣钰王望泊党炜犇
王宇斌,张 鲁,毛欣钰,王望泊,党炜犇
(西安建筑科技大学资源工程学院,陕西西安710055)
半水硫酸钙晶体因具有耐高温、高强度、抗化学腐蚀等优点而被广泛应用于摩擦材料、造纸、建筑模板等领域[1-4],而不同形貌半水硫酸钙晶体的应用领域各有不同。例如纤维状的半水硫酸钙晶须多作为增强材料应用于塑料、造纸等领域[3-5],而短柱状的半水硫酸钙晶体则多应用于力学性能要求较高的精密铸造、永久性建筑模板等领域[1]。为满足不同应用领域对半水硫酸钙晶体形貌的需求,调控半水硫酸钙晶体形貌的研究逐渐引起学者们的重视。王鑫等[6]以磷石膏为原料采用盐酸和氢氧化钠为pH调整剂探讨了pH为4.7~9.3时水热产物的结晶规律,研究认为较大的pH有利于短柱状半水硫酸钙晶体的生成。史培阳等[7]和邓志银等[8]以脱硫石膏为原料通过对溶液化学电位及半水硫酸钙晶体长径比的测定等手段研究了OH-浓度对水热产物微观形貌的影响,研究认为杂质离子对晶体生长的影响较大,而OH-主要通过影响杂质离子的活性以改变水热产物的晶体形貌。B.H.Guan等[9]也以脱硫石膏为原料讨论了溶液pH对半水硫酸钙晶体形貌的影响,结果表明增加料浆的初始pH会降低脱硫石膏的脱水速率,从而导致较大粒径半水硫酸钙晶体的形成。但上述研究均以含有较多杂质离子的工业副产品石膏为原料,鉴于杂质离子对半水硫酸钙晶体结晶有较大影响[2-3,10],上述研究成果是否能够正确反映OH-对半水硫酸钙晶体结晶过程的影响规律仍有待进一步补充研究。基于此,以分析纯的二水硫酸钙为原料,在氢氧化钠体系中研究了OH-浓度对水热产物晶体形貌的影响机理,以期阐明半水硫酸钙在碱性条件下的结晶规律,并为制备不同形貌的半水硫酸钙晶体提供一定的理论依据。
1 实验部分
1.1 原料、试剂与仪器
原料与试剂:二水硫酸钙(分析纯,天津市科密欧化学试剂有限公司)、NaOH(分析纯,洛阳市化学试剂厂)、蒸馏水(采用二次蒸馏)。
仪器:GSHA-1型高压反应釜、DW-2型恒速搅拌器、HH-2型恒温水浴锅、2XZ型旋片式真空泵、DHG-9245A型烘箱、DDS-307型电导率仪、Quanta 200型扫描电镜、K-Alpha型X射线光电子能谱仪、D/MAX-ⅢA型X射线衍射仪。
1.2 实验过程
1.2.1 半水硫酸钙制备
研究通过水热法合成半水硫酸钙,制备流程见图1。

图1 水热法制备半水硫酸钙晶须工艺流程示意图
制备时称量40 g二水硫酸钙与760 mL蒸馏水配制料浆,并分别添加适量的氢氧化钠,再将料浆移至反应釜中升温至120℃,在保温30 min后对料浆进行抽滤,最后将水热产物移至100℃的烘箱中烘干30 min。
1.2.2 Ca2+浓度测定
在95℃条件下将1.2.1节中加入氢氧化钠的料浆搅拌30 min后静置30 min,搅拌转速为300 r/min。使用校准的乙二胺四乙酸(EDTA)溶液滴定料浆上清液的Ca2+,并在滴定5次后取平均值为最终的Ca2+浓度。
1.3 检测方法
SEM观测:将无水乙醇分散后的水热产物涂覆在玻璃基体的表面,喷金处理后采用扫描电镜(加速电压为20 kV,倍率为2 000)观察水热产物的晶体形貌。
XRD检测:取适量水热产物研磨,并利用X射线衍射仪[Cu靶辐射,扫描步长为0.04°,扫描速率为0.08(°)/s,扫描范围为5~80°]对水热产物进行物相检测。
XPS表征:采用X射线光电子能谱仪(Al靶)对水热产物表面元素的结合能进行检测,并利用Avantage软件分析谱图(C 1s为284.6 eV)。
电导率检测:在95℃下检测溶液中二水硫酸钙的电导率,检测前需校准电导率仪,取5次检测数据的平均值作为最终的电导率值。
2 结果与讨论
2.1 OH-浓度对水热产物微观形貌的影响
图2为OH-浓度对水热产物晶体形貌的影响。由图2可知,不同浓度OH-作用下的水热产物的晶体形貌有所不同,其中主要有纤维状、短柱状和颗粒状等形貌,且随着OH-浓度的增大,纤维状形貌的含量逐渐减少而短柱状产物逐渐增多。当OH-浓度为1.0×10-5mol/L时,水热产物中纤维状与板状等形貌共存,且颗粒状形貌较多;当OH-浓度增至1.0×10-4mol/L时,水热产物中板状、短柱状等形貌的含量增大,且纤维状形貌的长径比减小;当OH-浓度进一步增至1.0×10-3mol/L时,短柱状形貌的比例增大,此时仍能观测到少量纤维状产物;而当OH-浓度增至1.0×10-2mol/L时,水热产物的形貌基本为短柱状。由此可见,OH-浓度对水热产物微观形貌的影响较大,且随着OH-浓度的增大水热产物的晶体形貌向短柱状转变。

图2 不同OH-浓度作用下水热产物的SEM照片
2.2 OH-浓度对水热产物物相组成的影响
图3为不同OH-浓度条件下水热产物的XRD谱图。由图3可见,14.68、25.64、29.73、31.88°处均为半水硫酸钙的特征衍射峰,而18.11°处则是氢氧化钙的衍射峰。可见当OH-浓度小于1.0×10-3mol/L时水热产物中只发现了半水硫酸钙的物相,而当OH-浓度为1.0×10-2mol/L时新出现了氢氧化钙的衍射峰。这说明当OH-浓度小于1.0×10-3mol/L时水热产物中只有半水硫酸钙晶体,而当OH-浓度为1.0×10-2mol/L时则为半水硫酸钙与氢氧化钙的混合物。此外,半水硫酸钙的特征衍射峰强度随OH-浓度的增大而降低,说明增大OH-浓度不利于半水硫酸钙晶体的生长。
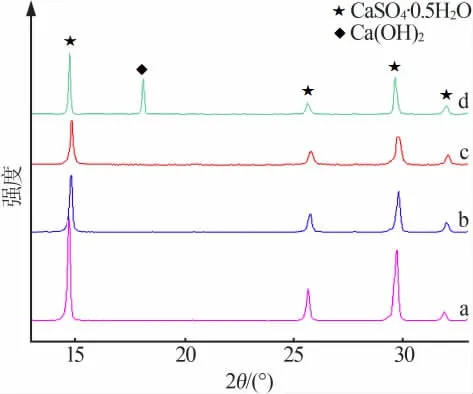
图3 不同OH-浓度条件下水热产物的XRD谱图
2.3 OH-浓度对二水硫酸钙的溶解行为的影响
图4为OH-浓度对溶液中Ca2+组分分布的影响规律。图5和图6为二水硫酸钙溶液的Ca2+浓度随OH-浓度的变化规律及OH-浓度对电导率的影响。
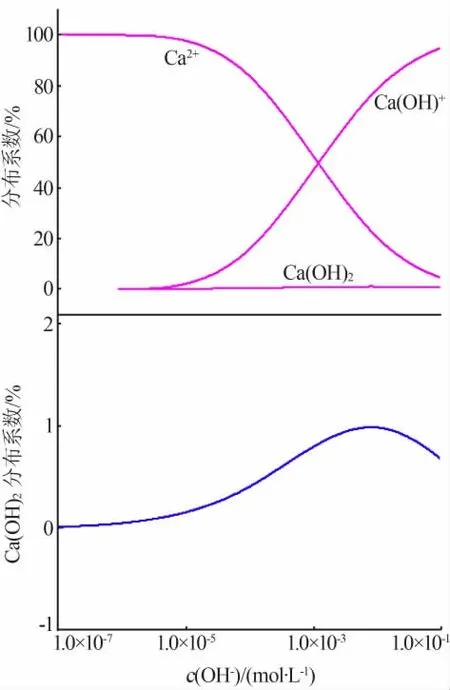
图4 Ca2+组分分布随OH-浓度的变化规律
由图4可知,溶液中的Ca2+主要有Ca2+、Ca(OH)+和Ca(OH)2这3种存在形式。当OH-浓度小于1.0×10-5mol/L时,其基本以Ca2+形式存在;当OH-浓度大于1.0×10-5mol/L时Ca(OH)+的比例随OH-浓度的增大而升高,而Ca2+的分布系数则随之减小。当OH-浓度大于1.0×10-3mol/L时Ca(OH)+的分布系数较大,且部分Ca2+以Ca(OH)2的形式存在。
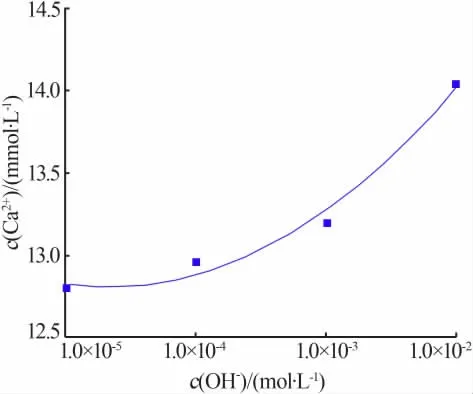
图5 溶液中Ca2+浓度随OH-浓度的变化规律
由图5可以看出,溶液中Ca2+浓度随OH-浓度的增大而增大,当OH-浓度由1.0×10-5mol/L增至1.0×10-2mol/L时Ca2+浓度从12.80 mmol/L增至14.04 mmol/L,相比增大了9.69%。可见OH-对二水硫酸钙有一定的促溶作用,并且OH-浓度越大其促溶作用越强。
由图6可以看出,二水硫酸钙上清液和氢氧化钠溶液的电导率均随OH-浓度的增大呈增大趋势,而由二水硫酸钙溶解电离引入的Ca2+和SO42-产生的电导率增量随OH-浓度的增大呈先增后减趋势,这说明二水硫酸钙溶液中离子的增量随着OH-浓度的增大先增大后减小。结合图4分析可知,溶液电导率增大的原因是强电解质溶液的浓度较小时其电导率与离子的浓度成正比[11],而当OH-浓度为1.0×10-2mol/L时溶液中Ca(OH)+比例的增大和Ca(OH)2等不溶物的出现导致其电导率增量降低。

图6 OH-浓度对溶液电导率的影响
2.4 OH-浓度对水热产物的表面电子结合能的影响
为了解OH-对水热产物表面元素结合能及价态的影响,分别对OH-浓度为1.0×10-4mol/L与1.0×10-2mol/L条件下的水热产物做了XPS分析,并对钙元素的窄谱谱图做了分峰拟合,结果见图7、表1。
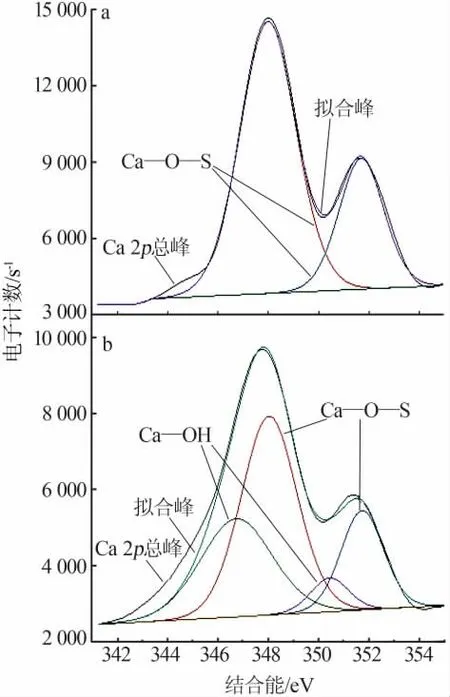
图7 Ca 2p的分峰拟合谱图
由图7、表1可见,当OH-浓度为1.0×10-4mol/L时,Ca(OH)+浓度较高且未出现Ca(OH)2,而OH-浓度为1.0×10-2mol/L时Ca(OH)2含量较大。

表1 Ca的价键形态及其分布
由图7可知,当溶液的OH-浓度为1.0×10-4mol/L时水热产物表面的钙元素仅存在一种电子结合能,而当OH-浓度为1.0×10-2mol/L时水热产物表面新出现了Ca—OH价键,并且Ca 2p1/2和Ca 2p3/2的电子结合能分别从351.68 eV和347.98 eV漂移至351.38 eV和347.68 eV,相比降低了0.30 eV。结合表1还可知,当溶液中的OH-浓度为1.0×10-2mol/L时,水热产物表面Ca—OH价键的质量分数为16.56%。由此可见,当OH-浓度增大时,OH-会在水热产物表面发生吸附并与其表面的Ca2+反应生成Ca(OH)+和Ca(OH)2,从而降低其表面的电子结合能。
结合二水硫酸钙的溶解行为分析和水热产物的XRD分析可知,碱性条件下溶液中的OH-会与Ca2+反应生成Ca(OH)+和Ca(OH)2,减少溶液中的Ca2+数量,从而促进二水硫酸钙的溶解,而溶液中Ca2+数量的减少不利于半水硫酸钙晶体的成核生长。由于溶液中n(SO42-)/n(Ca2+)增大时有利于SO42-在(200)和(110)晶面的吸附[4],而OH-对二水硫酸钙的促溶作用会增大溶液中的SO42-浓度,同时Ca2+浓度随OH-浓度的增大而减小,这会提高溶液的n(SO42-)/n(Ca2+),从而促进半水硫酸钙晶体沿(200)晶面和(110)晶面的生长。此外,由于碱性条件下OH-在(110)晶面的吸附达到饱和[12],因此当OH-浓度增大时其更易吸附于半水硫酸钙晶体的(002)晶面,并与该晶面上的Ca2+反应生成Ca(OH)+。且当OH-浓度增至1.0×10-2mol/L时,OH-会进一步与吸附于(002)晶面的Ca(OH)+反应生成Ca(OH)2,从而降低该晶面钙元素的电子结合能,进而阻碍半水硫酸钙晶体沿该晶面的生长。在以上3种作用下,OH-浓度的增大有利于短柱状半水硫酸钙晶体的生成。
3 结论
1)在氢氧化钠-蒸馏水体系中改变OH-的浓度可调控半水硫酸钙晶体的形貌。OH-浓度较小时有利于纤维状产物的生成,而当OH-浓度为1.0×10-2mol/L时可生成短柱状的半水硫酸钙晶体。2)在碱性条件下,OH-会与(002)晶面的Ca2+反应生成Ca(OH)+和Ca(OH)2,从而抑制晶体沿(002)晶面生长。此外,OH-不仅会消耗溶液中的Ca2+,减少溶液中的Ca2+数量,不利于半水硫酸钙晶体的成核生长,其对二水硫酸钙的促溶作用还会增加溶液中SO42-的浓度,从而促进晶体沿(200)和(110)晶面的生长。在三者的联合作用下,水热产物中短柱状半水硫酸钙晶体的比例随着OH-浓度的增大而逐渐增大。3)研究可进一步完善半水硫酸钙晶体的生长理论体系,并为制备不同形貌的半水硫酸钙晶体提供一定的理论依据。
