miR156a在不同海棠花瓣色泽形成中的作用
2020-11-21姚允聪
张 洁,程 昊,田 佶,张 杰,姚允聪
(农业应用新技术北京市重点实验室/植物生产国家级实验教学示范中心/北京农学院 植物科学技术学院,北京102206)
观赏海棠[1]是苹果属植物中具有较好观赏价值的植物之一。在中国分布广泛,其花、果、叶均具有极高的观赏价值。根据海棠花瓣的颜色,可将其分为红花、粉化和白花3种[2]。具有代表性的分别是‘王族’、‘印第安魔力’和‘当娜’。
花青素对植物颜色产生重要的影响[3]。花青素的组分及其比例是影响花朵颜色的重要原因[4]。在植物体内,花青素通过与各种单糖结合形成糖苷,因此称为花色苷(Anthocyanin)[5]。根据文献报道,影响植物花色苷合成的基因分两类,一类是保守的结构基因,直接编码参与花色苷生物合成的酶[6]。另一类是调节基因,调节结构基因的表达过程和含量以及花色苷的积累[7]。
MicroRNA (miRNA) 是一类内源的调节基因表达的小RNA,长度在19~25个核苷酸(nt)[8]。miRNA在植物中的调节作用有研究表明,在拟南芥中,miR828通过靶向调节花色苷合成的转录因子PAP1,PAP2和MYB113,从而负调控花色苷的积累[9]。高表达miR828通过抑制转录因子MYB75, MYB82, MYB90和MYB113从而减少花色苷的积累[10]。缺磷会导致植物中花色苷的积累,miR399d在缺磷条件下通过其靶基因和下游相关基因对花色苷进行了调节[11]。miR156是众多研究者研究的热点,miR156通过靶向负调节花色苷的SPL转录因子,进而调控花色苷的积累[12]。在苹果果皮的光照着色研究中,MLNC3.2和MLNC4.6对miR156a具有内源性靶点模拟的作用,在光诱导花青素生物合成过程中可以阻止miR156a对SPL2-like和SPL33的裂解[13]。
花色苷是影响花瓣颜色重要的物质之一。本研究拟以不同品种海棠为试材,对其花瓣进行miR156a前体基因克隆进行序列比较,并通过分光光度法测量花瓣的花色苷含量以及qRT-PCR方法测定miR156a的相对表达量,以揭示miR156a对观赏海棠花瓣花色苷形成的调控作用。
1 材料和方法
1.1 试验材料
材料是2019年春天采集的北京市顺义区木林镇蒋各庄村有机观光苹果园中自然生长的‘王族’、‘印第安魔力’和‘当娜’3个品种的海棠花瓣,分4个时期取样,分别命为小蕾、大蕾、初花和盛开。采后先在冰盒里存样,迅速用液氮冻存,存于-80 ℃备用。
1.2 试验方法
1.2.1 提取植物RNA及反转录 miRNA采用艾德莱EASYspin多糖多酚植物RNA快速提取试剂盒,提取海棠花瓣的RNA。采用全式金miRNA First-Strand cDNA Synthesis SuperMix反转miRNA。两步法反转基因克隆使用的cDNA。
1.2.2 pre-miR156a基因克隆 由于苹果和海棠同属于苹果属植物,使用GDR找到金冠的pre-miR156a的基因序列,查到该序列在15号染色体上。在前体序列的上游和下游各取200 bp左右的序列,构成一段400~500 bp的基因序列。通过Primer5软件设计引物。正向引物McmiR156a-F:5’-ATCCTGGTAGATAAGGGCAT-3’;反向引物McmiR156a-R:5’-GTTGGGAGAAAAACACCTGG-3’。以花瓣cDNA为模板,反应体系为:cDNA模板2 μL、McmiR156a-F 1.5 μL、McmiR156a-R 1.5 μL、擎科生物金牌Mix 45 μL。反应条件为:98 ℃预变性3 min,98 ℃变性10 s,58 ℃退火温度10 s,72 ℃延伸时间5 s,30 cycles,72 ℃总延伸2 min,4 ℃保存。
将PCR产物进行琼脂糖凝胶电泳检测,胶回收目对应位置的基因片段条带,胶回收试剂盒使用艾德莱琼脂糖凝胶纯化试剂盒。胶回收产物连接全式金pEASY-Blunt载体,转Trans-T1大肠感受态,涂板,挑菌,菌液PCR,将PCR产物条带正确的菌液送测序。
1.2.3 qRT-PCR qRT-PCR选择大连宝日医生物技术有限公司SYBR© Premix Ex TaqTMII (Tli RNaseH Plus)酶进行试验,试验体系参照说明书。采用qRT-PCR两步法( 95 ℃预变性3 min,94 ℃变性20 s,60 ℃ 退火30 s,72 ℃延伸30 s,39次循环)为反应条件,以U6作为内参基因,miR156a的荧光引物为miR156a成熟体序列,检测miR156a的相对表达量。待测样品的数据均进行3次生物学重复。
1.2.4 分光光度法测花色素苷含量 将花瓣在液氮中研磨成细粉,称取0.1 g样品,用植物花色苷提取试剂盒提取花色苷。用分光光度计分别测量提取液在530 nm处和700 nm处的吸光度值,运用公式计算得到花色苷含量。
1.2.5McmiR156a的靶基因预测 通过靶基因预测网站psRNATarget (http://plantgrn.noble.org/v1_psRNATarget/)对McmiR156a的靶基因进行了预测,通过NCBI比对,找到该基因的详细描述。
2 结果与分析
2.1 3 种海棠花瓣花色比较 通过照片可以看出,随着生长时期的增加,花瓣颜色逐渐变浅(图1),王族花瓣颜色逐渐变浅,在盛开时期,花朵依然红艳。印第安魔力花瓣颜色由红逐渐变粉,而当娜花瓣最初是粉红色,当生长到初花时期几乎为白色,盛开时全白。3种花瓣花色苷含量也呈现出明显的降低趋势(图2),同一时期3个品种的花瓣花色苷含量也出现了显著差异,王族花色苷含量最多,当娜花瓣花色苷含量最少。

图1 3种海棠花瓣表型图
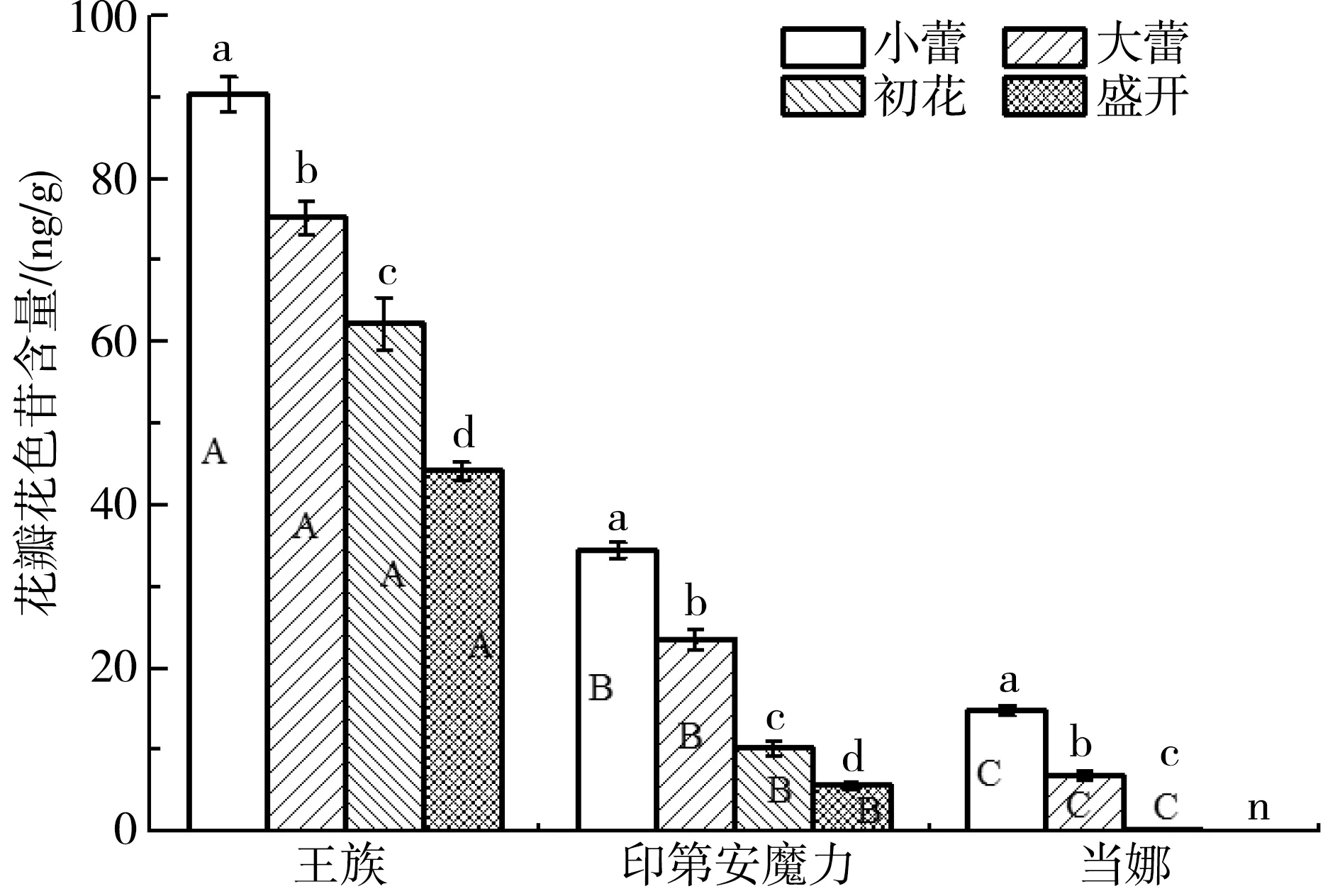
注:每组数据显示为平均值 SE (n=3)。不同的小写字母表示同一品种不同时期数据差异在P <0.05,不同的大写字母表示同一时期不同品种数据差异在P <0.05
2.2 3种海棠花瓣miR156a基因比较
以3种海棠花瓣cDNA为模板,进行miR156a基因克隆,得到长度为489 bp的加保护碱基的前体序列(图3)。miR156具有保守性,通过将3个品种的序列测序后与金冠miR156a前体序列进行比较,发现3个品种海棠花瓣中miR156a前体90 bp序列没有差异(图4)。
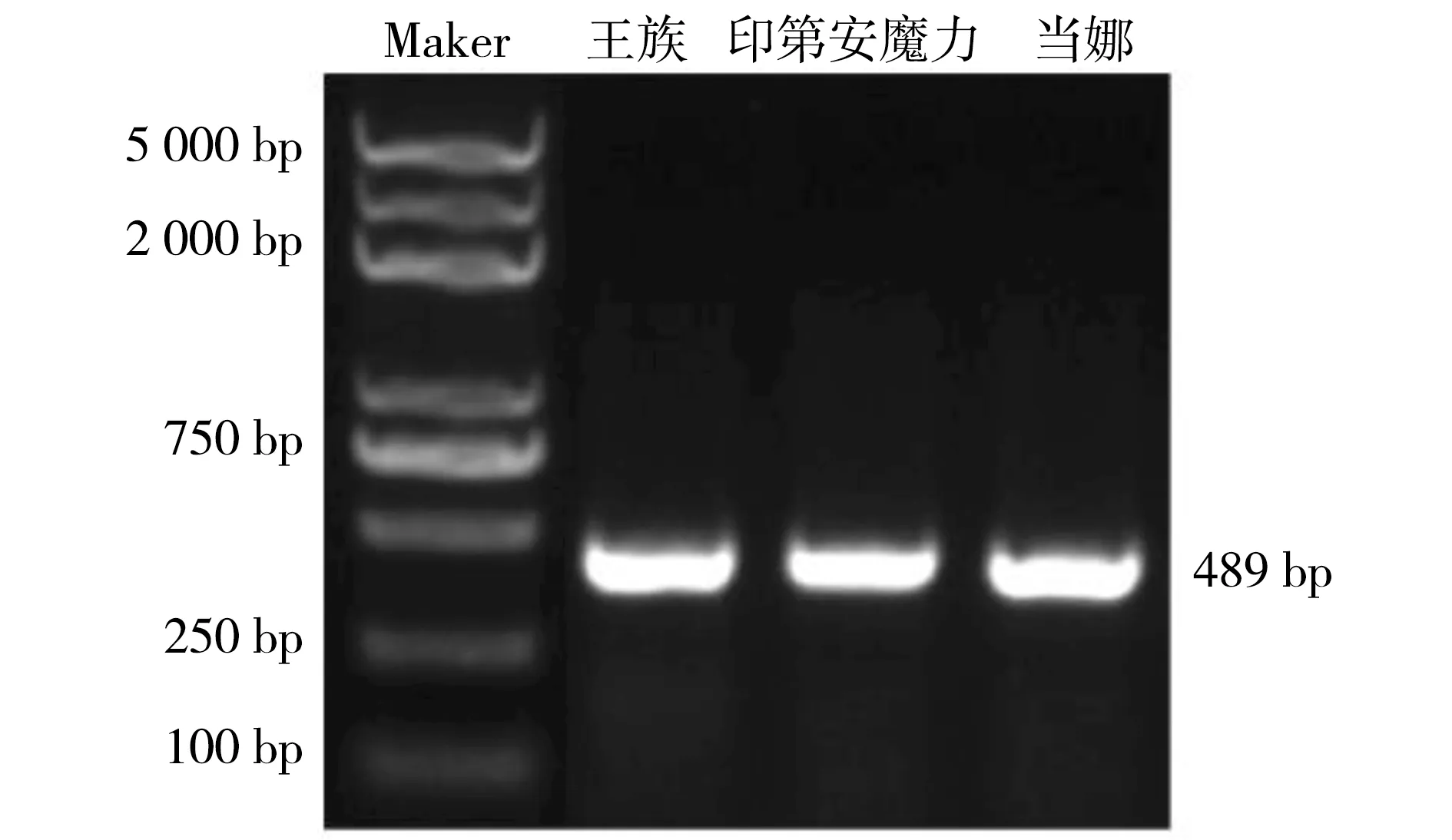
图3 miR156a前体PCR扩增产物

图4 miR156a前体序列比对
2.3 McmiR156a靶基因预测结果
通过靶基因预测网站psRNATarget对miR156a靶基因进行预测,筛选得到以下与其高度互补并且假阳性低的靶基因(表1)。分析发现miR156a靶基因多为SPL家族,通过NCBI网站查询得到靶基因序列,并对其做互补性分析。发现SPL6(Squamosa promoter binding like 6)基因只有一个碱基不匹配,不匹配碱基为U-G,剩余靶基因岁虽也是一个碱基不匹配,但不匹配碱基为U-U,相对的期望值要大。
2.4 3种海棠花瓣中miR156a相对表达量比较
以3种海棠花瓣为模板,提取miRNA,通过荧光定量PCR的方法,计算miR156a的相对表达量。
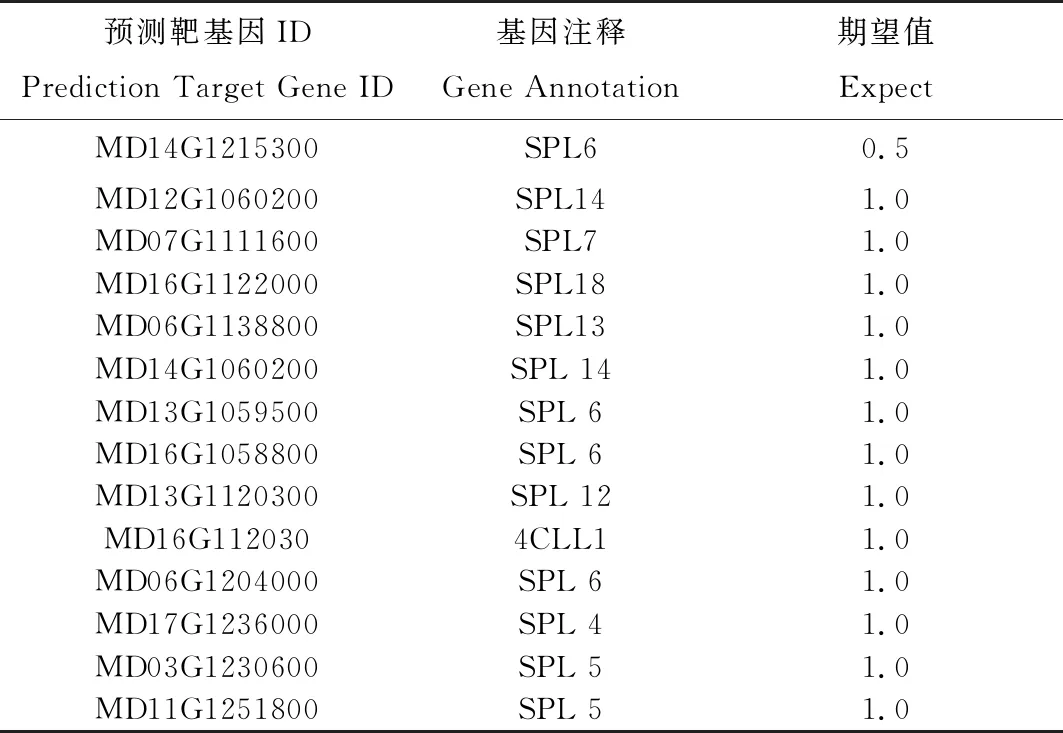
表1 miR156a靶基因预测结果
通过分析可以看出,随着花瓣颜色变浅,miR156a的相对表达量逐渐升高,并且3种不同颜色的花瓣中,王族的miR156a相对表达量较低,其余两种较高,在颜色变化明显的印第安魔力花瓣中4个时期miR156a的相对表达量呈现显著差异(图5)。说明miR156a在花色苷生物合成中起到了负调控的作用。

注:每组数据显示为平均值 SE (n=3)。不同的小写字母表示同一品种不同时期数据差异在P <0.05,不同的大写字母表示同一时期不同品种数据差异在P <0.05
3 讨 论
观赏海棠是中国极具综合观赏价值的植物。其花果叶均具有观赏价值。影响植物颜色的重要物质之一是花色苷,花色苷不仅能够让植物色彩艳丽,便于授粉和传播种子,又能抵御害虫侵袭[14],减少植物受到紫外线伤害。同时对人体有许多有益功效,比如抑制脂质过氧化、保护视力、预防糖尿病、保护肝脏和清除体内自由基等[15]。花色苷极其不稳定并且在不同生长时期,花色苷含量也不相同[16]。在本研究中,随着植物的生长,花瓣中花色苷的含量逐渐降低。因此如何提高花色苷的生物合成量,降低花色苷的降解,需要更深入的研究。
研究者常使用基因调控的方法可以使花色苷生物合成增多。苹果中MdHY5受光照和脱落酸诱导,在苹果愈伤组织中高表达HY5,可以调节MYB10基因和下游花青素生物合成基因的表达,从而促进花青素的积累[17]。miRNAs是一类负调控基因表达的非编码小RNA,有研究表明,葡萄中,miR828和miR858抑制靶基因MYB114从而促进花青素的生物合成[18]。猕猴桃果实测序中发现miR858高度表达可抑制MYBC1基因的表达,而MYBC1可与LDOX基因的启动子结合,从而抑制猕猴桃果实花青素的生物合成[19]。植物发育中miR156-SPL模块广为研究,在柑橘的愈伤组织中,miR156-SPL被增强可以增加愈伤组织对硒的调控能力,从而促进愈伤组织的生物学进程[20]。miR156/miR157通过控制SPL基因的变化来调节拟南芥营养期的转变[21]。拟南芥中miR156e-3p的高表达抑制SPL1的转录水平,从而促进DFR的高表达使得拟南芥中花色苷积累[22]。
通过研究发现,不同颜色海棠花瓣中miR156a的相对表达量不同,颜色深的miR156a表达量低,颜色浅的表达量高。本研究结果对miR156a及靶基因SPL对花色素苷的具体调控作用提供一定的理论基础。
