IL-17A 可以促进卵巢癌的腹腔转移
2020-11-20李岩牛秀珑郁春艳陈燕沈洋洋邓为民
李岩,牛秀珑,郁春艳,陈燕,沈洋洋,邓为民
(1.天津医科大学基础医学院免疫学系,国家教育部免疫微环境与疾病重点实验室,天津300070;2.中国人民武装警察部队特色医学中心勤务环境皮肤疾病防治研究所,天津300162)
卵巢癌(ovarian cancer,OvCa)是女性生殖系统三大恶性肿瘤之一,转移和耐药使OvCa 的5年生存率为30%左右,病死率居于女性生殖系统恶性肿瘤的首位[1]。研究发现,OvCa 患者体内白细胞介素17A(interleukin-17A,IL-17A)水平增高,且与肿瘤进展密切相关[2]。IL-17A 是IL-17 细胞因子家族中(IL-17A~IL-17F)最早被发现也最具有代表性的一员,是一种多效性炎症因子,主要通过IL-17RA发挥作用[3-4]。同时有研究表明IL-17A 是血管生成因子,IL-17A 在肿瘤组织中的高表达与肿瘤的血管生成有密切联系,而血管生成又与肿瘤转移侵袭密切相关[5]。腹腔转移是OvCa 最常见的转移方式[6],但IL-17A 在OvCa 腹腔转移中的作用及其相关机制未见报道,需进一步研究。
1 材料与方法
1.1 材料 小鼠OvCa 细胞系ID8 细胞由堪萨斯大学医疗生殖中心惠赠;C57BL/6 遗传背景的野生型(WT)小鼠购自中国军事医学科学院实验动物中心;C57BL/6 遗传背景的IL-17A-/-小鼠购自日本东京理科大学生物医学科学研究所动物疾病模型中心;DMEM 培养基购自中国南京凯基生物科技发展有限公司;胎牛血清(FBS)购自美国GIBCO 公司;rmIL-17A 购自美国PeproTech 公司;四甲基偶氮唑盐(MTT)和人工基底膜基质凝胶Matrigel 购自美国BD 公司;Transwell 小室购自美国Corning 公司。
1.2 方法
1.2.1 细胞培养 ID8 细胞以含10%FBS 的DMEM,置于5% CO2、37℃培养箱中常规培养。
1.2.2 小鼠体内实验 将ID8 细胞注射于6 周龄雌性WT 小鼠和IL-17A-/-小鼠腹腔内(5×106/200 μL/鼠,n=6 只),6 周后颈椎脱位处死小鼠,打开腹腔,观察瘤结节生成情况,计数并拍照。
1.2.3 MTT 实验 将ID8 细胞接种于96 孔板中(4×103/100 μL/孔)。24 h 后更换培养液,加入1 ng/mL、10 ng/mL rmIL-17A,同时对照组加入等体积的生理盐水,所有组设置5个平行孔;继续培养12 h、24 h、48 h。培养结束前4 h,避光加入MTT(终浓度0.5 mg/mL)。培养结束后离心弃上清,加入DMSO(100 μL/孔),酶标仪检测波长为490 nm 的光密度值(OD490)。
1.2.4 细胞划痕实验 将ID8 细胞接种于12 孔板中(2×105/mL/孔);待细胞贴壁后,划线,清洗去除脱落细胞;加入含2%FBS 的DMEM 培养基(1 mL/孔),加入1 ng/mL、10 ng/mL rmIL-17A,同时对照组加入等体积的生理盐水。分别于0 h、6 h、12 h、24 h 在显微镜下拍照,应用Quantity One 4.5.6 软件分析各组划痕间距。
1.2.5 Transwell 侵袭实验 将ID8 细胞接种于铺有Matrigel 胶的Transwell 上室(5×104/200 μL/孔);在下室加入500 μL 含1%FBS 的DMEM 培养基,同时加入1 ng/mL、10 ng/mL rmIL-17A,同时对照组加入等体积的生理盐水,常规培养24 h。培养结束后,取出上室,进行漂洗,并拭去未穿膜的细胞,以4%多聚甲醛固定,用0.1%结晶紫染液染色,显微镜下拍照并统计穿膜细胞数。
1.3 统计学处理 使用GraphPad prism 5 进行统计学分析并绘图,最终结果以±s 表示。两组间比较采用t 检验,多组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 内源性IL-17A 促进小鼠OvCa 腹腔内广泛生长 在接种ID8 细胞6 周后处死小鼠,结果发现,WT 小鼠腹腔内肠系膜、脾脏、肾脏表面和腹膜后淋巴结处可见密集转移灶;而IL-17A-/-小鼠腹腔内仅横膈部位有较密集转移灶,肠系膜、脾脏和肾脏表面可见极少转移灶(图1A 箭头所示)。WT 组小鼠腹腔内瘤结节数量明显高于IL-17A-/-组小鼠(56.67±5.37 vs. 14.37±3.68,P<0.01,图1B)。

图1 内源性IL-17A 促进小鼠OvCa 腹腔内成瘤Fig 1 Endogenous IL-17A promoted tumor formation of OvCa in abdomen in mice
2.2 rmIL-17A 对ID8 细胞增殖的作用 MTT 实验结果表明,rmIL-17A 不影响ID8 细胞的增殖。如图2 所示,在0~48 h 内ID8 细胞增殖能力均呈增加趋势,但与对照组相比,不同浓度的rmIL-17A 对ID8细胞增殖没有影响(P>0.05)。

图2 rmIL-17A 对ID8 细胞增殖的作用Fig 2 Effects of rmIL-17A on the proliferation of ID8 cells
2.3 rmIL-17A 对ID8 细胞迁移的作用 细胞划痕实验结果表明,rmIL-17A 可促进ID8 细胞迁移。如图3 所示,与对照组相比,10 ng/mL 的rmIL-17A作用6 h 后可促进ID8 细胞迁移(P<0.05),1 ng/mL和10 ng/mL 的rmIL-17A 作用12 h 后可显著促进ID8 细胞迁移(对照组:71.67±2.62;1 ng/mL 组:50.67±2.49;10 ng/mL 组:48.00±3.74;均P<0.01)。
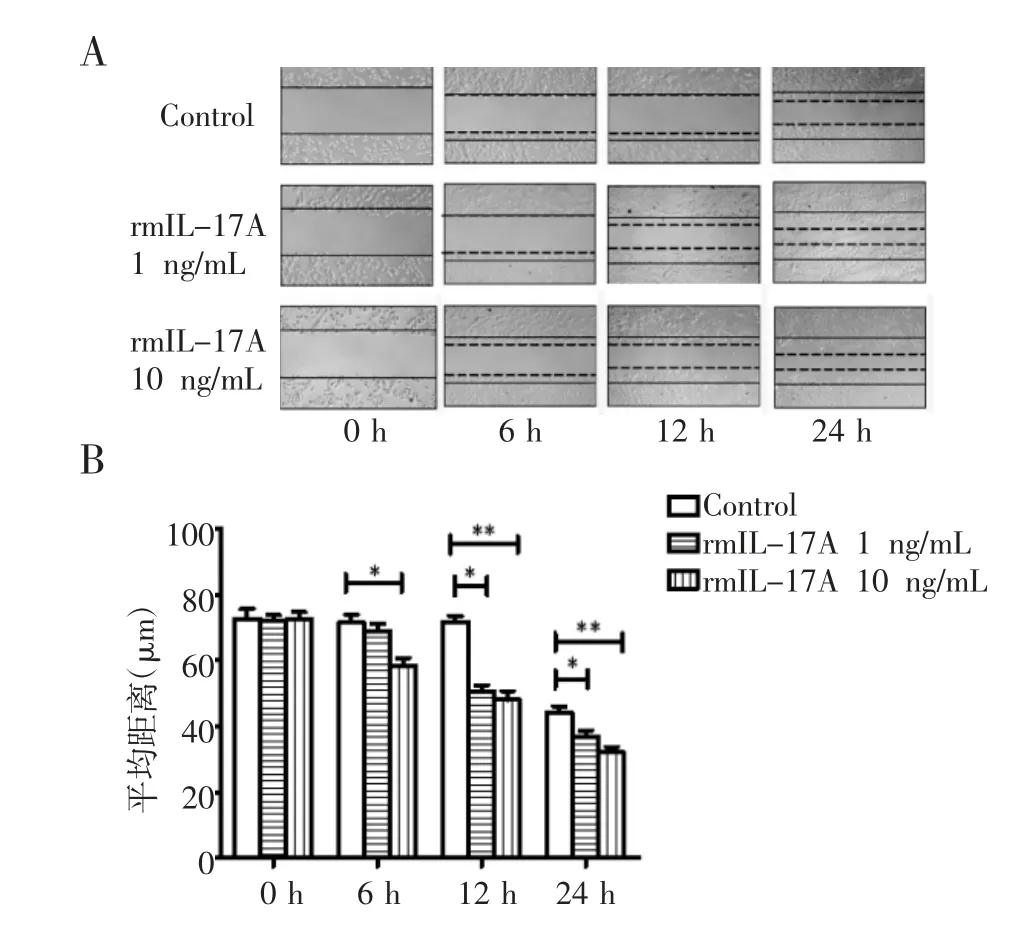
图3 rmIL-17A 对ID8 细胞迁移能力的作用Fig 3 Effects of rmIL-17A on the migration of ID8 cells
2.4 rmIL-17A 对ID8细胞侵袭能力的作用 Transwell侵袭实验结果表明,rmIL-17A 可促进ID8 细胞的侵袭能力(图4A)。

图4 rmIL-17A 对ID8 细胞侵袭能力的作用Fig 4 Effects of rmIL-17A on the invasion of ID8 cells
如图4B 所示,干预24 h 后,1 ng/mL rmIL-17A 组穿膜细胞数为153.00±9.41,10 ng/mL rmIL-17A 组穿膜细胞数为169.00±10.89,而对照组仅为0.33±0.47(均P<0.01)。
3 讨论
转移是晚期OvCa 患者死亡的主要原因之一[7-9]。但目前对OvCa 转移、侵袭的机制还不甚了解,而OvCa 细胞转移、侵袭和腹腔内生长是决定OvCa 腹腔转移的重要步骤[10-12]。本研究通过体内、体外实验研究,证实IL-17A 可以促进OvCa 的腹腔转移。
体外划痕实验表明,rmIL-17A 可以促进ID8 细胞的迁移。此外,体外的侵袭实验表明rmIL-17A 可以促进ID8 细胞的侵袭。有研究表明,IL-17A 可以通过上调基质金属蛋白酶(MMP)-2 和MMP-9 表达,增强人肺腺癌A549 细胞的侵袭能力[13]。但关于IL-17A 对OvCa 侵袭能力的影响还未见报道,需要进一步探索其机制。
本研究以相同基因背景的IL-17A-/-小鼠和WT小鼠为荷瘤动物模型,检测内源性IL-17A 对腹腔内OvCa 生长的影响。发现WT 组小鼠腹腔内瘤结节数量明显高于IL-17A-/-组小鼠,肿瘤转移灶明显多于IL-17A-/-组小鼠,表明内源性IL-17A 可以促进Ov-Ca 细胞在腹腔内的生长和转移。然而,体外MTT 实验结果表明,无论低浓度(1 ng/mL)或高浓度(10 ng/mL)的rmIL-17A 都不影响ID8 细胞的增殖。体内、外实验结果矛盾的原因,可能与IL-17A 具有促进血管生成的作用相关[14-15]。文献报道在OvCa 的组织切片中IL-17A 呈现强阳性,加速了OvCa 的血管生成[16],而血管生成在肿瘤转移中扮演着不可或缺的角色,新生血管可以为肿瘤提供所需的营养和氧气[17]。此外,研究表明,脂肪酸结合蛋白(FABP)4 可以介导脂肪酸进入肿瘤细胞,进行β 氧化,为肿瘤细胞生长和腹腔转移提供能量[18]。本课题组以前的结果发现FABP4 是IL-17A 激活的下游效应蛋白,IL-17A可能通过促进FABP4 表达而促进脂肪酸进入肿瘤细胞发挥作用[2],这可能是IL-17A 促进卵巢癌腹腔转移的另一个机制。
综上所述,本研究通过体内、体外研究,证实IL-17A 可以促进OvCa 的腹腔转移,为OvCa 腹腔转移的临床干预提供了新的思路和策略。
