高脂饮食抑制胰岛素受体和胆囊收缩素受体在小鼠肝脏中的表达
2020-11-20李秋菊胡立娟陈喜娟邱帅王丰
李秋菊,胡立娟,陈喜娟,邱帅,王丰
(1.天津医科大学研究生院,天津300070;2.天津南开医院,天津市急腹症器官损伤与中西医结合修复重点实验室,天津300100)
胰岛素是胰岛β 细胞分泌的肽类激素[1],分泌后经门静脉进入肝脏,与肝细胞表面的胰岛素受体(insulin receptor,IR)结合,促进肝细胞葡萄糖和脂类的利用[2]。持续高脂饮食(high fat diet,HFD)的摄入能导致肝脏发生胰岛素抵抗,继发肝细胞内脂肪堆积,引发非酒精性脂肪肝炎、肝硬化等[3]。食物中的脂肪和蛋白分解物经上段小肠时会刺激黏膜内的I细胞向血中分泌胆囊收缩素(cholecystokinin,CCK)[4]继而引发胆囊收缩和胆汁与胰液的外分泌,有助于蛋白和脂肪的消化与吸收[5]。作为胆汁生成的器官,肝脏的细胞能表达CCK 受体(cholecystokinin receptor,CCKR)。研究表明,该受体的表达异常参与了多个肝脏疾患的发生、发展[6-7]。
CCK 和胰岛素是组成内分泌系统肠-胰轴的重要激素[8],协调食物的消化吸收[9],并与肥胖和肝病的发生密切相关[3,7]。研究表明,肥胖小鼠的胰岛β细胞不仅分泌胰岛素,还产生CCK,并刺激胰岛素分泌,促进β 细胞增殖,保护细胞免于凋亡。胰岛素和CCK 的这种异常分泌是对肥胖的适应性改变[10]。而肝脏作为胰岛素和CCK 的靶器官,其IR 和CCKR如何对HFD 作出应答还未被阐明。此次,笔者在进食HFD 的小鼠中研究了其肝脏中IR 和CCKR 的表达,胰腺中β 细胞群落和胰岛素储量的变化。
1 材料与方法
1.1 动物和材料 46 只雄性Balb/c 小鼠和普通小鼠饲料购自中国北京华阜康生物科技有限公司,该饲料含碳水化合物(56%w/w)、粗蛋白提取物(19%w/w)和粗脂肪提取物(5% w/w),其脂肪含量为5%,并在实验1 周前用于全部小鼠,也作为对照饲料(control diet,CD)在实验中用于对照组小鼠。向研磨成粉的CD 中加入15%和30%的猪油,制得两个HFD,压缩成形并消毒后储存于4℃备用。
β-tubulin 抗体购自Santa Cruz 公司(47778),IR 抗体购自Abcam 公司(ab69508),CCKR 抗体购自Affinity 公司(DF4914),辣根过氧化物酶标记的山羊抗兔抗体和山羊抗鼠抗体购自上海良森生物科技有限公司,鼠源胰岛素单克隆抗体购自上海西格玛奥德里奇贸易有限公司。卵白素-生物素-酶复合物(ABC)染色法试剂盒购自美国Vector 公司,二氨基联苯胺(DAB)法显色试剂盒购自于美国Millipore公司,酶联免疫吸附试验(ELISA)试剂盒购于武汉伊莱瑞特生物科技股份有限公司,二喹啉甲酸(BCA)蛋白定量试剂盒购于美国Thermo 公司,放射免疫(RIA)试剂盒购自上海信帆生物科技有限公司。为准备实验所用的血液容器,向EP 管中加入10 μL EDTA(15%)溶液,并随即烘干备用。
1.2 动物管理 小鼠抵达时4~5 周龄,体重14~16 g。饲养于南开医院动物实验中心SPF 级动物房,12 h/12 h 循环光照,所有实验小鼠自由摄食和饮水。小鼠适应性喂养CD 1 周后,按随机数字表法分为3 组:对照餐组16 只,进食含有15%脂肪的HFD 组(15%HFD 组)15 只,进食含有30%脂肪的HFD 组(30%HFD 组)15 只。每周监测小鼠体重,而每日进食量在众多文献中已有清楚记载[11-12],故不赘述,共饲养12 周。
用外周和门静脉两次取血的方法获得了测定胰岛素和CCK 所需的血浆。为此,在第10 周时使用毛细管行内眦采血(250 μL),3000 r/min 离心15 min,吸取上层血浆,置于-80℃冰箱保存备用。第12 周末,用三溴乙醇和叔戊醇混合物按125 mg/kg 腹腔注射麻醉动物,剖开腹腔,暴露门静脉,用采血针(0.55 mm×19 mm)取门脉血,同前法获取血浆置于-80℃冰箱保存备用。快速取胰腺组织平分两份,一份放入福尔马林中,另一份于-80℃冰箱保存备用。快速取肝脏、腹股沟棕色脂肪组织(inguinal brown adipose tissue,BAT)和附睾白色脂肪组织(epididymal white adipose tissue,WAT)称重,并将肝脏放入-80℃冰箱保存备用。
1.3 指标检测 所用的蛋白印迹法和免疫组化法详见参考文献[13-14]。在免疫组化中,每组含至少5 只小鼠胰腺,每张切片至少随机获取3个视野,通过显微镜(400×)摄取影像,β 细胞内胰岛素呈棕黄色,胞核呈蓝色。用镂空方格法计算胰岛素阳性的β 细胞面积,及其在胰岛总面积中的占比。
胰腺内胰岛素测定:用预冷的PBS(pH7.4)冲洗胰腺组织,将剪碎的组织与对应体积的PBS(含蛋白酶抑制剂)在冰上进行超声破碎,5000 r/min 离心10 min 后取上清。按ELISA 试剂盒说明书的步骤测定胰岛素含量。血浆中胰岛素水平用同一ELISA 试剂盒测定。按RIA 试剂盒说明书的步骤操作,测定血浆CCK 的浓度。
1.4 统计学处理 应用统计分析软件SPSS 17.0 进行统计分析,符合正态分布的计量数据以±sx表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 HFD 对小鼠体重、脂肪组织质量、肝脏质量的影响 与对照餐组相比,15%HFD 组及30%HFD 组小鼠体重均增加(P<0.01)(图1A)。此外,含30%HFD 组小鼠的肝脏质量(图1B)和两处脂肪组织的质量(图1C 和1D)增加(P<0.01)。

图1 HFD对小鼠体重、脂肪组织质量、肝脏质量的影响Fig 1 Effects of HFD on body weight,fat tissue weight and liver weight in mice
2.2 HFD 对小鼠肝脏IR 和CCK1R 的影响 与对照餐组相比,15%HFD 组及30%HFD 组小鼠肝脏IR的表达水平均下降(P<0.01)(图2A)。30%HFD 组肝脏中CCK1R 表达水平也较对照餐组下降(P<0.05)(图2B)。
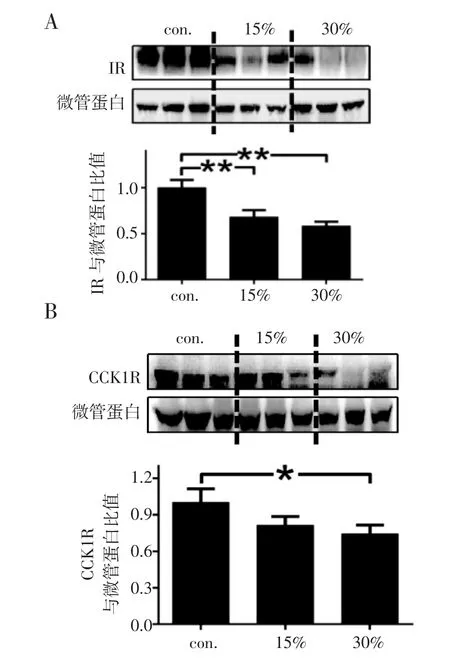
图2 HFD对小鼠肝脏IR和CCK1R表达的影响Fig 2 Effects of HFD on the expression of IR and CCK1R in mouse liver
2.3 HFD 对小鼠胰腺内胰岛素的影响 15%HFD组和30%HFD 组小鼠胰腺内β 细胞面积与对照餐组相比逐渐上升,差异有统计学意义(P<0.01)(图3)。

图3 HFD 对小鼠胰腺内胰岛素的影响Fig 3 Effects of HFD on insulin in pancreas
此外,当用ELISA 直接检测胰腺组织中胰岛素的含量时,也发现了和免疫组化实验相似的趋势,即15%HFD 组和30%HFD 组小鼠胰腺内胰岛素含量与对照餐组相比呈上升趋势,并在30%HFD 组呈现显著差异(P<0.01)(图4A)。

图4 HFD 对小鼠胰腺组织中胰岛素和血浆胰岛素的影响Fig 4 Effects of HFD on insulin contents in pancreatic tissue and in plasma
2.4 HFD对小鼠血浆胰岛素和CCK 的影响 30%HFD 组门脉胰岛素浓度较对照餐组升高,较同组小鼠外周血的胰岛素浓度也升高(P<0.01)(图4B)。
高脂饮食不影响小鼠门脉血和外周血CCK 浓度,两组间比较差异无统计学意义(P>0.05,结果未展示)。
3 讨论
肥胖在起源上是多因素的,但在许多情况下,肥胖是由于进食过多的高脂饮食而引起的,不同的脂肪含量和脂肪类型对胰岛素的敏感性有不同的影响[15]。含有大量饱和脂肪如猪油、牛脂、椰子油的饮食更易诱发肥胖和胰岛素抵抗,而含有不饱和脂肪酸的饮食如鱼油和来自各种种子的油却可能对胰岛素敏感性产生有益的作用[16]。本研究结果也再次证明了摄入过量猪油会诱发肥胖这一事实。高脂饮食时,β 细胞通过多种方式增强胰岛素的分泌能力,包括加快细胞增殖和抑制细胞凋亡[17]。IR 介导肝脏对胰岛素的利用[3]。胰岛素抵抗时,一个重要特征就是肝脏胰岛素清除率随IR 表达水平的降低而降低[18]。本研究结果显示,随脂肪浓度的增加,小鼠胰腺内胰岛素浓度逐渐增加而肝脏内的IR 表达水平降低,表明高胰岛素血症可能是胰腺高分泌和肝脏胰岛素清除率降低共同作用的结果,胰岛素代谢的这种适应性变化可能参与了HFD 导致的肥胖和胰岛素拮抗时的代谢再平衡[3]。
脂质饮食可以提高CCK 基因在CCK 生成细胞(I 细胞)中的表达[19],这与脂质刺激人类CCK 分泌增加的结果一致[20]。CCK 与CCK1R 相互作用介导摄食调节,具有CCK1R 亚型特异性的拮抗剂被证明可增加食物的摄入量[21]。本研究结果显示肝脏中CCK1R表达随着膳食脂肪浓度的增加而逐渐降低,这与IR结果具有一致性,可能提示肝脏CCK1R 和IR 表达水平均与脂肪浓度密切相关,但相关机制仍需进一步研究。胰岛素和CCK 在生理情况下对肝脂肪代谢有协同作用,而病理情况下则相互影响以适应肥胖导致的变化[3,10]。本研究同时检测肝IR 和CCKR,发现二者均随脂肪浓度的增加逐渐降低,这为临床上通过肝IR 和CCK1R 制定新的药物靶点来预防肥胖症和相关肝病提供了数据支持。
综上所述,肥胖症作为全身性疾病,能同步降低肝脏IR 和CCK1R 以及增加胰腺胰岛素储量。但在肥胖条件下,肠-胰轴中胰岛素和CCK 间的相关作用机制仍有待深入研究。本研究的新颖性在于:(1)同时检测肝IR 和CCKR 表达水平。(2)用外周血和门静脉血胰岛素水平反映胰岛素敏感性。从这一模型中得到的结果,如HFD 可同时下调肝IR和CCKR 表达等,也将会对肥胖症和肝病的相关研究产生影响。
