持续外源一氧化氮处理对黄瓜(Cucumis sativus L.)幼苗生长发育及耐冷性的影响
2020-11-20张文博杨志峰吴佩赵明伟刘慧英崔金霞
张文博,杨志峰,吴佩,赵明伟,刘慧英,崔金霞
(石河子大学农学院/新疆生产建设兵团特色果蔬栽培生理与种质资源利用重点实验室,新疆 石河子 832003)
低温胁迫是限制植物分布和产量的重要因素之一。植物在低温胁迫下的生理生化变化主要表现为叶绿素合成受阻[1]、细胞收缩、膜系统受损、膜脂从液晶态变成凝胶态,导致离子发生外渗、细胞导电性发生变化,进而体内各种代谢发生紊乱。活性氧(ROS)参与细胞内生理生化反应,正常情况下,ROS分子能够被氧化防御机制清除,即植物的保护性应激反应[2]。一旦植物受到低温等逆境胁迫时,活性氧的动态平衡被打破,从而对植物造成伤害[3]。NO是一种易穿过生物膜,几乎不含极性的亲脂性分子。植物体内NO的产生主要有硝酸还原酶(NR)、一氧化氮合酶(NOS)途径和非酶促途径[4]。研究[5]已证实NO在植物中是一种关键的信号分子参与植物体内多种生理代谢,包括促进植物生长发育、延缓叶片衰老、刺激防御相关基因的表达,并在逆境中具有抗氧化的作用。Zhao等[6]研究发现,拟南芥内源NO的产生与低温驯化呈正相关关系,并且NO合成的迅速增加伴随着冷应答基因的表达。也有研究[7]表明ROS中的H2O2可以作为信号分子参与植物的防御反应,并可以与NO信号分子互作来提高植物的抗逆性。
植物在生长发育过程中遭受低温、干旱等逆境胁迫后,能够通过一系列信号转导激发转录因子与顺式作用元件结合,精确调控下游基因的转录表达,并通过基因产物的作用对外界信号在生理生化等方面做出合适的调节反应,提高自身的耐性以维持生存[8]。WRKY转录因子家族能响应低温胁迫,Ling等[9]研究表明黄瓜中共发现有57个WRKY家族基因,有一些WKRY转录因子参与到低温胁迫中。
近年来,将NO作为信号分子来研究植物抗逆的报道较多[10],但对于构建不同水平的NO对植物生长发育及抗逆的研究鲜有报道。因此,本试验以黄瓜幼苗为试验材料,通过外源喷施NO供体硝普钠(SNP)及其清除剂PTIO来构建不同NO水平的黄瓜幼苗植株,进而研究NO对黄瓜幼苗的生长发育及低温胁迫后NO在提高黄瓜幼苗低温耐受性的机制,为黄瓜栽培中外源NO供体的合理应用提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验材料为‘津研4号’(购自山东祥云种业有限公司)黄瓜品种,试验所用NO供体SNP购自Sigma公司,试验所用PTIO购自东京化成工业株式会社,草炭购自德国Floragard公司。
试验材料于2019年3—6月在石河子大学农学院试验站及特色果蔬栽培生理与种质资源利用实验室中进行。挑选籽粒饱满、大小一致的黄瓜种子于55 ℃浸种30 min,自然冷却至室温浸泡6 h后于28 ℃恒温箱内黑暗催芽24 h。选取发芽一致的种子播于72孔穴盘。待两片子叶完全展开后移入装有基质(V草炭∶V蛭石∶V珍珠岩=2∶1∶1)的花盆(直径120 mm,高110 mm),每盆1株,缓苗5 d后每隔4 d浇1次Hoagland营养液(0.5倍),每次100 mL。待幼苗第1片真叶完全展开后,进行以下处理:①喷施蒸馏水,每隔1 d喷一次;②喷施200 μmol·L-1SNP,每隔3 d喷1次;③喷施200 μmol·L-1PTIO,每隔1 d喷1次;④喷施200 μmol·L-1PTIO及200 μmol·L-1SNP,PTIO每隔1 d处理1次,SNP每隔4 d处理1次。每处理重复3次,各15株。
待植株长至二叶一心后,选取整齐一致的幼苗60株移到人工气候箱(Percival,美国),10:00对以上植株进行低温处理:昼(14 h)(10±1) ℃、夜(10 h)(6±1) ℃,植物叶片表面受光照强度为100 μmol·m-2·s-1,相对湿度昼75%/夜50%,分别在低温胁迫0、24和48 h后对植株第2片叶进行相关指标的测定。试验采用单因素完全随机试验设计。
1.2 测定项目及方法
1.2.1 植物地上部分干鲜重与叶面积的测量
黄瓜植株地上部分以子叶下1 cm处为准,称取植物的鲜重后,将植株放于信封袋内,置于DCG-9(146 A)电热恒温鼓风干燥箱内,105 ℃杀青30 min后,70 ℃烘至恒重,此时植株的重量记为干重。LI-3100C台式叶面积仪用于测定植物的叶面积。
1.2.2 叶绿素含量的测量
叶绿素a、叶绿素b及总叶绿素均用丙酮乙醇混合液法进行提取[11],日本日立U-3900H紫外分光光度计用于测量各色素的含量。
1.2.3 丙二醛含量的测量
参照Hodges等[12]的方法测定黄瓜叶片丙二醛(MDA)含量。
1.2.4 过氧化氢含量的测量及过氧化氢染色
过氧化氢(H2O2)含量的测定采用南京建成生物工程研究所的过氧化氢试剂盒(A064),具体操作使用方法见说明书,H2O2组织化学染色参考Thordal-Christensen等[13]的方法,双蒸水冲洗各处理黄瓜幼苗叶片,打孔器(直径1 cm)打孔,叶圆片放入24孔培养板中,每孔加入1.6 mLDAB反应液(50 mmolTris-HCL,pH3.8)用于H2O2染色。300 μmol·m-2·s-1光强下28 ℃光照6 h后将叶圆片放入存有95%无水乙醇中煮沸数分钟,肉眼观察叶片颜色由绿变白后拍照,棕褐色表示H2O2积累程度。
1.2.5 NO含量及NOS活性测定
NO含量及NOS活性测定采用南京建成生物工程研究所的试剂盒(A012-1-2、A0142-2),具体操作使用方法见说明书。
1.2.6 RNA提取及基因转录水平
Trizol法提取黄瓜叶片总RNA,Nanodrop 2000(Thermo Fisher Scientific公司,美国)检测核酸含量琼脂糖凝胶电泳验证RNA完整性。Bio-Rad(美国)荧光定量PCR仪用于qRT-PCR反应。反应条件:95 ℃预变性30 s,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1 min,40个循环。以黄瓜的Actin(XM-011659465.1)基因作为内参校正并定量分析叶绿素相关基因、抗冷相关基因的表达水平。实时定量(qRT-PCR)分析:基因表达的相对定量采用2-ΔΔCt法进行计算[14]。基因的qRT-PCR扩增引物序列如表所示:

表1 qRT-PCR引物序列
1.3 数据统计方法
采用Excel 2010和SPSS 19.0对数据进行统计分析,Duncan’s新复极差法用于差异显著性检验(P<0.05),Origin 9.0软件绘图。图表中结果为平均值±标准误。
2 结果与分析
2.1 外源NO处理对黄瓜幼苗生长指标的影响
如表2所示,与CK相比,SNP处理的黄瓜幼苗的叶面积、鲜重及干重分别显著升高38.55%、45.68%和28.33%;PTIO处理的黄瓜幼苗叶面积、鲜重及干重分别显著降低了11.70%、6.8%和20.00%;PTIO+SNP处理的黄瓜幼苗叶面积、鲜重分别显著增加了20.18%、23.53%。此外,与SNP相比,PTIO+SNP处理的黄瓜幼苗的叶面积、鲜重及干重分别显著降低了13.26%、15.21%和23.38%,说明PTIO抑制了SNP的作用效果。
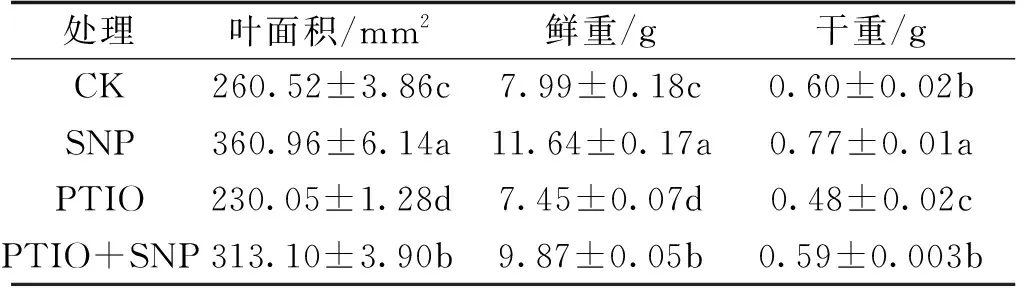
表2 不同处理对黄瓜幼苗叶面积、干鲜重的影响
2.2 外源NO处理对叶绿素含量及其合成基因表达
由表3可知,在低温处理0 h后,与CK相比,SNP处理的叶绿素a、b和总叶绿素的含量分别显著提高17.85%、21.57%和18.23%;低温胁迫24 h后,与CK相比,SNP处理的叶绿素a、b和总叶绿素的含量分别显著提高31.61%、28.81%和33.19%。而PTIO处理与对照相比在0 h时,叶绿素a、b和总叶绿素含量分别显著降低16.43%、15.68%和16.67%;在低温胁迫24 h后,PTIO处理与CK相比,叶绿素a、b和总叶绿素含量分别显著降低19.54%、23.73%和19.21%。PTIO+SNP处理的叶绿素a、b和总叶绿素含量与CK相比无显著差异。
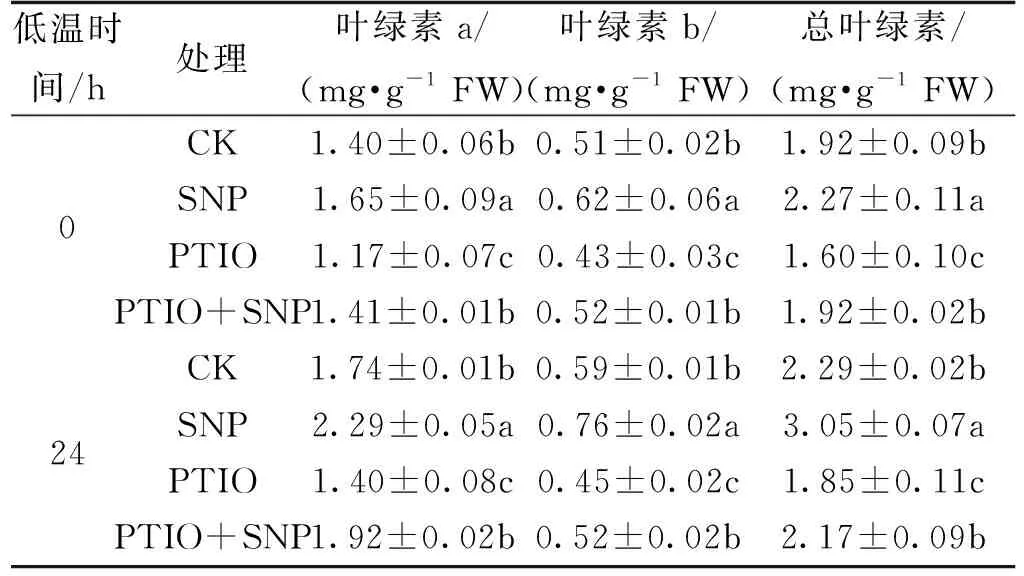
表3 低温胁迫下NO对黄瓜幼苗叶绿素含量的影响
如图1所示,低温0 h时,与CK相比,SNP和PTIO+SNP处理显著上调MgCH和FeCH基因的表达水平,PTIO处理与CK相比无显著差异。低温24 h后,与CK相比,SNP处理的MgCH和FeCH基因的转录水平依然显著上调,PTIO处理显著则抑制FeCH和MgCH基因的表达水平,PTIO+SNP处理的FeCH基因表达与CK相比无差异,但MgCH的表达水平显著高于CK。
2.3 外源NO对黄瓜幼苗MDA含量的影响
如图2,低温0 h时,与CK相比,SNP处理的MDA含量显著降低了12.66%,其他处理与CK相比无显著差异。低温24 h后,SNP和PTIO+SNP处理的MDA含量与CK相比无显著差异,但与CK相比,PTIO处理黄瓜幼苗的MDA含量显著增加了25.59%。

图2 不同NO处理对黄瓜幼苗丙二醛(MDA)含量的影响
2.4 外源NO对黄瓜幼苗H2O2的影响
低温胁迫后黄瓜幼苗H2O2含量的变化如图3。在低温0 h时,各处理H2O2含量与CK相比无显著差异。低温24 h后,与低温前相比,各处理的H2O2含量迅速升高,与CK相比,SNP、PTIO处理的H2O2含量显著增加57.02%、26.47%,PTIO+SNP处理与CK相比无显著差异。如图3B,染色深浅与H2O2含量正相关。H2O2染色图像与H2O2含量的变化趋势相一致。

A—H2O2含量,B—H2O2染色。
2.5 低温胁迫下外源NO对黄瓜幼苗内源NO及NOS活性的影响
如图4所示,低温胁迫24 h后,与CK相比,SNP和PTIO+SNP处理的NO含量和NOS活性均显著增加,PTIO处理NO含量与CK相比无显著差异(图4A),而与CK相比,PTIO处理的NOS活性显著降低(图4B)。

图4 低温胁迫下NO对黄瓜幼苗NO含量和NOS活性的影响
2.6 外源NO对黄瓜幼苗抗冷相关基因的影响
如图5所示,低温胁迫后,与CK相比,SNP显著提高CsWRKR40和CsWRKR57基因的相对表达水平(除低温48 h后的CsWRKR40)(图5 A、5C),显著降低了CsWRKR53的表达水平(图5B),而PTIO处理则表现出与SNP完全相反的作用效果,且PTIO的抑制效果可以被SNP部分恢复。

图5 不同NO处理对黄瓜幼苗抗冷基因表达的影响
3 讨论
据研究[15-16],适宜浓度的NO会促进番茄等植物幼苗的生长。Tian等[17]研究表明浓度适宜的NO处理使豌豆叶片膨大。本试验发现,SNP处理后黄瓜幼苗的叶面积及干鲜重显著增加,而PTIO处理则表现出了与SNP相反的作用效果,这与张双双等[18]研究的与野生型拟南芥相比,拟南芥NO合成缺陷突变体具有叶色泛黄、叶片较小、植株矮小等结果一致。这说明本试验利用化学遗传法成功构建了不同NO水平的黄瓜幼苗植株。Kolbert等[19]研究表明,对NO的nia1、nia2和noa1-2突变体外源施加NO能增加突变体内源NO水平,从而提高突变体的抗逆性。本试验证明,低温胁迫下,外源施加SNP可以显著提高NO含量和NOS活性,而PTIO对植物内源NO和NOS的负影响可以部分被SNP处理恢复并提升。
当植物遭受低温胁迫时,光合机构首先受到损伤,叶绿体色素是植物进行光合作用的重要基础,叶绿素含量在一定程度上反映了植株进行光合作用的能力。低温会造成的植物叶绿素的损失[20]。Zhang等[21]研究表明低温胁迫后,SNP处理会显著提高叶绿素的含量和相关基因表达。本试验表明,NO显著提高叶绿素含量及其合成基因FeCH和MgCH的相对表达水平,而PTIO处理则表现出与SNP相反的作用效果。这表明在低温胁迫下NO通过提高植物叶绿素合成相关基因的表达水平来提高叶绿素含量,进而缓解低温对黄瓜幼苗的伤害。
MDA是衡量黄瓜低温耐受性的一个重要指标[22]。吴旭红等[23]研究表明,外源NO能降低低温胁迫下植株MDA含量。徐洪雷等[24]研究表明适宜浓度的SNP能够降低低温胁迫下黄瓜幼苗叶片质膜透性,抑制过氧化作用产物MDA的积累,提高黄瓜幼苗对低温胁迫的适应性。本试验结果显示,低温24 h后SNP处理的MDA含量相比CK而言显著降低,而PTIO处理则显著提高了MDA含量。这与徐洪雷等[24]的研究结果一致。
植物受到低温胁迫后,ROS代谢失衡,会造成ROS如O2-、H2O2、羟自由基(OH·)及单线态氧等的大量积累[25]。ROS可以伤害蛋白质、核酸和脂类等生物大分子引起细胞氧化损伤,但也可做为信号分子对植物生理进行调节,提高其抗逆性[26]。在非生物胁迫下,H2O2和NO的产生是瞬时连续发生或者平行发生[27]。Liao等[28]人报道cPTIO(NO清除剂)可以抑制内源性H2O2的生成,说明植物体内产生H2O2需要NO的参与。NO和H2O2两个分子之间存在相互作用,可以调节其他分子、细胞和整个植物对各种胁迫的反应[27]。Shams等[29]研究发现,NO处理可以提高辣椒体内过氧化氢的含量。本试验研究发现,正常条件下,NO对黄瓜幼苗过氧化氢含量无显著影响,在低温胁迫24 h后,NO诱导H2O2含量显著上升。这表明NO在低温胁迫后诱导了黄瓜叶片内源H2O2的产生共同参与到低温胁迫应激反应中。
Ling等[9]研究表明,WRKY转录因子能响应低温胁迫,至今在黄瓜基因组中共有57个基因被鉴定为WRKY家族的可能成员,目前已经鉴定它们编码55个WRKY蛋白(CsWRKY10和CsWRKY16未被鉴定)。在低温条件下,这些转录因子的表达水平不尽相同,CsWRKR40和CsWRKR57在低温下表达量上调,而CsWKRY53在低温下表达量下调。本试验发现,低温胁迫后,SNP显著提高CsWRKR40和CsWRKR57的相对表达水平(除低温48 h后的CsWRKR40),抑制CsWRKY53的相对表达水平,PTIO+SNP处理3个转录因子的表达水平处于SNP和PTIO处理之间,表明WKRY转录因子参与了NO增强黄瓜幼苗的耐冷性。
4 结论
正常生长条件下,持续SNP处理会诱导黄瓜幼苗叶面积、干鲜重、叶绿素含量显著增加。低温胁迫下,持续SNP处理,能通过提高NOS的活性、内源NO含量、H2O2含量、叶绿素含量和上调叶绿素合成基因,降低丙二醛含量以及增强与抗冷相关正调控转录因子(CsWRKY40和CsWRKY57)的表达水平,抑制负调控的转录因子(CsWRKY53)的表达水平来提高黄瓜幼苗对低温胁迫的耐受性。
