铁皮石斛糖蛋白对皮肤炎症期的调控作用及机制
2020-11-19戴天浥洪文龙周丽免苏海冉白忠彬
赵 倩,戴天浥,洪文龙,周丽免,苏海冉,田 洋,4,*,白忠彬,*
(1.云南农业大学食品科学技术学院,云南昆明 650201; 2.云南农业大学国家辣木加工技术研发专业中心,云南昆明 650201; 3.云南斛哥药业有限公司,云南普洱 665000; 4.食药资源开发与利用教育部工程中心,云南昆明 650201)
铁皮石斛(DendrobiumofficinaleKinura et Migo,DOKM)为石斛属兰科多年生草本植物,全球约1400多种,主要分布于亚洲的热带地区[1]。我国石斛属植物共76种,铁皮石斛是中国药典收录的5种石斛之一,具有益胃生津、滋阴清热、润肺止咳等功效[2]。在2018年铁皮石斛被国家卫健委收录为新资源食品。已经有研究报道,石斛与机体多个部位的炎症反应密切相关,如对于糖尿病引发的心肌病,铁皮石斛提取物可通过抑制氧化应激、炎症反应,降低炎症因子白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)的分泌来减轻心肌病症状[3]。对于胃肠道疾病,铁皮石斛多糖对治疗急性结肠炎小鼠具有明显作用,其机理为通过β-arrestin1信号通路抑制NLRP3炎性体[4]。在脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞炎症模型中,石斛通过抑制一氧化氮合酶(nitric oxide synthase,iNOS),环氧化酶-2(cyclooxygenase-2,COX-2)的表达以及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径中的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的磷酸化达到抑制炎症的作用[5]。
皮肤伤口愈合一般经历炎症、新生肉芽组织填充和瘢痕形成三个阶段[6],其组织学变化为伤口部位发生凝血,细胞因子分泌及后续的炎症细胞聚集,细胞外基质填充损伤部位,愈合后瘢痕组织的降解和吸收[7]。正常愈合过程中,在伤口受损的初期,大量的单核细胞聚集于受损部位,逐渐转化为活化的巨噬细胞,对坏死组织和细胞碎片进行吞噬,并分泌大量的炎症因子,同时释放抗菌物质,促进创面的炎症反应[8]。到创面炎症的后阶段,创面的炎症被抑制,巨噬细胞主要分泌生长转化因子(transforming growth factor,TGF-β)和血管内皮生长因子(Vascular Endothelial Grown Factor,VEGF)等蛋白因子,使成纤维细胞、内皮细胞等修复细胞迁移至创面,肉芽组织开始覆盖病损组织,新生血管大量生成,逐步进入创面修复时期[9-10]。
铁皮石斛作为新资源食品,其在药食同源领域具有诸多功效,但其促进伤口愈合及其机理未见报道。本实验采用小鼠皮肤损伤模型,检测了铁皮石斛糖蛋白对小鼠皮肤损伤愈合的促进作用,同时选用巨噬细胞株RAW264.7作为体外研究对象,应用MTT、ELISA、RT-PCR、WB等方法检测铁皮石斛糖蛋白对RAW264.7细胞分泌炎症因子TNF-α、IL-1β、IL-6以及NF-κB信号通路的影响,研究了铁皮石斛糖蛋白在伤口愈合过程中的炎症调控作用。
1 材料与方法
1.1 材料与仪器
C57雄性小鼠7-8周龄,体重(20±2) g 购自常州卡文斯实验动物有限公司,饲养于云南农业大学工程中心动物饲养室(N000013);RAW264.7小鼠单核巨噬细胞 由云南农业大学云南辣木所提供;三年生林下仿生铁皮石斛 来自云南省普洱市斛哥庄园,于12月份采集;高糖DMEM培养基 美国BI公司;胎牛血清(fetal bovine serum,FBS) 美国Hyclone公司;二甲基亚砜(Dimethyl sulfoxide,DMSO)、0.25%胰蛋白酶-EDTA消化液、RIPA细胞裂解液、磷酸酶抑制剂、青链霉素 北京索莱宝科技有限公司;逆转录试剂盒、SYBR染料 南京喏唯赞生物科技有限公司;抗体AMPK、P-AMPK、NF-κB、P-NF-κB、VEGF、IL-6、TNF-α、ECL发光液 辽宁万类生物科技有限公司;BCA试剂盒 碧云天公司。
Epoch2全波长酶标仪 美国BioTek公司;LightCycler480 II荧光定量PCR仪 德国Roche公司;JY-scz2电泳仪 美国Bio-Rad公司;K3000mini化学发光成像系统 北京科创锐新生物科技有限公司。
1.2 实验方法
1.2.1 铁皮石斛糖蛋白的制备 参照白忠彬[11]方法,在此基础上适当修改。试验采用热水浸提法,采取工艺为提取料液比1∶10,浸提温度70 ℃,提取时间为90 min,提取次数3次,(纱布过滤)合并滤液;4000 r/min,离心15 min,合并上清液;浓缩(减压浓缩),浓缩到一定体积后,加5倍体积95%乙醇,静置24 h,离心取沉淀,沉淀用适量无水乙醇洗涤2次,冷冻干燥得到石斛糖蛋白粉,于常温储存。
1.2.2 RAW264.7细胞培养 取出低温保存的1 mL细胞株,快速融化,放于15 mL无菌离心管中,加入5 mL培养液混匀后,以1500 r/min离心3 min,去上清将细胞沉淀转移至100 mm培养皿中,于37 ℃、5% CO2条件下培养。待细胞生长至80%,用磷酸缓冲液(phosphate buffered saline,PBS)冲洗2次,0.25%胰蛋白酶-EDTA消化液在37 ℃培养箱中消化3~4 min,用无血清培养基吹打底部细胞,使细胞脱落。取细胞悬液以1500 r/min离心3 min,弃上清,加入新鲜培养液使底部细胞沉淀悬浮于培养液中。取细胞混悬液按1∶3传代放于3个培养皿中,并分别补充培养液,于 37 ℃、5% CO2及饱和湿度条件下继续培养。
1.2.3 MTT法检测细胞毒性实验 以200 μL/孔(104个细胞)接种细胞到96孔板上,于37 ℃、5% CO2环境下培养24 h,用PBS清洗未贴壁细胞,添加25、50、100、200 μg/mL铁皮石斛糖蛋白,对照组更换新鲜培养基。每孔200 μL,继续培养24 h。培养完成后,每孔用100 μL新鲜培养基配制的0.25 mg/mL的MTT溶液37 ℃避光孵育4 h显色。吸去培养基,PBS洗2次,每孔添加150 μL DMSO,轻微振荡使紫色结晶物溶解。酶标仪于490 nm测定吸光值。细胞存活率计算公式如下:

表1 RT-PCR扩增条件Table 1 RT-PCR amplification conditions

表2 RT-PCR引物序列Table 2 RT-PCR primer sequence
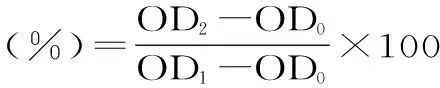
式中:OD0为调零孔;OD1为空白孔;OD2为实验孔。
1.2.4 RT-PCR法检测RAW264.7细胞中细胞因子mRNA表达水平 将处于对数生长期RAW264.7细胞按每皿1.2×106个细胞接板于60 mm培养皿内,培养24 h后进行添加铁皮石斛糖蛋白。对照组更换新鲜培养基,石斛糖蛋白组添加铁皮石斛糖蛋白终浓度分别为25、50、100 μg/mL。添加石斛糖蛋白干预12、24、48、72 h后,按照试剂盒说明书提取总RNA,将RNA按照试剂盒说明书逆转录为cDNA,按表1的扩增条件加样上机。RT-PCR引物序列见表2。
1.2.5 ELISA法检测细胞上清中炎症因子的分泌 将处于对数生长期的细胞按照5×104个/mL每孔200 μL接种于96孔板中37 ℃,5% CO2培养24 h。在检测IL-1β时,先用1 μg/mL的LPS诱导1 h然后添加铁皮石斛糖蛋白。对照组更换新鲜培养基,石斛糖蛋白组终浓度为25、50、100 μg/mL。培养24 h后,收集上清液于200 μL的离心管里。每组5个复孔。上清液1200 r/min离心10 s后吸取上层清液分装后放于-20 ℃冰箱里备用。
从4 ℃冰箱里取出试剂盒,室温平衡30 min,取出事先制备好的细胞上清液振荡离心混匀后,按照试剂盒说明进行TNF-α、IL-1β表达量的测定。
1.2.6 蛋白印迹法检测细胞中蛋白的表达 取对数生长期RAW264.7细胞以3×105个/mL接板于60 mm培养皿内,每皿4 mL培养24 h后待细胞贴壁。对照组更换新鲜培养基,石斛糖蛋白终浓度分别为25、50、100 μg/mL。继续培养24 h后弃去培养液,预冷PBS清洗2次,吸干PBS后,加入蛋白裂解液RIPA冰上裂解20 min,进行总蛋白提取。随后根据BCA试剂盒测定蛋白浓度,根据浓度制备好蛋白样品备用。SDS-PAGE电泳先采用50 V低电压跑30 min,后用100 V高电压跑100 min左右。电泳后在200 mA,60 min冰浴转到PVDF膜上,5%脱脂奶粉封闭膜1.5 h,TBST清洗3次,每次5 min。随后加入一抗(TGF-β、VEGF、IL-6、TNF-α、IL-1β、P-IκB、IκB、NF-κB、P-NF-κB)4 ℃孵育过夜。TBST洗膜后与1∶5000稀释的标记有辣根过氧化物酶(horse radish peroxidase,HRP)的鼠抗或者兔抗室温孵育1 h,洗膜后用发光液显色,采用image J对目的条带进行灰度分析。
1.2.7 铁皮石斛糖蛋白对小鼠伤口的愈合影响 动物实验根据国际指南进行,实验方案经云南农业大学机构动物伦理委员会批准。选取20只C57小鼠,每只小鼠背部左右两侧用刀片划开约1 cm对称的两对刀口,左侧涂抹凡士林,右侧涂抹用凡士林配制的2%铁皮石斛糖蛋白(预实验对0.5%、1%、2%、5%等浓度实验结果显示,当浓度为2%时,愈伤效果最佳),每天早晚各一次,连续7 d,停药23 d,分别于给药的第7 d、停药第5 d(即给药12 d)、第23 d(即给药30 d)用乙醚麻醉后拍照观察实验结果。事后用Image Pro对伤口面积进行分析,GraphPad Prism 5.01进行统计学分析愈合程度。

图2 铁皮石斛糖蛋白对RAW264.7细胞炎症因子mRNA表达的影响Fig.2 Effect of DOKMG on the mRNA expression of inflammatory factors in RAW264.7 cells注:*表示与对照组相比两组之间的差异;*P<0.05,**P<0.01,***P<0.001;图4~图7同。
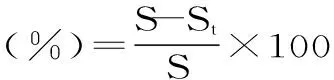
式中:St为测定当天的伤口面积,S为手术当天的伤口面积。
1.3 统计分析
实验数据采用GraphPad Prism 5.01统计作图软件进行处理,组间比较采用单因素方差分析和独立t检验,* 表示P<0.05,差异显著,** 表示P<0.01,差异高度显著,***,表示P<0.001,差异极显著。
2 结果与分析
2.1 铁皮石斛糖蛋白对RAW264.7细胞活力的影响
用MTT法检测铁皮石斛糖蛋白对RAW264.7细胞生长的调节作用。结果如图1所示,在实验剂量下,铁皮石斛糖蛋白的添加未影响细胞的存活率。因此,在本实验条件下,铁皮石斛糖蛋白在25~200 μg/mL的剂量下对RAW264.7细胞无毒害作用。
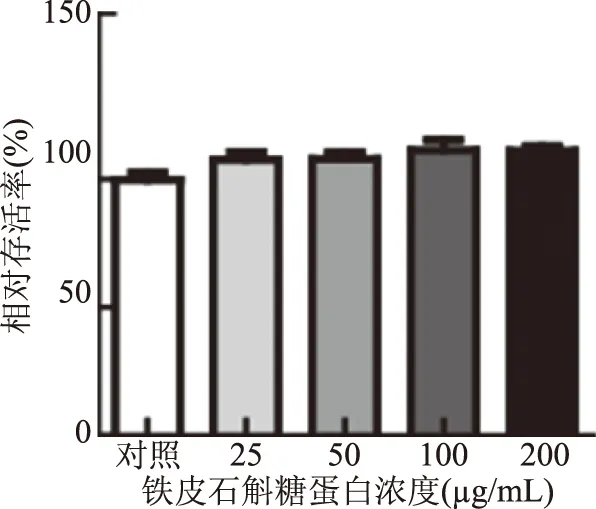
图1 铁皮石斛糖蛋白对RAW264.7活力的影响Fig.1 Effect of DOKMG on RAW264.7 vitality
2.2 铁皮石斛糖蛋白对IL-1β、IL-6、TNF-α炎症因子基因的影响
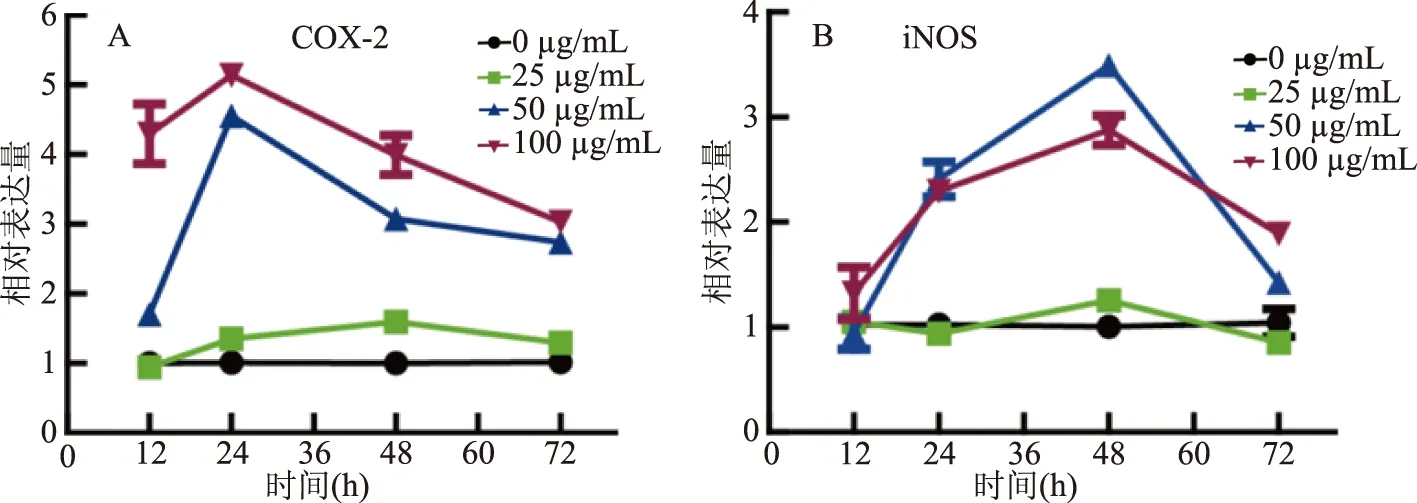
图3 铁皮石斛糖蛋白对炎性关键酶mRNA表达的影响Fig.3 Effect of DOKMG on the mRNA expression of inflammatory key enzymes

图4 铁皮石斛糖蛋白促进RAW264.7细胞分泌炎症因子Fig.4 DOKMG promotes the secretion of inflammatory cytokines in RAW264.7 cells注:图B中#表示与LPS组相比两组之间的差异;#P<0.05,##P<0.01,###P<0.001。
IL-1β、IL-6、TNF-α是炎症反应中常见的促炎因子,其表达量可间接反映炎症反应的程度。随着时间的推移,IL-1β、IL-6、TNF-α的相对表达量呈现先上升后下降的趋势,且在24 h达到峰值(图2A、B、C)。随着浓度的增加,IL-6、TNF-α的相对表达量也随之增加,在100 μg/mL时相对表达量最高。如图2D、E、F所示,与24 h的对照组相比,IL-1β在峰值(24 h,100 μg/mL)相对表达量增加了10.09倍,IL-6在峰值(24 h,100 μg/mL)相对表达量增加了20.45倍,TNF-α的峰值(24 h,100 μg/mL)相对表达量增加了0.95倍,均出现极显著差异(P<0.001)。炎症因子的基因表达预示,在铁皮石斛糖蛋白刺激24 h的促炎效果最佳,因此后续炎症因子检测均选用24 h这个时间点。
2.3 铁皮石斛糖蛋白对iNOS、COX-2基因表达的影响
iNOS可催化L-精氨酸不断地产生NO,且其产生能活化自身的环氧合酶COX,而COX-2与炎症密切相关[12]。由图3A、B所示,50、100 μg/mL各时间点的iNOS,COX-2的mRNA的表达量均在对照组之上。随着时间的推移,COX-2与iNOS的相对表达量均出现先上升后下降的趋势,iNOS在48 h达到峰值。随着浓度的增加,COX-2的相对表达量也随之增加。与24 h的对照组相比,COX-2在峰值(24 h,100 μg/mL)的表达量增加了4.14倍,与48 h的对照组相比,iNOS在峰值(48 h,50 μg/mL)的表达量增加了3.49倍。结果表明,铁皮石斛糖蛋白能促进炎性关键酶的mRNA的表达。
2.4 铁皮石斛糖蛋白对RAW264.7细胞炎症因子分泌量的影响
TNF-α作为肿瘤坏死因子,主要由巨噬细胞产生,是机体发生炎症反应的重要促炎因子。IL-1β是IL-1家族的一种,同样具有介导炎症的作用,在生理状态下巨噬细胞IL-1β的分泌量较少。LPS具有诱导RAW264.7细胞大量分泌IL-1β的作用,当细胞分泌的炎症因子因分泌量过少而不易检查时,加入LPS可促进检测的顺利完成[13]。如图4所示,随着铁皮石斛糖蛋白的浓度的升高,在其浓度为100 μg/mL时,TNF-α的分泌量呈现极显著增加(P<0.001),对照组中仅为0.52 μg/mL,而当铁皮石斛糖蛋白浓度上升为100 μg/mL时,分泌量达到1.99 μg/mL。IL-1β分泌量未能达到检测阈值,采用LPS诱导1 h后,再用铁皮石斛糖蛋白刺激,其分泌量由118.52 pg/mL达到272.81 pg/mL。此实验结果表明,铁皮石斛糖蛋白能促进炎症因子分泌。
2.5 铁皮石斛糖蛋白对炎症相关蛋白表达水平的影响
如图5所示,经过铁皮石斛糖蛋白处理24 h后巨噬细胞中的TGF-β、VEGF对铁皮石斛糖蛋白呈浓度依赖性变化,随着浓度的升高,其蛋白表达量逐渐增强。而炎症因子IL-6、TNF-α、IL-1β的蛋白表达也随着石斛糖蛋白浓度的增加而增加,且在浓度达到100 μg/mL时有显著性差异(P<0.05),TNF-α、IL-1β、IL-6的相对蛋白表达量分别为1.41、3.01、1.61。
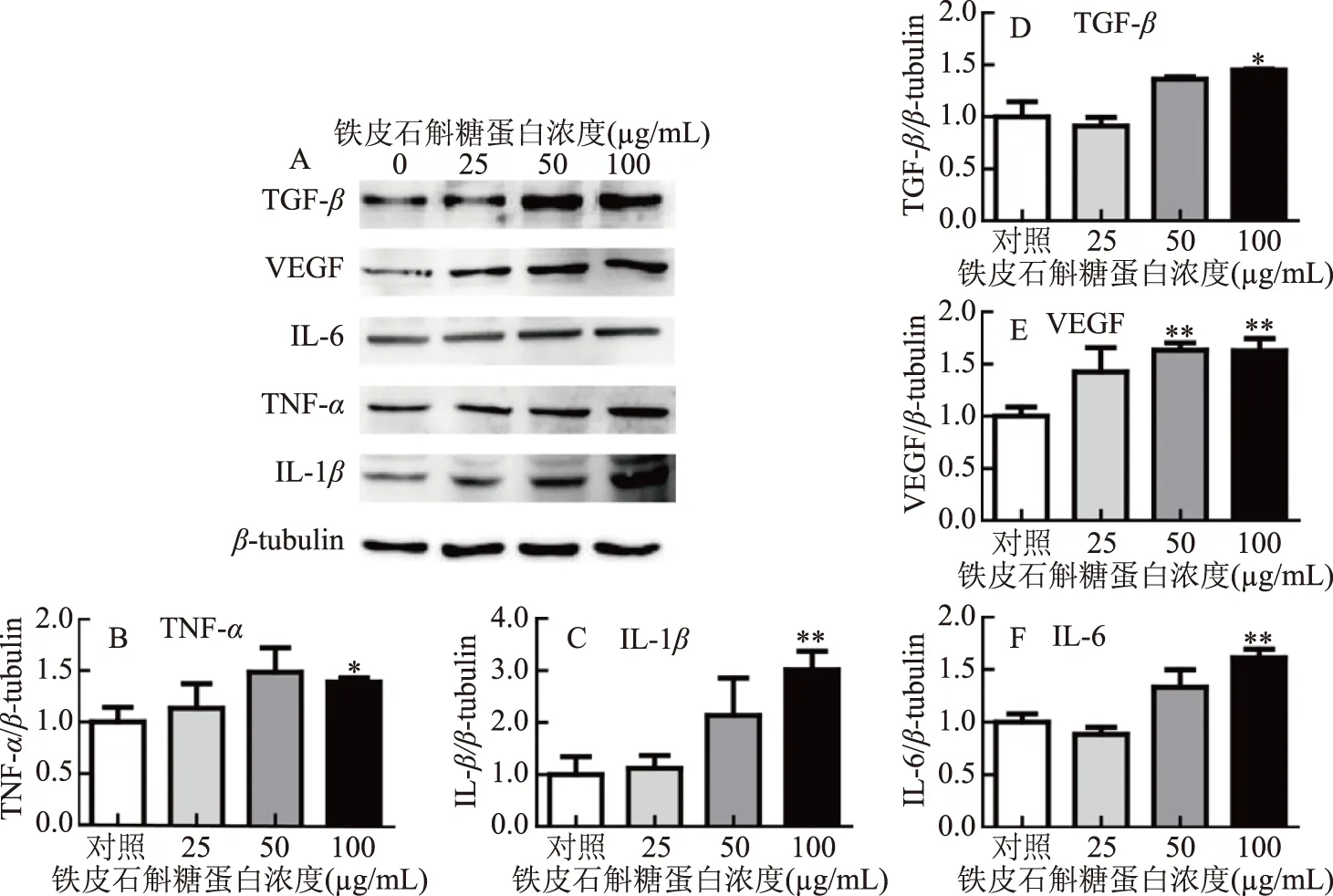
图5 铁皮石斛糖蛋白促进炎症因子蛋白表达Fig.5 DOKMG promotes the expression of inflammatory cytokines
2.6 铁皮石斛糖蛋白对信号通路NF-κB的影响
为了了解铁皮石斛糖蛋白促进炎症的机制是否与NF-κB信号通路有关,检测不同浓度铁皮石斛糖蛋白处理后NF-κB信号通路上各项蛋白的变化情况。如图6所示,当铁皮石斛糖蛋白的浓度达到100 μg/mL时,NF-κB的上游蛋白IκB的磷酸化程度相比对照组高度显著(P<0.01)增加了0.99,当铁皮石斛糖蛋白处理的浓度为50 μg/mL时,NF-κB的磷酸化程度显著(P<0.05)增加了0.85。上述结果表明,铁皮石斛糖蛋白能显著促进NF-κB信号通路相关蛋白的磷酸化。据文献报道,AMPK是一种参与能量稳态的酶,能调节炎症反应,与NF-κB、COX-2有一定关联[14]。结果表明,在经过25 μg/mL的铁皮石斛糖蛋白刺激后其磷酸化相比对照组有显著增强(P<0.05)。因此,铁皮石斛糖蛋白可能通过AMPK介导的NF-κB信号通路促进炎症发生。
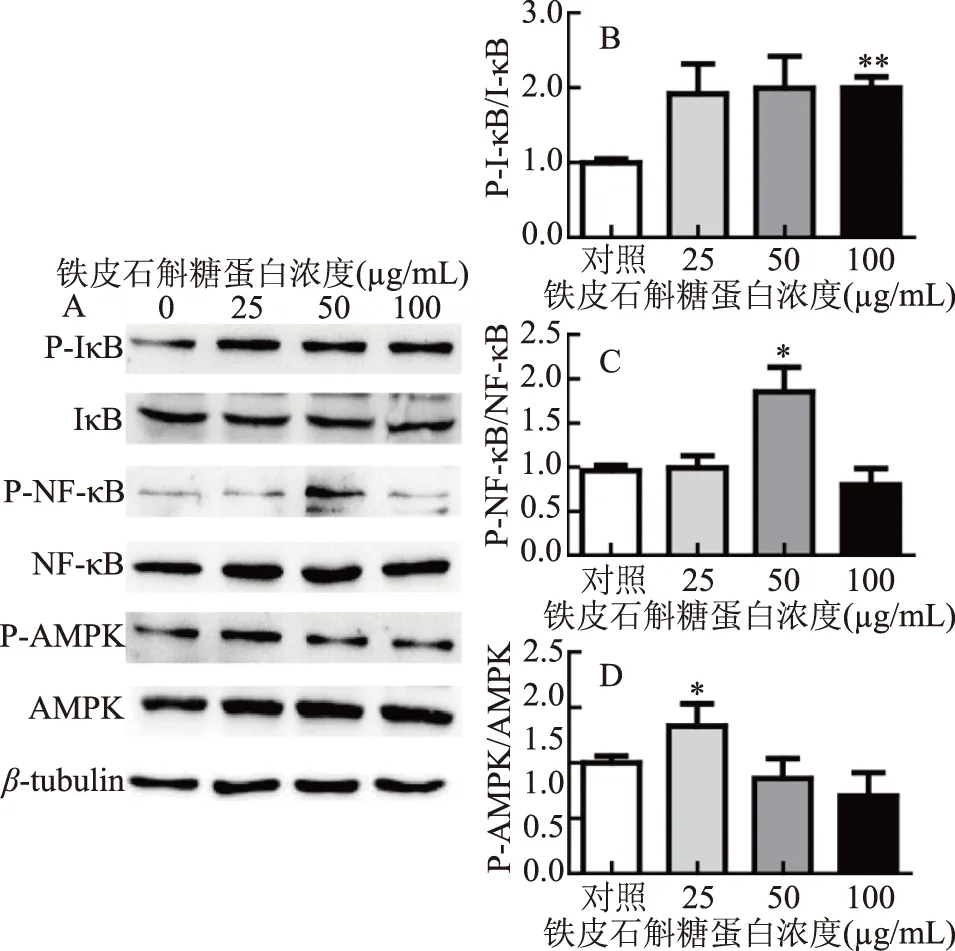
图6 铁皮石斛糖蛋白通过NF-κB信号通路促进炎症发生Fig.6 DOKMG promotes inflammation through theNF-κB signaling pathway
2.7 铁皮石斛糖蛋白对小鼠伤口愈合的影响
通过小鼠皮肤损失模型检测了铁皮石斛糖蛋白是否具有促进伤口愈合的功效。由图7可知,相对伤口愈合率以时间依赖的方式增加,铁皮石斛糖蛋白组在第7和第12 d愈合率达到65.45%、72.45%,比凡士林为对照的组增加了15.20%、12.36%。本结果结合前面的细胞及炎症因子的检测,预示着铁皮石斛糖蛋白可能在受损早期(炎症期)通过调节炎症因子表达来促进小鼠皮肤伤口愈合。

图7 铁皮石斛糖蛋白对小鼠伤口的作用Fig.7 Effect of DOKMG on wound healing in mice
3 讨论与结论
伤口愈合是一个复杂和动态的过程[15],包括炎症、肉芽组织形成、瘢痕形成三个阶段。炎症阶段作为伤口愈合的第一个时期,适度的炎症反应有利于伤口的愈合。巨噬细胞在创面修复的炎症期中起到了重要作用[16-17]。在炎症的初期,巨噬细胞能清除坏死组织,细胞碎片以及其他机体组织中的异物,分泌转化生长因子(TGF-β),成纤维细胞生长因子(FGF)血管生长因子(VEGF)等细胞因子,刺激成纤维细胞增殖迁移,有利于胶原沉积,肉芽组织生成。同时促进新生血管生成[18]。
NF-κB是一种核转录因子,与多种免疫细胞的增殖,迁移,分化紧密相关[19]。Park等发现,丝素蛋白通过NF-κB信号通路调节成纤维细胞的波形蛋白、周期蛋白、纤维连接蛋白和血管内皮生长因子的表达促进伤口愈合[20]。低温等离子体可通过诱导活性氧ROS的产生,上调磷酸化的p65,下调IκB的表达,激活NF-κB信号传导途径改变成纤维细胞周期实现伤口愈合[21]。AMPK是一种能量传感器,调节能量代谢和机体能量的储存[22]。AMPKα1是巨噬细胞功能和表型极化的重要调节因子,与NF-κB、COX-2有一定的关联[14]。研究结果发现,以RAW264.7为细胞系,铁皮石斛糖蛋白刺激24 h后,NF-κB、IκB的磷酸化随着其浓度增加相对对照组有一定的显著性差异,意味着铁皮石斛糖蛋白可能通过NF-κB途径调控炎症。与此同时,在铁皮石斛糖蛋白浓度为25 μg/mL时,AMPK的磷酸化也相对对照组有显著性增加,这可能暗示着AMPK与NF-κB是正相关关系,与NF-κB协同调控炎症。
本研究发现在基因的水平上,铁皮石斛糖蛋白能在一定时间内促进炎症因子IL-1β、IL-6、TNF-α和炎症相关酶COX-2、iNOS的表达。且随着时间的延长促进作用有所降低。这种现象可以很好地解释铁皮石斛糖蛋白在伤口愈合的炎症期,先起到促炎的作用,使巨噬细胞快速清理细胞碎片和坏死的组织,将体内异物排除,随时间推移,促炎效果减弱,降低持续炎症给机体带来的伤害。为更好地研究铁皮石斛糖蛋白的促炎机理,选用促炎效果最好的24 h这个时间点对后续实验研究,发现细胞上清分泌的炎症因子在铁皮石斛糖蛋白的刺激下也有所增加,这种现象同样发生在通过WB实验检测的蛋白水平。Western blot实验同时发现,铁皮石斛糖蛋白激活了NF-κB信号通路导致炎症加深。为验证铁皮石斛糖蛋白是否通过调控炎症促进伤口愈合,建立了小鼠全程皮肤损伤模型,结果发现,相对凡士林组,石斛糖蛋白组的愈合率在第7与第12 d都出现了显著增加(P<0.05)。从体内证明了起初的假设——铁皮石斛糖蛋白通过调控炎症促进伤口愈合。
目前跟炎症相关的文献,大部分认为炎症是对机体是有害的,因此,研究的侧重点主要在药物的抗炎性,而早期适度的炎症反应有利于创面的愈合[23-24],本文评价了炎症在早期伤口愈合过程中扮演的正向调节作用,发现炎症有利于伤口愈合的特性,但伤口愈合后期炎症同样会延误受损部位的恢复。
总之,本研究在评估铁皮石斛糖蛋白对巨噬细胞炎症的调控的基础上,对铁皮石斛糖蛋白促炎的分子机理进行了初步的探索,明确了铁皮石斛糖蛋白能明显促进炎症因子IL-1β、IL-6、TNF-α的表达。通过本研究,可以为铁皮石斛糖蛋白愈伤作用的机理研究提供重要的理论依据,有利于铁皮石斛在功能食品与膳食方面的开发,促进石斛产业的可持续发展。
