制备蔗糖源高果糖浆的酶解参数的优化
2020-11-18米运宏蓝伯广
米运宏,梁 鹏,蓝伯广
(1南宁纵联科技有限公司,广西南宁530033;2广西本草坊保健品有限公司,广西南宁530007)
0 引言
蔗糖酶(Sucrase)[1]也称蔗糖转化酶(invertase)[2]或 β-D-呋喃果糖苷水解酶(β-D-fructofuranoside fructohydrolase)(EC.3.2.1.26)特异地催化非还原糖中的β-D-呋喃果糖苷键水解,能催化蔗糖水解生成等量葡萄糖和果糖[3],称之为转化糖浆[4]。蔗糖水解成果糖和葡萄糖可以通过酸水解[5]或蔗糖酶水解[6]。酸水解需要添加酸性物质如柠檬酸钠、盐酸、硫酸等至蔗糖溶液中使pH值降至2~3,再经过高温保压使蔗糖水解。在高温高压下蔗糖水解成果糖和葡萄糖,同时糖也发生美拉德反应,导致转化糖液色泽较深,在后工序中需要增加脱色、脱盐、浓缩等工艺。虽然酸水解中时间较短,但是从整个生产来说时间并没有缩短,反而造成生产操作复杂化等不足。因此,在实际生产中用蔗糖酶液或冻干蔗糖酶,两者均为游离酶,游离蔗糖酶用于转化蔗糖反应结束后需要要灭酶,且仅能用1次,而把游离蔗糖酶固定于特定载体中获得固定化蔗糖酶[7-8],用于转化蔗糖反应完全只需把固定化蔗糖酶回收,不用灭酶,因此,固定化蔗糖酶可重复使用,直至固定化蔗糖酶活性降低到不再适合使用为止[9]。蔗糖(白砂糖)是历史悠久的最常用的甜味剂之一[10],清甜纯正,无不良感或甜腻感。白砂糖主要以结晶体形式在市场上销售,除了保存和运输方便外,使用中存在许多不便,日常烹饪中添加白砂糖调节菜品的口味或色泽,溶解时间长、着色不均、局部容易焦化等不足,白砂糖以调甜味加到如奶茶、凉茶不容易溶解,在饮料工厂加入白砂糖需要加热搅拌溶解,增加了能耗等。此外,目前使用玉米源高果糖浆存在对人体健康的风险[11],为为了克服白砂糖此类使用不足和满足市场细细分需要,市场上出现月饼专用标准糖浆(烧烤糖浆、 烹 饪 糖浆、奶茶专用糖浆、调味糖浆)[12-13]、甘 蔗 糖浆[14-15]、冰糖浆等等,而此类糖浆含有一定量的蔗糖成分,不能完全用淀粉糖浆如玉米源高果糖浆[16-17]、麦芽糖浆代替。但蔗糖源高果糖浆销售价格比淀粉源果葡糖浆贵将近一倍。除了生产原料白砂糖价格高之外,生产成本高也导致致蔗糖源高果糖浆价格偏高。为了提高蔗糖源果葡糖浆竞争力,利用固定化蔗糖酶法生产蔗糖源果葡糖浆对降低产品成本效果显著,且优点明显:首先工艺上减少灭酶、脱色能耗;其次固定化蔗糖酶可重复使用,减少酶的的成本;最后是产品质量比较纯净、、保持产品色香味、甜度增厚,不容易结晶[18]。而固定化蔗糖酶生产蔗糖源果葡葡糖浆的关键是蔗糖酶固定化技术[19]和固定化蔗糖酶转化蔗糖[20]的控制参数,本文主要介绍固定化蔗糖酶转化蔗糖生产蔗糖源果葡糖浆的控控制参数的优化。
1 材料与方法
1.1 材料
优质白砂糖(南南宁糖业明 阳糖厂)、乙腈腈(色谱纯,天津四友)、固定化化蔗糖酶(自制,活力为2..5万U/g)、试验反应罐(OK-10 L,浙江新欧科),验证试验反应罐(TR08-1000 L,江苏天宇)、板框过滤机((WBG-1200 mm,广州恒东机械),超高温瞬时灭菌器(RD 6L10,北京东方海川)、二效真空浓缩器(SJN-100000,温州成东药机)、直线灌装机(GTL--4,山东青州膏体达)、反渗透纯水机(HCC-1000,北京京东方海川)、高效液相色谱仪(LA100,日本岛津,示差检测器)、工作站(N20000,浙江大学)、旋振分离筛(TS-12000,河南新乡天丰振动机械)。
1.2 实验方法
1.2.1 工艺流程[21--23]
固定化蔗糖酶法制备蔗糖源高果糖浆的工艺流程见图1。
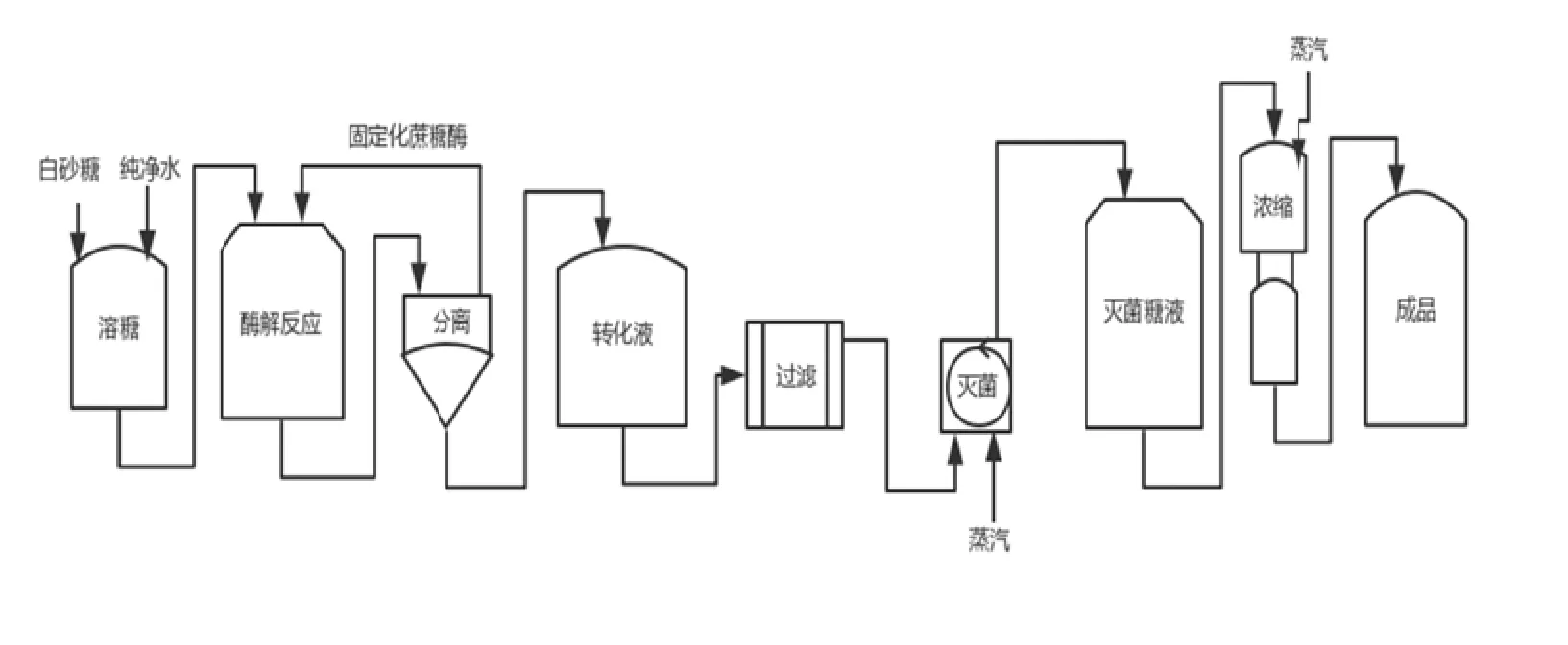
图1 固定化蔗糖酶法制备蔗糖源高果糖浆工艺流程图
1.2.2 反应设备技技术参数
单因素试验验设备采用1000 L不锈钢反应罐,径高比为为5/9,叶片式搅拌浆,搅拌不可调转速为1200 r/minn,夹套导热油保温,温度差可控±0.5℃,反应装料量为75 L;验证试验设备采用10000 L不锈钢反反应罐,径高比 55/9,叶片式搅拌浆,搅拌变频调速120 r/mmin,夹套保温,温差可控±0.5℃,,反应加料量为7750 L。
1.2.3 单因素实验
1.2.3.11 固定化酶用量对转化率的影响
固定化蔗糖酶用量分别为0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%、0.5%、0.55%、0.6%,温度50℃,pH 5.0,底物浓度(蔗糖液浓度)50%,反应时间8 h进行试验。
1.2.3.2 温度变化对转化率影响
反应温度分别为 40、45、50、55、60、65、70、75、80℃,pH 5.0,底物浓度50%,反应时间8 h,固定化酶用量0.25%进行试验。
1.2.3.3 pH变化对转化率影响
反应pH分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,温度50℃,底物浓度50%,反应时间8 h,固定化蔗糖酶用量0.25%进行试验。
1.2.3.4 反应底物浓度变化对转化率影响
底物浓度分别为45%、50%、55%、60%、70%、75%、80%、85%,其它影响因素温度50℃,pH 5.0,固定化蔗糖酶用量0.25%,反应时间8 h进行试验。
1.2.3.5 反应时间变化对转化率影响
反应时间为 4、6、8、10、12、14、16、18 h,温度50℃,pH 5.0,底物浓度50%,固定化蔗糖酶用量0.25%进行试验。
1.2.4 响应面试验
利用Design-Expert 7.0中软件Box-Behnken设计与分析,根据单因素试验结果确定固定化蔗糖酶添加量(A)、反应温度(B)、pH(C)、反应底物浓度(D)、反应时间(E)为因素水平取值范围,并以这5个因素为自变量,以转化率R1为响应值,利用Box-Behnken模型设计5因素3水平试验组作响应面分析,因素水平值见表1。

表1 试验因素及水平值
1.2.5 转化率计算
式 1中葡萄糖(G)、果糖(F)和蔗糖(GF)是指反应转化结束后的转化液用高效液相测得的数据。试验试剂和检测方法按中华人民共和国国家标准GB/T 20882-2007《果葡糖浆》规定方法[24-25]。
1.2.6 验证方法
每次反应验证都用同一批次新的固定化蔗糖酶,其它控制反应参数经过优化获得的数据。反应结束把固定化蔗糖酶回收,反应液经过瞬时灭菌后,取样用高效液相色谱仪检测转化率。

1.2.7 数据处理
按要求所得的数据,运用软件Design-Expert 7.0进行模型设计和分析。
2 结果与分析
2.1 单因素试验
2.1.1 固定化酶用量对转化率影响
固定化蔗糖酶用量对转化率的影响见图2。由图2可以看出,在反应时间、pH、底物浓度、温度不变,改变添加固定化蔗糖酶的用量,随添加量增加,转化率随之快速提高,从酶用量0.1%时转化率为83%,到0.15%时转化率94%几乎是直线上升,从 0.15%~0.2%转化率升高有所放缓,转化率从94%升至97%,只升高3%,0.2%~0.3%缓慢上升,酶用量到 0.3%~0.4%时转化率只升高 0.4%。添加量为 0.4%以上时,转化率升高 1%以下。从经济角度考虑,酶添加量应该选用0.3%~0.4%之间比较合理。
2.1.2 反应温度对转化率的影响
温度变化是生物酶反应最主要因素之一,在酶耐受温度内,温度每变化10℃,酶反应速率提高1~3倍,具体试验见图3。
从图3看出,反应温度40~60℃转化率处于上升阶段,40~50℃转化上升较快从76%快速升96%,而反应温度50~60℃,转化率从96%升到99.7%。反应温度超过60℃转化率开始下降,温度在60~65℃转化率下降缓慢,超过温度65℃转化率有了较快下降,反应温度在75~80℃转化率急速下降,转化率从86%快速降到53%。反应温度在随温度升高,酶反应开始向最适温度靠近,所以转化率在上升阶段,当反应温度升到60℃左右,转化率最高说明接近最适适反应温度,温度继续升高,转化率开始下降,说明反反应温度超过酶解最适反应温度,超过温度越高,转化率下降越快,高温对酶活性有抑制或杀灭。图3可看出固定化蔗糖酶对温度是敏感的,生产上考虑选取的反应温度应该在55~65℃。
2.1.3 反应pH值对转化率的影响
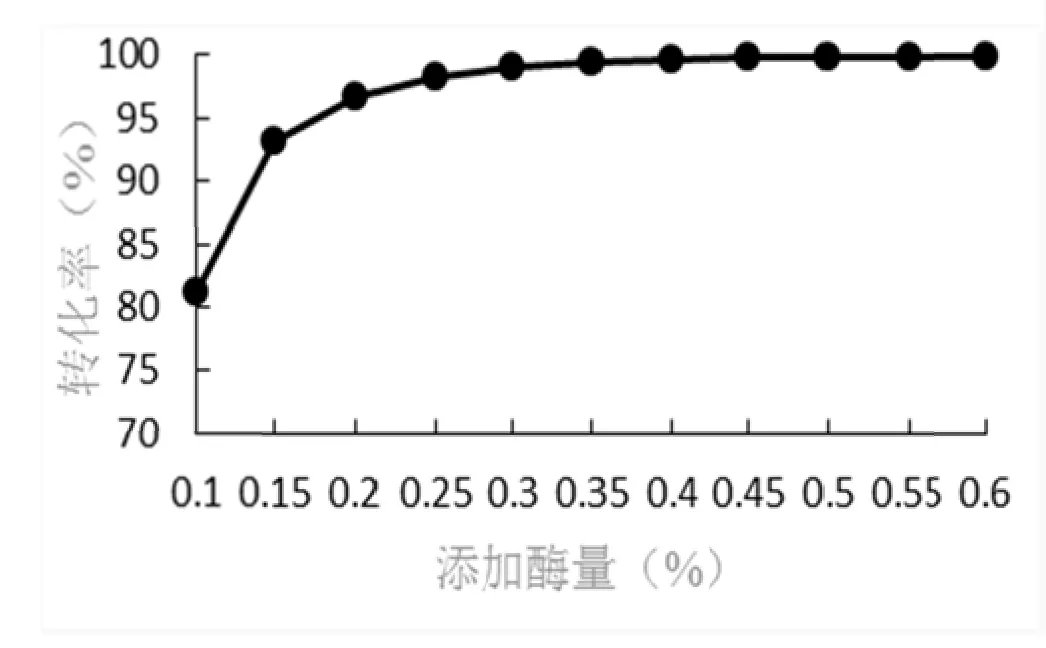
图2 固定化蔗糖酶不同用量对转化率的影响
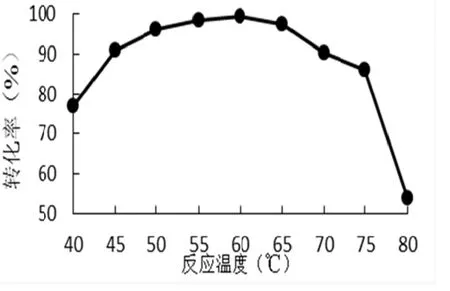
图3 不同反应温度对转化率影响
考查固定化蔗糖酶转化化蔗糖受到反应系统 pH变化对反应影响情况结果见图4。
图4在pH 33.5时转化率率79%,一直直平缓上升至至pH 55.5,转化率99.8%,当pH值继续升升高至6.5,转化率率降到83%%,pH值越高,转化率下降幅度较大,,当pH升至8转化率仅为41%。从曲线图4可得pH在5~~5.5区间为最适反应pH值,pH 3.5~5.5为酸酸性区,pH值高于5.5之后,转化率下降比较快,pH为7中性时转化率为74%,很明显固定定化蔗糖酶具有耐低pH值,综合考虑选取反应pH在5~6区间。
2.1.4 反应底物浓浓度对转化率率的影响
固定化蔗糖酶转化蔗糖中仅改变蔗糖浓度,其它因素为温度 500℃,pH 5..0 固定化蔗糖酶用量0.25%,反应时间8 h影响情况见图5。
从从图5中可以看出蔗糖浓度在 50%%转化率为99.8%,到蔗糖浓度为70%时转化率为877.5%,蔗糖浓度超过70%时,固定蔗糖酶酶转化率开始始呈快速下降趋势,蔗糖浓度75%时转化化率70%,蔗糖浓度为85%,转化率为 334%。转化率随蔗糖浓度升高,转化率随之下降,是由于蔗糖浓度升高,反应体系中的黏度也升高,进而影响了酶分子运动,导致酶解反应速度变慢。从能耗大小考虑,应该选择底物浓度在65%~75%之间。
2.1.5 反应时间对转化率的影响
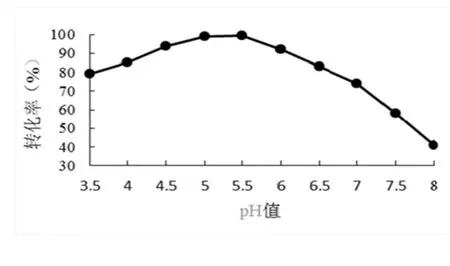
图4 不同反应pH值对转化率的影响
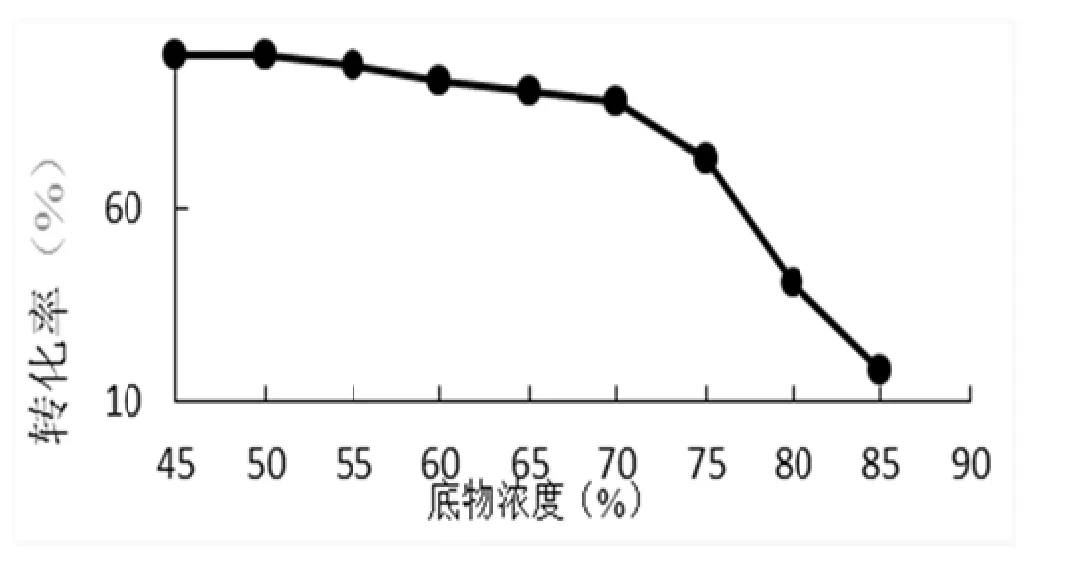
图5 反应底物不同浓度对转化率的影响
反应温度 50℃、pH 55.0 固定化蔗糖酶用量0.25%,反应液中蔗糖浓度50%,反应时间为4、6、8、10、12、14、16、18 h试验结果见图6。
从图6看出反应时间4~8 h转化率曲线很陡,,之后一直平稳。说明 4~8 h反应还没有转化完全,故转化率一直上升阶段。8~18 h转化率变化不大,说明反应已经达到或处于平衡阶段。酶促促反应时间应选在在 8~12 h。
2.2 响应面面优化
2.2.1 响应应面优化试验
利用BBox-Behnkeen模型设计试验组作响应面分析,试验设计与结果见表2,方差分析见表3。
由表3可看出模型极显著(P<0.0001),说明5个因素变量与转化率之间的线性关关系显著。失拟合项P=0.0942>0.05,不显著,说明本试验所得得二次回归方程能能很好地对响响应值进行预预测。试验值值与回归方程预测值的相关系数R2为0.99798,说明该该模型能解释97.98%响应值的的变化,只有有2.12%不能能用此模型解释,拟合情况很很好。校正拟合度AdjjR2为0.9637和预测拟合度PrredR2为0.9230,两者数数字相近且数值较大接近 1,说明该模型型具有较好的的回归性。变异系数数(CV)表示试试验的精确度度,其数值越越小,试验结果的可靠性越高高。
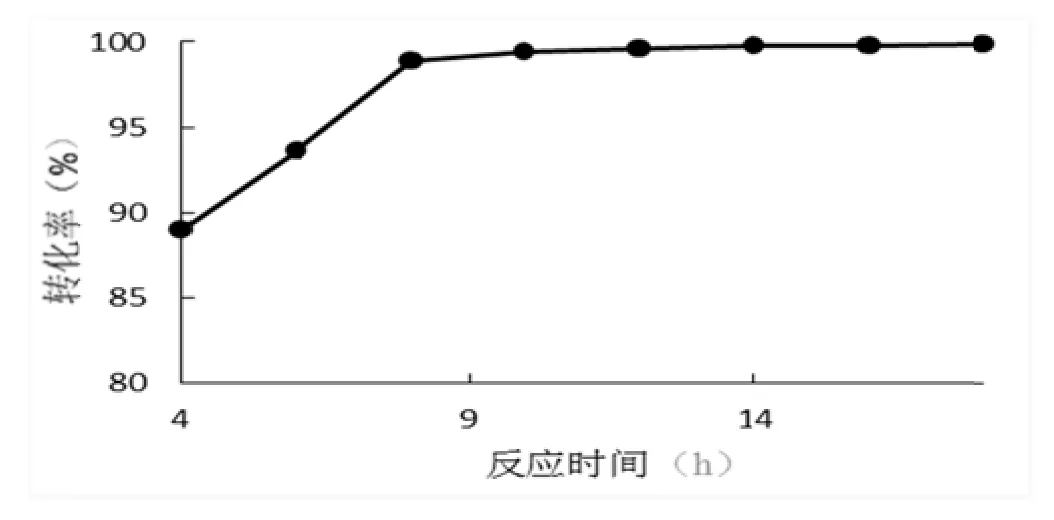
图6 不不同反应时间对对转化率的影响
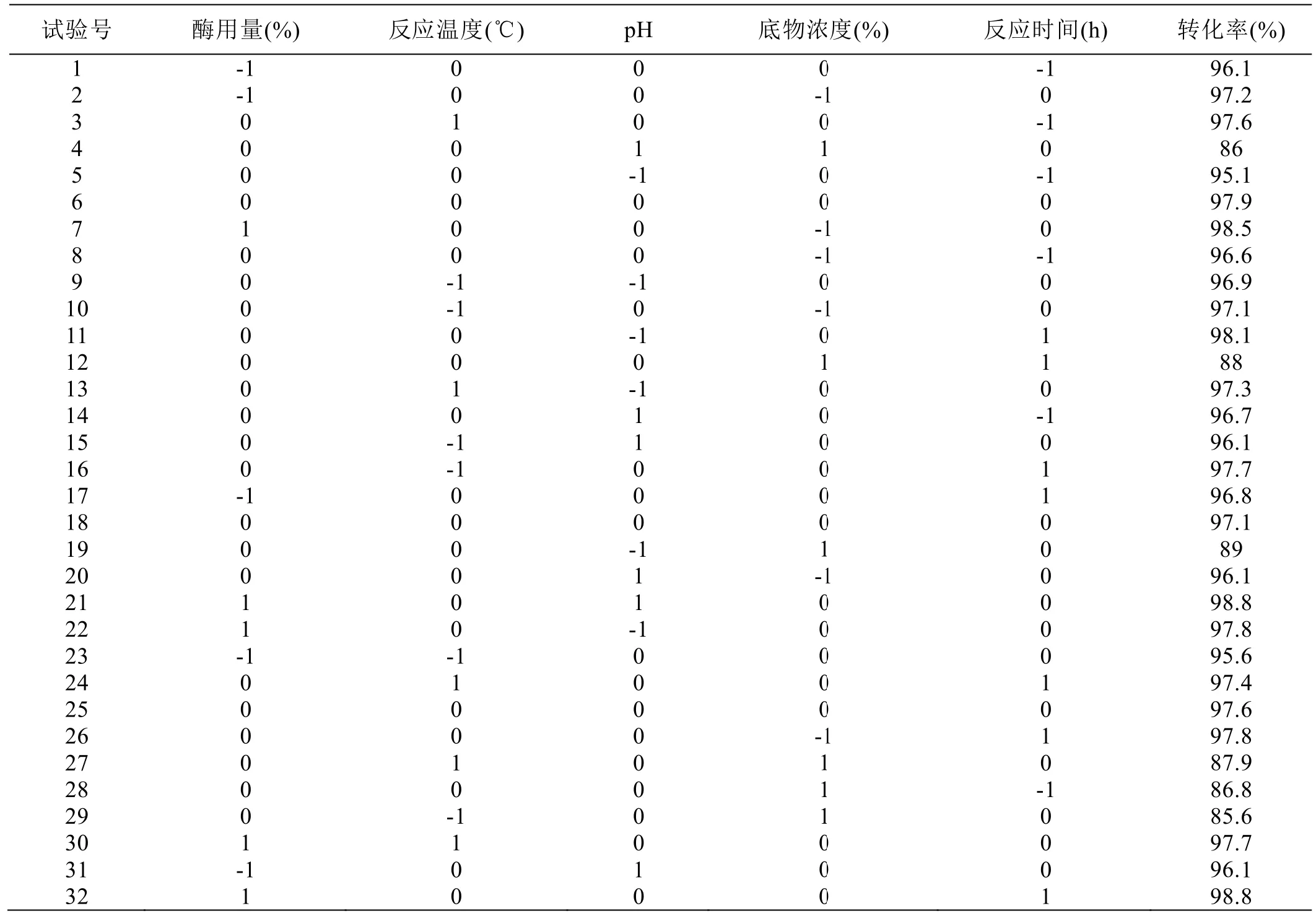
表2 响应面试验验设计与结果
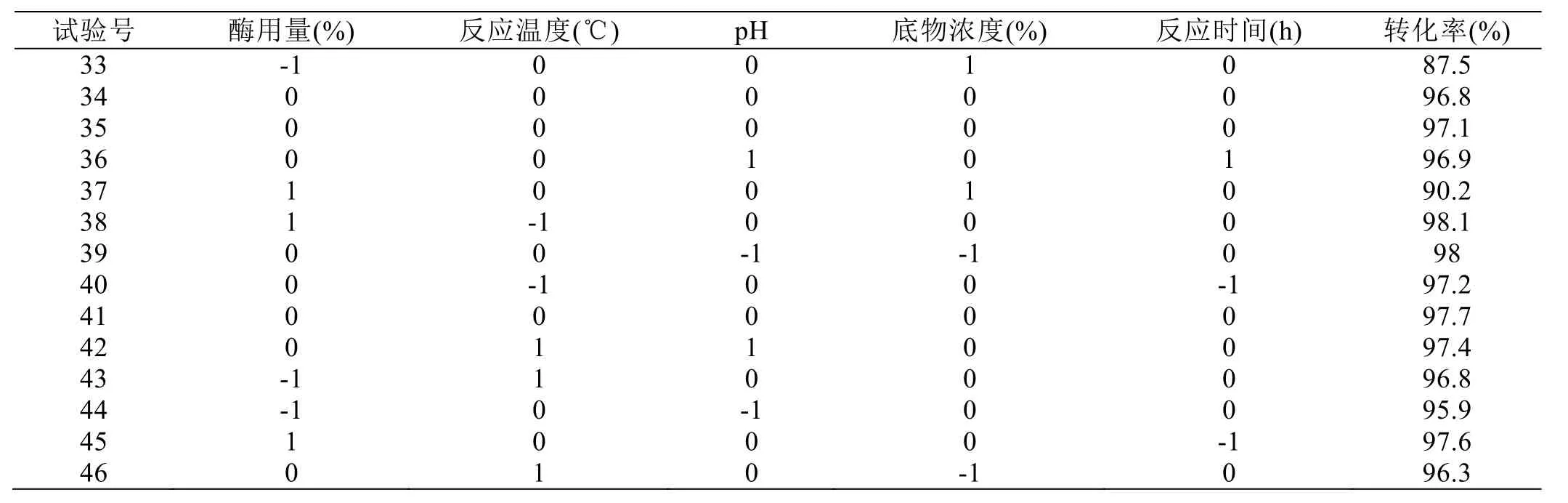
试验号 酶用量(%) 反应温度(℃) pH 底物浓度(%) 反应时间(h) 转化率(%)33 -1 0 0 1 0 87.5 34 0 0 0 0 0 96.8 35 0 0 0 0 0 97.1 36 0 0 1 0 1 96.9 37 1 0 0 1 0 90.2 38 1 -1 0 0 0 98.1 39 0 0 -1 -1 0 98 40 0 -1 0 0 -1 97.2 41 0 0 0 0 0 97.7 42 0 1 1 0 0 97.4 43 -1 1 0 0 0 96.8 44 -1 0 -1 0 0 95.9 45 1 0 0 0 -1 97.6 46 0 1 0 -1 0 96.3
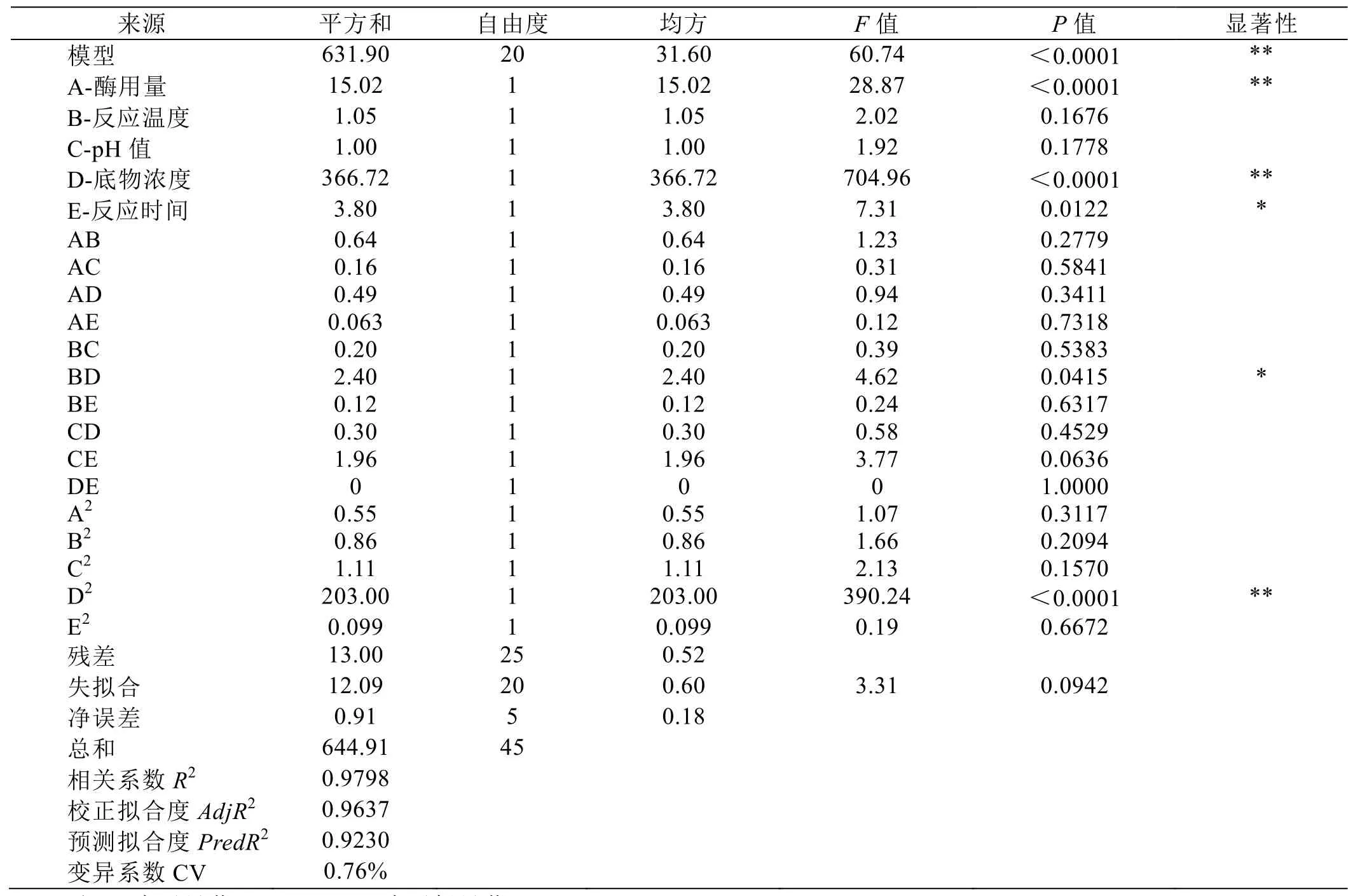
表3 响应值模型方差分析
本试验 CV为 0.76%,在可接受范围内说明试验结果可靠很高[26-27]。从回归方程系数显著性可知,一次项A、D、E极显著,互交项 BD及二次项D2表现为显著。由F值大小可得出各因数影响大小,依次为底物浓度(D)>添加酶量(A)>反应时间(E)>反应温度(B)>pH(C)。经回归拟合后得到二次多项式编码回归方程:转化率(%)(Y)=97.37+0.97A+0.26B-0.25C-4.79D+0.49E-0.40AB+0.20AC+0.35AD+0.12AE+0.23BC+0.78BD-0.17BE-0.27CD-0.70CE+0×DE+0.25A2-0.31B2-0.36C2-4.82D2-0.11E2。
图7是BD互交项为显著项的所得到的二次回归方程的R1响应面3D图。图底部等高线及曲面形状反映交互作用大小,当为椭圆形时,表示交互作用显著,而圆形则表示交互作用不显著[28]。
2.3 响应面面优化最佳控控制参数
经过软软件分析,设设置软件响应值(转化率率)达到最大化(maaximize)[29],模型运行预测得到最佳控制参数:酶用量0.4%,反应温度588.36℃,pH5.13,底物浓度66.9%,反应应时间12.82 h。响应面法优化结果见图8~10三维效果图。
图8~10是在最佳条件的情况下,影响最大因素底物浓度和影响第2位因素的3D效果图,由图可见等高线互交作用显著,响应曲面的倾斜度较高,颜色也由浅蓝色渐变深绿色,说明交互作用显著。
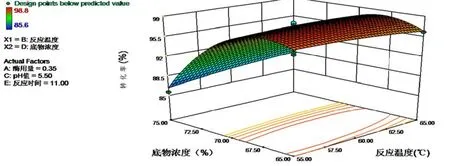
图7 互交项BD响应面三维图
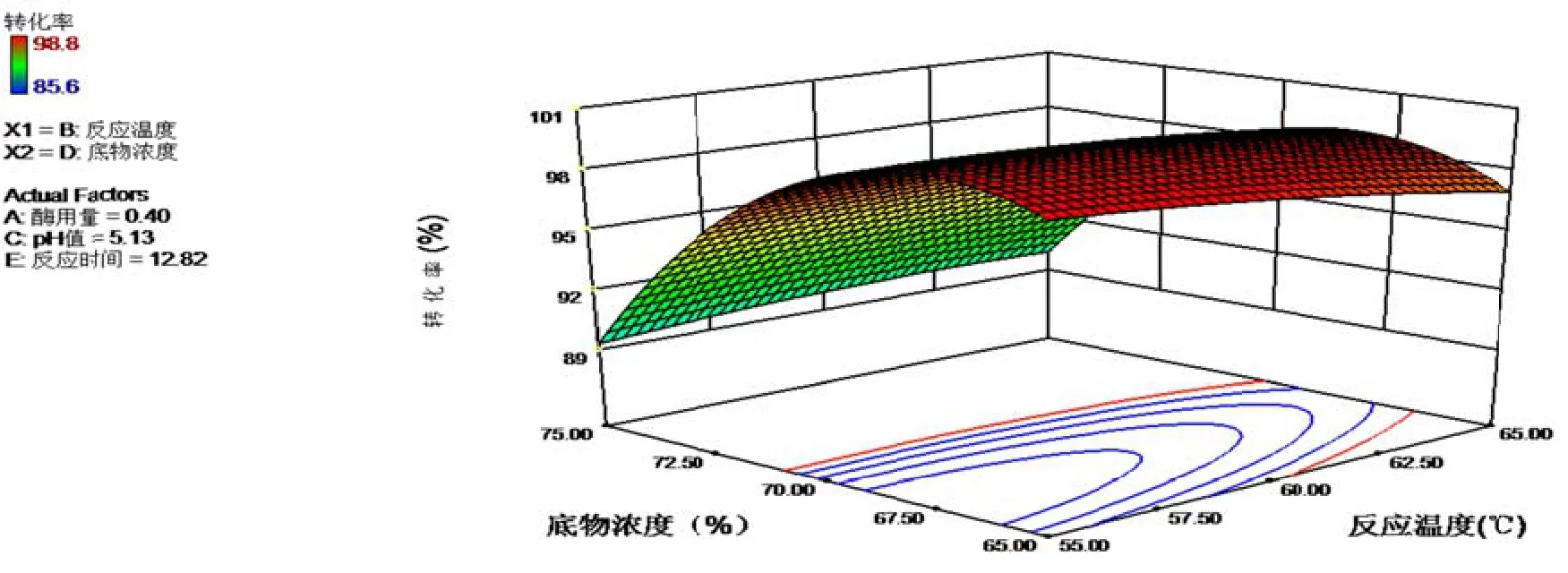
图8 最佳条件下下BD互交项转化率3D效果和等高线图
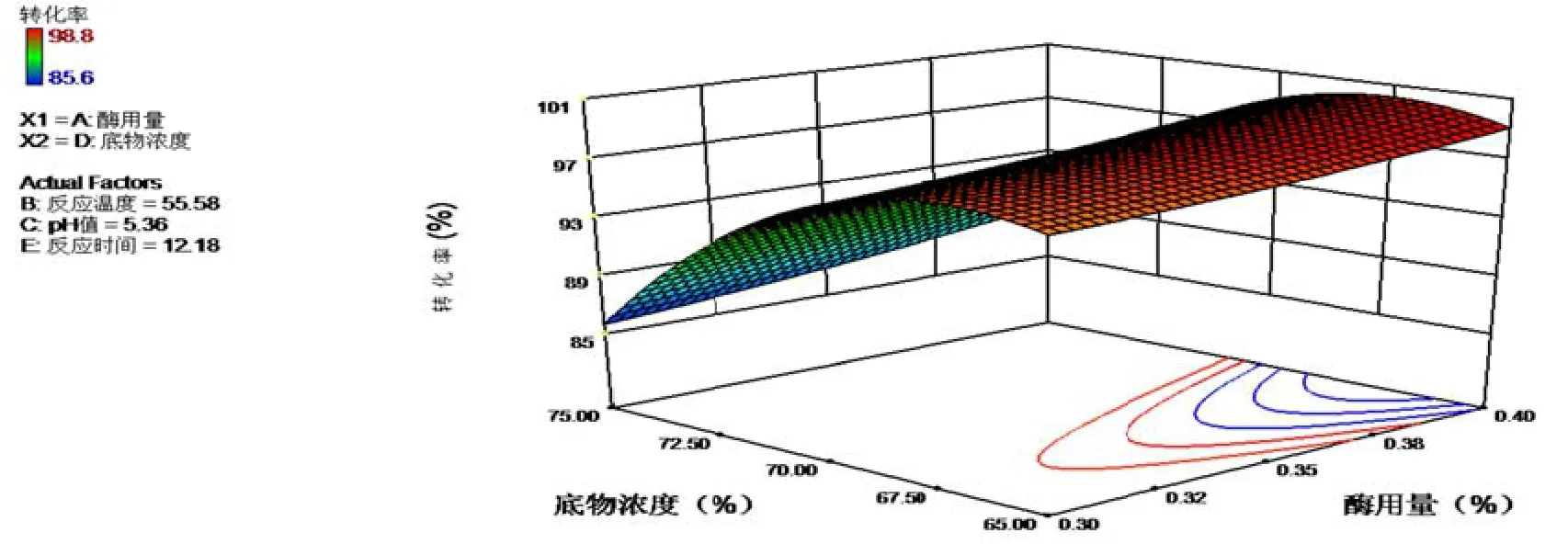
图9 最佳条件AD互交项3D效果和等高线图
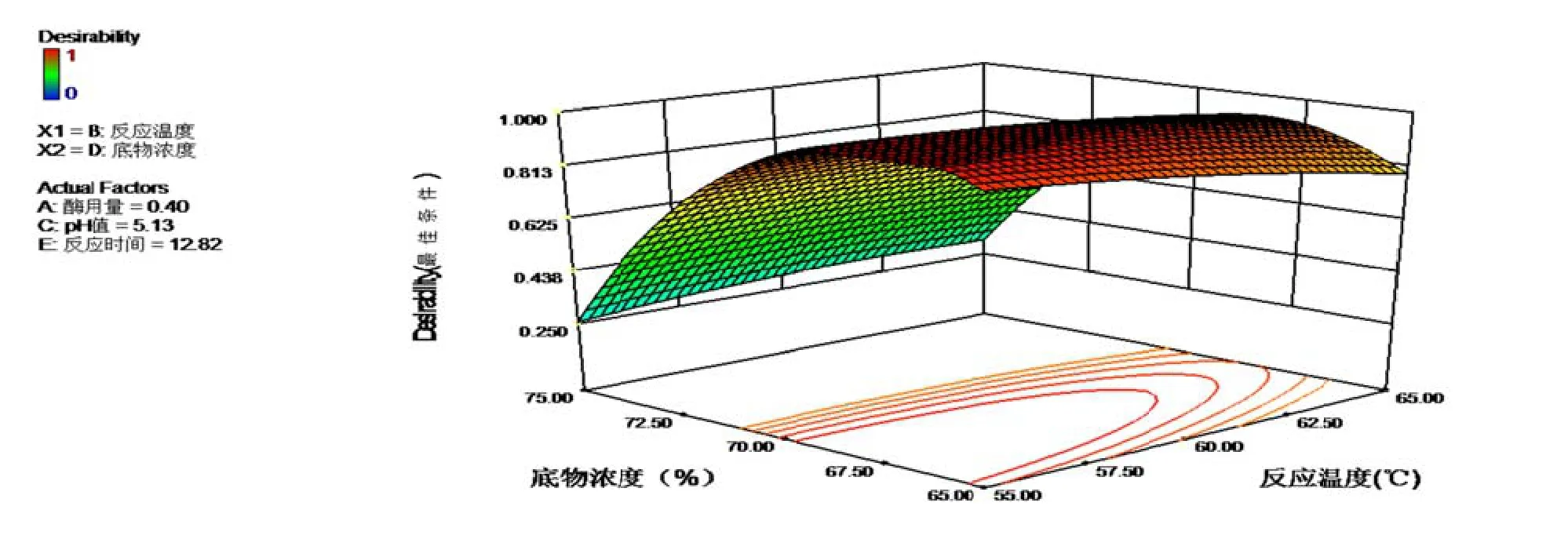
图10 最佳条件下BD互交项3D效果和等高线图
2.4 模模型验证
根据优化得到操作参数:添加酶量(A)0.4%,反应温度(B)58.36℃℃,pH(C)5.13,底物浓度(D)66.9%,反应时间(E)13.115 h,按实际操作修改为添加酶量(A)0.4%,反应温度(B)58.4℃℃,pH(C)5.11,底物浓度(D)677%,反应时间(E)13 h。验证检测结果可见图11~13。
由表4~6可以看出反应液中果糖、、葡萄糖、蔗糖含量,表4果糖、、葡萄糖、蔗糖糖含量分别为49.61%、48.34%%,2.05%,由此可计算出第一次验证的转化率为97..95%;表5果糖、葡萄糖、蔗糖含量为别为51.43%、47.19%,1.38%,计计算出第 2次次验证的转化率为为98.62%;表6果糖、葡萄糖、蔗糖含量为别为50.44%、48.20%,1.36%,计算得第3次验证的转化率为98.65%;;平均转化率为98.41%,与软件预测转化化率接近,说明模型预测可靠。
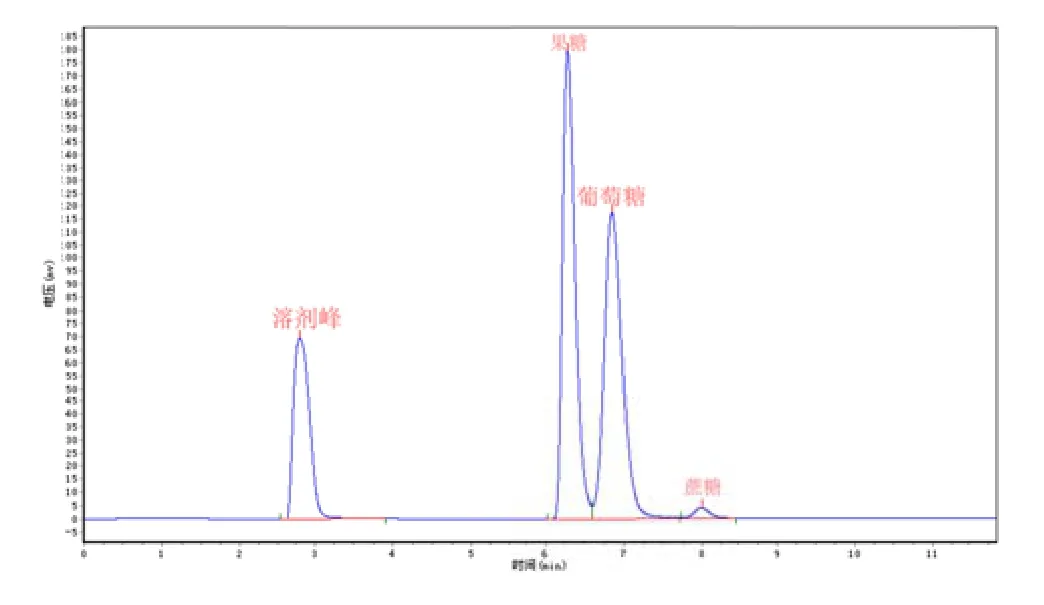
图11 第一次验证反应分离液的高效液相谱图
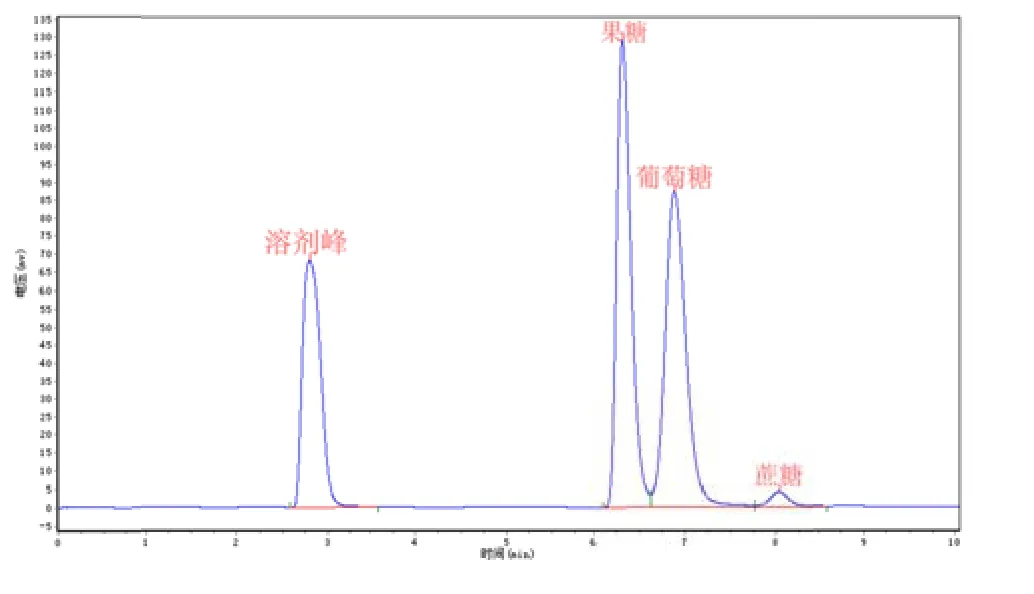
图12 第二次验证反应分离液的高效液相谱图
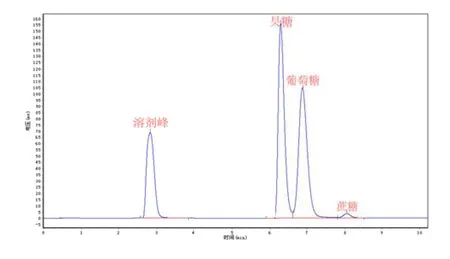
图13 第三次验证反应分离液的高效液相谱图

表4 第一次验证反应分离液的高效液相峰面积分结果

表5 第二次验证反应分离液的高效液相峰面积积分结果

表6 第三次验证反应分离液的高效液相峰面积积分结果
3 结论与展望
⑴通过优化试验,得到固定化蔗糖酶转化蔗糖最佳控制参数:酶用量 0.4%,反应温度 58.36℃,pH 5.13,底物浓度66.9%,反应时间12.82 h,并可应用到实际生产中酶解工序中。
⑵蔗糖源高果糖浆是专用标准糖浆,可根据用户的需要糖浆中各糖分含量的比例,通过控制转化反应参数加以实现,企业可从传统产品统一标准生产方式转向定制式生产模式。
⑶实际生产中所考虑的最主要因素之一是经济效益,按生产工艺过滤、灭菌、浓缩等重要工序,初步制得固形物为70%的成品,按白砂糖价格6000元/t计算,把能源费、人工费、包装费等费用计算在内,测算直接生产成本约5400元/t,而淀粉源高果糖浆的市场价格在3000元/t左右。为蔗糖源高果糖浆产品赢得市场竞争,把蔗糖源高果糖浆进一步升级,与其它食品配料因子复配成各类调味糖浆、调甜糖浆、专用糖浆等,另外,从原料上可以选用冰糖母液、制高纯度低聚果糖副产物、甘蔗汁等为原料,把蔗糖源高果糖浆的成本进一步降低,提高产品竞争力。
⑷生产工艺的各关键控制点进行研究分析,重点将是把各项工序中控制参数纳入研究分析体系,然后选择合适分析方法,获得制备蔗糖源高果糖浆最高经济收益的全部生产工艺参数。
