大豆动物蛋白混合体系功能性质研究进展
2020-11-18王旭峰王宇琦罗凯云福州大学生物科学与工程学院福建福州350000湖南农业大学食品科技学院湖南长沙40000
王旭峰,王宇琦,罗凯云(. 福州大学生物科学与工程学院,福建福州 350000;2.湖南农业大学食品科技学院,湖南长沙 40000)
蛋白质是食品的主要成分之一,具有较高的营养价值,能够提供人体蛋白质合成(如激素、酶、抗体等)所需的基础氨基酸[1]。此外,食物蛋白质良好的功能特性也使得它们被广泛应用于食品加工领域,赋予产品多种期望的品质和功能性质,如食品的质地、外观、口感及味道,以及产品的储藏(如货架期、适口性)和加工特性(如泡沫、乳液或凝胶的形成)等[2]。根据来源的不同,食物蛋白可以分为两类:动物蛋白和植物蛋白。其中,乳、蛋、肉和海鲜等是动物蛋白的主要来源,如牛奶蛋白、鸡蛋蛋白、肉蛋白等;而植物蛋白主要来源于豆类、米面和坚果,常见的有大豆蛋白、玉米蛋白、小麦蛋白、大米蛋白等[3]。据预计,到2050年,全球人口将达到95亿左右,在此期间人类对动物蛋白的需求将翻一番,与植物蛋白不同,动物蛋白生产对养殖面积的需求及温室气体的排放会增加环境压力[4]。联合国粮农组织的报告也强调了动物蛋白质消费的增加对于资源和环境可持续发展及粮食安全来说是一颗定时炸弹[3-5]。因此,在食物配方中利用植物蛋白部分替代动物蛋白越来越受到人们的关注,在降低生产成本的同时也能够带给产品一些独特的功能特性,如凝胶性、起泡性及乳化性等[6-11]。
在植物蛋白中,大豆蛋白是目前研究最多、最易获得的植物蛋白之一。大豆蛋白是一种完全蛋白质,其必需氨基酸组成符合人体推荐模式,可以满足人体各阶段对蛋白质的需求,营养价值较高[12-13],因此常被用作传统动物蛋白的部分替代物[14-17]。混合蛋白产品中含有大豆蛋白的典型例子包括营养饮料、酸奶、咖啡奶油、植脂奶油、婴幼儿配方等[18-22]。我国《国民营养计划(2017-2030年)》也强调将植物蛋白(大豆蛋白)与动物蛋白(牛奶蛋白)相结合,发展“中国特色双蛋白工程”,在全民中推广以“优质植物蛋白为主,优质动物蛋白为辅”的优质双蛋白食品,满足全面营养补充蛋白质的健康需求[23]。然而,目前利用植物蛋白替代动物蛋白仍然存在一定的挑战,有报道指出植物蛋白的添加对产品的机械和感官性能产生了负面影响,如凝胶硬度和粘弹性的降低[3,20]。因此,研究动植物蛋白相互作用的机理及混合蛋白体系功能性质对于食品工业的发展具有重要意义。本文重点综述了大豆蛋白与常见动物源蛋白混合体系的研究现状和进展,以期为大豆蛋白在替代动物蛋白方面的研究和应用提供参考。
1 大豆-牛奶蛋白
牛奶蛋白主要由乳清蛋白和酪蛋白两种成分组成。在牛乳中,酪蛋白占总蛋白质含量的80%(约2.7 g/100 g),而其他20%则对应乳清蛋白(约0.6 g/100 g)[24]。大豆蛋白富含赖氨酸,但蛋氨酸是其限制性氨基酸,而牛奶蛋白中的乳清蛋白富含含硫氨基酸;大豆中的植物雌激素有助于减少乳腺癌和更年期症状;此外有报道指出向大豆酸奶中添加适量脱脂奶粉可以增强其储藏过程中异黄酮糖苷向生物活性形式的转化[25]。在运动营养功能方面,大豆蛋白与牛乳蛋白组成的双蛋白具有混合消化吸收效率,在外周血中必需氨基酸,尤其是支链氨基酸的维持上起重要作用,进而有效促进肌肉蛋白合成[26-27]。因此,大豆蛋白和牛奶蛋白的混合是一种营养上有利的组合[2],了解大豆蛋白与牛奶蛋白混合时的加工行为,如聚集、凝胶等,对混合蛋白产品的开发和利用尤为重要。大豆蛋白与牛奶蛋白的混合较为复杂,研究显示,利用热处理不同比例(0∶100到100∶0)脱脂乳粉和大豆浓缩蛋白混合溶液,当两者混合比例为70∶30时,聚集颗粒尺寸达最大,说明两种蛋白之间发生蛋白-蛋白相互作用[28];在酸化条件下(葡萄糖酸-δ-内酯),大豆蛋白的存在使得混合蛋白在较高pH下开始聚集[29]。同时,pH的降低会导致酪蛋白胶束中磷酸钙的释放,而溶液中钙的存在可能造成大豆蛋白的不稳定,加速蛋白的聚集[30]。然而,由于牛奶蛋白中各组分(乳清蛋白和酪蛋白)分子特性的差异,其与大豆蛋白混合后的聚集和凝胶等行为也不尽相同[31]。因此,为了深入理解大豆蛋白与牛奶蛋白各组分之间的共混及相互作用,本文分别对大豆-乳清蛋白和大豆-酪蛋白体系进行了进一步研究和探讨。
1.1 大豆-乳清蛋白
热处理条件下,大豆蛋白与乳清蛋白的混合能够发生共聚集,形成大豆-乳清蛋白复合物。Roesch等[16]在90 ℃下对1.4%的大豆-乳清蛋白混合物进行热处理,并对混合蛋白的可溶及不溶性聚集产物进行了分析,结果显示两种蛋白能够形成以共价结合(二硫键)为主、非共价相互作用为辅的复合聚集体,而复合聚集体的状态(可溶或不可溶)及组成随混合蛋白中乳清蛋白含量的改变而不同。当大豆蛋白比例较高时(70%),聚集产物以高分子量可溶性复合物为主;而高比例含量的乳清蛋白(70%)则导致不溶性聚集体的生成,此时聚集体主要由β-乳球蛋白(β-lg)、β-伴球蛋白(7S)以及球蛋白(11S)的碱性亚基组成。McCann等[19]在对热诱导大豆-乳清蛋白混合凝胶的研究中也证实了大豆蛋白组分(主要为7S的α和α′亚基)在热处理过程中能够与乳清蛋白发生相互作用,进而参与混合蛋白凝胶网络的形成。
大豆-乳清蛋白的混合凝胶行为与蛋白浓度、混合比例及蛋白原料特征等因素相关。在较低蛋白浓度下(如6%),加热纯大豆蛋白体系或低乳清蛋白比例的混合蛋白无法形成凝胶,而当乳清蛋白所占比例大于50%时,混合蛋白的凝胶行为与纯乳清蛋白体系无明显差异,说明对于大豆-乳清蛋白混合体系,乳清蛋白是促使蛋白初级凝胶网络结构形成的主要驱动组分,降低乳清蛋白含量会导致凝胶强度减弱,而大豆蛋白主要起颗粒填充作用,同时部分大豆蛋白和乳清蛋白之间的相互作用也会增加凝胶的弹性性能[19]。从混合蛋白凝胶的微观形态来看,凝胶结构主要受大豆蛋白和乳清蛋白的混合比例影响。Roesch等[16]发现0.1 mol/L NaCl存在下,6%浓度的单一乳清蛋白能够形成均匀的凝胶网络结构,利用少量大豆蛋白替代乳清蛋白(替代率≤30%)会导致大颗粒聚集体的形成,使凝胶变得更加粗糙。McCann等[19]研究也得到类似结果,提高混合蛋白体系中的乳清蛋白含量有利于凝胶网络由粗糙向均匀转变。然而,Jose等[20]则报道了在0.1 mol/L NaCl、总浓度为10%的大豆-乳清蛋白热诱导混合凝胶中,随着大豆蛋白含量的增加,凝胶弹性模量降低,但结构粗糙度得到显著改善,特别是当大豆蛋白所占比例由0提高到30%时,改善效果最为明显,凝胶的粗糙度从1.4 μm降低到0.17 μm。推测可能是混合蛋白总浓度在一定程度上影响大豆蛋白、乳清蛋白及混合体系的成胶行为,从而导致凝胶结构和模量的变化。
此外,蛋白原料的性质和对于大豆-乳清蛋白的凝胶行为也具有重要的影响,包括大豆蛋白的变性程度、聚集颗粒大小等,如商业大豆蛋白受制备过程影响,大部分大豆蛋白已经变性,形成了大的聚集颗粒,在与乳清蛋白混合和热处理过程中易发生相分离和相转化行为[32]。由于大豆蛋白和乳清蛋白分子量及理化性质(如疏水性)差异,当乳清蛋白浓度较低时,大豆蛋白形成连续相,包裹浓缩乳清蛋白组分。随着乳清蛋白含量增加至大豆-乳清蛋白比例为5∶1时,相分离程度最高,混合蛋白凝胶的模量值最小。继续增加乳清蛋白所占比例则会发生相转化,此时乳清蛋白成为连续相,形成凝胶结构,大豆蛋白分布在凝胶网络中(如图1)[14]。相对而言,利用未变性或实验室提取的大豆蛋白与乳清蛋白混合,未观察到两者的相分离现象[16,20]。因此,在混合大豆-乳清蛋白过程中,应避免或降低蛋白原料的变性和聚集程度,以提高混合蛋白产品的性能和品质。
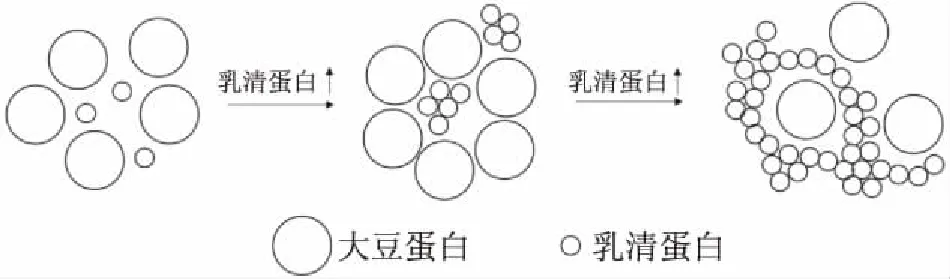
图1 大豆蛋白与乳清蛋白混合体系成胶机理示意图Fig.1 Schematic diagram of gelation mechanism of mixed soybean protein(SP)-whey protein(WP)
除了热聚集和凝胶行为,大豆-乳清混合蛋白体系的界面性质也得到了广泛研究。如崔强等[33]研究了超声处理对大豆-乳清混合蛋白的理化和功能特性的影响。结果表明,对比单一蛋白体系(大豆或乳清蛋白),混合蛋白(两种蛋白比例为1∶1)在超声功率为300 W时乳化活性与乳化稳定性分别达到最大值(76.46 m2/g和22.83 min)。王喜波等[34]得到了类似结果,等比混合的大豆-乳清蛋白体系乳化活性与乳化稳定性最大(65.5 m2/g,16.3 min),体积平均粒径 D[4,3]达到最小值(205.6 nm)、ζ-电位绝对值达到最大(21.4 mV),此时混合体系稳定性最好。Ho等[35]利用不同蛋白及其混合物稳定含番茄红素的乳液,结果显示相比于单一大豆或乳清蛋白,两者的混合(1∶1)具有界面协同效应,使得乳液表现出更好的番茄红素保留率,贮藏14天后仍达到80%以上。Pizones等[2]则对混合大豆球蛋白(11S、7S)-β乳球蛋白(β-lg)的体相、界面及起泡性质进行了更为细致的研究,发现中性条件下(pH7.0),7S和β-lg在水相中发生缔合相互作用,7S/β-lg协同效应显著增强了界面膜的弹性,同时7S/β-lg混合溶液形成的泡沫呈现出更密集、更小的气泡且具有优异的稳定性(图2)。11S和β-lg在pH7.0下没有显示出明显的相互作用,而pH3.0时表现出较强的拮抗作用。以上表明,大豆蛋白和乳清蛋白在一定条件下混合对蛋白界面性质表现出协同作用,通过合理控制两种蛋白的混合比例或混合组分,能够有效提高蛋白的界面活性和稳定性,增强混合蛋白在食品中的应用效果。

图2 β-lg、7S+β-lg(1∶1)和7S稳定泡沫中气泡大小随时间变化情况Fig.2 Evolution of bubble size with time in β-lg,7S+β-lg(1∶1)and 7S stabilized foam
1.2 大豆-酪蛋白
在食品工业中,胶束酪蛋白主要用作营养强化剂、增稠剂以及泡沫稳定剂[36]。酪蛋白具有很好的热稳定性,在正常牛奶pH及离子环境下,温度高于140 ℃时才会发生自聚集[37],但对金属螯合剂(如EDTA、某些蛋白等)、钙盐等比较敏感,容易引起解离或沉淀[38-39]。虽然有研究表明,大豆蛋白与酪蛋白混合加热过程中没有发生相互作用[40],但利用大豆蛋白替代部分酪蛋白能够显著提高体系的临界凝胶温度(Tc),且提高效果随着大豆蛋白替代量的增加而增强,这可能是由于大豆蛋白与体系中的Ca2+结合,而 Ca2+的消耗减少了有效桥接的酪蛋白数量,导致Tc的急剧上升[8,41-42]。Beliciu等[22]指出酪蛋白的存在对分子流动性具有一定的限制作用,从而影响大豆球蛋白在热处理下的展开,提高大豆蛋白热稳定性。当蛋白总浓度大于7.5%时,大豆-酪蛋白混合物的结构和流变行为受大豆蛋白变性和浓度的控制。80 ℃以上加热7.5%~12.5%的混合蛋白体系,酪蛋白和展开的大豆蛋白分子之间发生局部相分离。Silva等[8]研究发现在加热过程中,大豆蛋白与酪蛋白未发生共聚集,每种蛋白质都独立形成凝胶网络。对于固定酪蛋白浓度(6%),低浓度大豆蛋白(<2%)的添加对混合凝胶的强度没有显著影响,而高浓度大豆蛋白的作用取决于pH,在pH5.6和5.8时能够增加凝胶的模量,而pH6.0时结果相反。另一方面,在总浓度6%条件下,热诱导大豆-酪蛋白混合凝胶强度主要由体系中含量较高的蛋白形成的网络决定,且模量均比单一蛋白形成的凝胶的低。Grygorczyk等[43]报道指出,酪蛋白和大豆蛋白混合凝胶受两者聚集顺序影响,若酪蛋白比大豆蛋白先变性聚集,大豆蛋白聚集体则作为填充颗粒被包裹在酪蛋白凝胶网络之中,导致最终混合凝胶结构均匀性较差;若同时聚集,两种蛋白可以均匀分布在整个凝胶网络之中。因此,通过温度等条件控制酪蛋白和大豆蛋白的聚集顺序,可以改变凝胶结构并影响其质地特性。
2 大豆-肌原纤维蛋白
大豆蛋白被广泛应用于肉制品中的加工和生产,如香肠、鱼丸、鱼糜等[44-45],合理使用能够提高产品的产量和质地,改善肉制品的乳化稳定性和热诱导凝胶特性[46]。肌原纤维蛋白是肌肉蛋白中的重要组成部分,天然大豆蛋白与肌球蛋白之间没有相互作用,只有当温度达到85 ℃以上时,肌球蛋白重链才会与解离11S的B亚基发生缔合,而A亚基却极少或没有参与肌球蛋白反应,大豆蛋白中7S组分在50~100 ℃之间能够抑制肌球蛋白的聚集[47]。天然大豆蛋白直接加入肉糜类制品中会降低肉糜的凝胶特性,这是由于肌原纤维蛋白变性温度低于大豆蛋白,加热过程中肌原纤维蛋白先凝胶,未变性的大豆蛋白会夺取肌肉中的水分,从而造成蛋白凝胶结构疏松,弹性较差等问题,但经过预热处理的大豆蛋白能够显著提高混合凝胶的储能模量[46]。Wu等[48]对大豆蛋白和鳕鱼蛋白混合凝胶进行了研究,发现在热处理过程中,大豆蛋白和鳕鱼蛋白混合体系形成的是一种“自分类”凝胶网络。同时,在较高的鳕鱼蛋白比例下形成的网络多孔、均匀性较差,但具有更高的储能模量;利用大豆蛋白分级组分(11S和7S)部分替代水溶性鳕鱼蛋白,研究了11S/7S比例对混合体系的热聚集和凝胶行为的影响,结果显示11S比例越高,凝胶的储能模量越高,但同时由于大颗粒聚集体的生成,导致了凝胶网络中的微相分离,引起多孔结构的形成。
此外,大豆蛋白聚集体的溶解性也是影响大豆-肌原纤维蛋白混合体系凝胶性质的重要因素,通过大豆蛋白可溶与不溶性聚集体对猪肌原纤维蛋白凝胶影响的研究,发现可溶性大豆蛋白聚集体可以降低大豆-肌原纤维蛋白复合凝胶的随机结构,极大地改善(P<0.05)凝胶的弹性模量和持水率,但对凝胶硬度没有显著影响;相对而言,不溶性大豆蛋白聚集体主要以颗粒填充的形式分布在猪肌原纤维蛋白形成的连续凝胶网络之中,从而在一定程度上增强凝胶性质[49]。另一方面,大豆蛋白的水解也对大豆-肌原纤维蛋白混合体系的功能性质有重要影响,Feng等[50]研究发现大豆蛋白的水解增强了它与肌原纤维蛋白之间的相互作用,导致两种蛋白的热稳定性降低。同时,与未水解的大豆蛋白相比,碱性蛋白酶水解大豆蛋白产物能够改进凝胶的粘弹性和硬度,而风味蛋白酶水解大豆蛋白产物则对凝胶产生不利影响。从已有的研究可以发现,大豆蛋白与肌原纤维蛋白的混合及其凝胶行为与大豆蛋白的变性、组成、聚集体性质、水解等因素具有显著相关性,现实加工中,可以根据具体情况,通过不同方式对大豆蛋白进行处理,如加热、酸化、改性等[46,51-53],以达到改善肉制品品质的目的。
3 大豆-胶原蛋白/明胶
目前关于大豆蛋白与胶原蛋白/明胶混合行为的研究主要集中在成胶和成膜性两个方面。大豆蛋白与胶原蛋白/明胶的凝胶行为与其他混合球蛋白的不同。一般来说,加热使球蛋白成胶,而胶原蛋白/明胶恰恰相反,凝胶发生在冷却过程中,加热使凝胶融化。因此大豆-胶原蛋白/明胶的凝胶过程是大豆蛋白在加热过程中先凝胶,然后冷却使明胶凝胶化到球蛋白凝胶网络之中[32]。有研究也证实了大豆蛋白与明胶混合物中两种成分分别形成了独立的网络结构,混合凝胶的强度也随凝胶进程及温度变化而改变。加热过程中,大豆蛋白形成较弱的凝胶,低温下明胶的凝固加强了网络结构,相比于单一大豆蛋白凝胶,混合凝胶的弹性模量明显提升。当重新加热时,明胶凝胶融化,凝胶强度又重新降低直至与大豆蛋白凝胶保持一致[15]。Ersch等[54]通过研究6%总浓度下大豆蛋白与明胶混合行为(pH7,150 mmol/L NaCl)时发现,在溶液状态下两种蛋白组分混合没有发生相分离现象,然而在明胶凝胶过程中(冷却阶段)观察到两者发生了相分离,相对浓缩了局部的明胶浓度,导致形成的混合凝胶模量明显高于单一明胶凝胶。Oechsle等[55]则对原始大豆蛋白(1.25%)和胶原蛋白(2.8%)的共凝胶行为进行了研究,在pH3.0下大豆球蛋白能够均匀分布在胶原网络之中,与胶原蛋白形成一种“混合交织”网络,增加凝胶的储能模量(图3)。
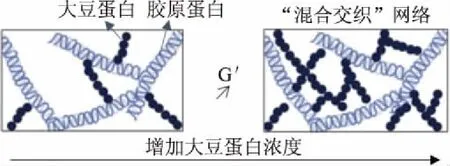
图3 大豆蛋白影响胶原蛋白凝胶储能模量示意Fig.3 Effect of soy protein on storage modulus of collagen gel
成膜性是蛋白的另一个重要性质,可以用来制造可食用膜,进而作为包装材料用于食品和制药领域。然而大豆蛋白有轻微豆腥味,其薄膜脆且具有相对较差的机械性能。明胶具有优异的成膜性和良好的力学性能,但成本较高。近年来,研究大豆蛋白-明胶复合膜性质受到广泛关注[56-58]。研究显示,相比于纯明胶薄膜,大豆蛋白-明胶复合薄膜的厚度和水蒸气渗透性显著降低。含有25%大豆蛋白和75%鳕鱼皮明胶的复合膜屈服力达到最大,分别比100%明胶膜及100%大豆蛋白膜高1.8和2.8倍,这可能是由于展开的明胶分子链与大豆球蛋白之间的某种程度的交联引起的[59],进一步红外光谱研究结果显示明胶与大豆蛋白分子间通过C=O键相互作用。Cao等[56]报道通过增加B型牛明胶复合膜中大豆蛋白的比例,其抗张强度,断裂伸长率,弹性模量,溶胀能力和透明度降低。然而,少量的大豆蛋白(与明胶的比例在4∶6~2∶8范围内)并没有显着影响薄膜的性能,但降低了生产成本。大豆蛋白和明胶中的氨基与羧基之间的相互作用可能是复合膜机械性能得到改善的原因,且氢键是引起这些相互作用的主要机理。Guerrero等[60]的研究也得到相似结果,同时指出复合膜性质受明胶种类的影响,其中牛明胶效果最为明显。利用大豆蛋白部分替代牛胶原蛋白而获得较弱的膜,也被认为是调节香肠感官特性(如耐咀嚼性)的一种可行的替代方法[61]。
4 展望
随着人们对健康饮食的逐渐重视,植物蛋白在食品加工中的应用受到广泛关注。利用植物蛋白,特别是大豆蛋白部分替代动物蛋白,不仅能够优化国民的膳食结构,改善居民膳食营养与健康,同时可以避免动物蛋白的过度消耗对可持续发展造成不利影响以及降低生产成本。在此背景下寻求混合蛋白体系在功能性质上的协同效应对于食品品质的改善具有重要意义。本文涵盖了目前关于大豆蛋白与常见动物蛋白(牛奶蛋白、肌肉蛋白和胶原蛋白)共混体系行为和性质的一些主要研究,对混合蛋白的聚集、凝胶、界面等行为及其影响因素进行了综述,并由此可见通过合理控制混合蛋白的参数,如蛋白浓度、混合比例、蛋白组分、加工条件等,大豆蛋白与动物蛋白的混合具有协同效应,在一定程度上增强混合蛋白功能性质的同时,降低生产成本,可以为大豆-动物混合蛋白在食品加工中的应用提供参考。然而,目前利用大豆蛋白替代动物蛋白仍然存在一些问题,如a.商业大豆蛋白在制备和储藏过程中的变性和聚集会对混合蛋白体系的行为产生不利影响,引起相分离、凝胶结构粗糙等问题,研究如何降低大豆蛋白的聚集程度是解决上述问题的关键,可以考虑通过向大豆蛋白中加入还原剂(Na2SO3、半胱氨酸等)、分散剂以及采用超声等技术来降低大豆蛋白的聚集和颗粒尺寸,增强其在溶液中的分散性;b.现有研究主要通过热处理诱导蛋白分子结构发生变化,进而研究混合蛋白分子间的相互作用,从而影响蛋白的混合行为。而在此基础上,通过一些新兴技术的应用,如超声、微波、(超)高压、微射流、酶交联等,也是实现大豆-动物混合蛋白体系功能性质改善的重要研究方向和目标;c.大豆-动物混合蛋白体系的建立不仅能够降低生产成本,获得更佳的功能性质,同时有利于实现营养的互补和均衡。因此,区别于单一蛋白体系,动植物蛋白混合系统在人体摄入后的消化、吸收等行为及其对机体的健康效应仍需进一步的研究和评估,这对于开发具有高生物学和营养价值的产品十分关键。综上,大豆蛋白与动物蛋白混合体系的研究是一个前景广阔且不断发展的科学领域,充分利用动、植物不同蛋白之间的分子结构和性质差异,通过合理控制混合条件,可以达到有效改善混合蛋白的功能性质和营养特性的目的,从而为高品质健康食品的加工生产提供新思路和技术保障。
