芡实皮渣多糖的提取工艺优化及体外抗氧化活性研究
2020-11-18何小宁陈志宏何晓伟赵维萍朱国美查明方滁州学院生物与食品工程学院安徽滁州29000安徽大学现代生物制造协同创新中心安徽合肥2060滁州市农业农村技术推广中心安徽滁州29000
刘 洋,张 汆,何小宁,陈志宏,何晓伟,赵维萍,,朱国美,查明方(.滁州学院生物与食品工程学院,安徽滁州 29000;2.安徽大学,现代生物制造协同创新中心,安徽合肥 2060;.滁州市农业农村技术推广中心,安徽滁州 29000)
芡实(Euryaleferox)又名鸡头莲,为一年生水生草本植物,属于睡莲科[1]。芡实是一种珍贵药食兼用作物,有刺芡(北芡)和苏芡(南芡)两个品种[2]。芡实营养丰富,如芡实米中富含淀粉、蛋白质、维生素、矿物元素以及少量的脂类物质[3],还含有多糖、多酚类等活性成分[4]。芡实皮渣是芡实加工过程中产生的主要副产物,易腐烂,不易保存,一直是做为废弃物被丢弃。按照目前全国芡实米年产约10万吨进行估算,预计可产生的芡实皮渣约为20~30万吨,这不仅是对资源的浪费,也会对环境造成一定的污染。
多糖存在于很多植物原料中,具有一定的生理活性或保健功能,其良好的抗氧化性使其在医药、化妆品方面有着极大的市场[5]。近年来,许多学者从芡实种仁中进行了多糖的提取、纯化与抗氧化活性等方面的研究[6-7]。目前芡实来源的多糖研究主要针对的是芡实种仁,而对于芡实皮渣中多糖的提取、理化性质和抗氧化活性方面的研究则未有报道。
本实验通过研究芡实皮渣的干燥曲线,确定其最佳干燥条件,延长其贮藏期,并以干燥后的芡实皮渣为原料,使用热水浸提醇沉法提取多糖。通过单因素实验和正交试验确定多糖提取最佳工艺,同时测定多糖的理化性质、凝胶特性,利用高效液相色谱法(High Performance Liquid Chromatography,HPLC)对多糖水解产物进行分析。在此基础上,以多糖的总还原力以及对羟基自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧离子和亚硝酸盐的消除率作为评价指标,评估多糖的体外抗氧化活性,研究结果可为芡实皮渣的综合利用、多糖的制备及其在食品等领域的应用奠定基础。
1 材料与方法
1.1 材料与仪器
芡实新鲜果实 于2018年9月采于滁州市琅琊区秋桐村芡实种植试验田;苯酚、无水乙醇、浓硫酸、硫酸钾、硫酸铜、甲基红、溴甲酚绿、碳酸钠、硼酸、氢氧化钠、盐酸、葡萄糖标准品、铁氰化钾、三氯化铁、抗坏血酸等 分析纯,国药集团上海化学试剂有限公司。
CP224S型分析天平 德国Sartorius公司;L500型离心机 湖南湘仪实验室仪器开发有限公司;HH-4型恒温水浴锅 金坛市杰瑞尔电器有限公司;DHS16-A型水分测定仪 上海天美天平仪器有限公司;L3S型分光光度计 上海仪电分析仪器有限公司;TA. XTplus物性测试仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 原料预处理 取新鲜芡实果,手工剥开外表皮,获取芡实皮渣,装入塑料自封袋内,4 ℃冰箱中贮藏,备用。
1.2.2 芡实皮渣干燥曲线的绘制 取芡实皮渣解冻,称取12份芡实皮渣置于恒重铝盒中,每份称取10 g。样品从1~12编号,置于烘箱进行干燥,分别于0.5、1、1.5、2、3、4、5、6、7、8、9、10 h取出并称重,再将样品干燥至恒重,计算剩余含水率。分别研究计算40、50、60、70、80 ℃温度条件下不同干燥时间的失水率和干燥速率[8],通过绘制失水率-时间曲线和干燥速率-时间的曲线,获取最佳干燥温度和时间。
1.2.3 芡实皮渣多糖提取工艺流程 芡实皮渣的干燥和粉碎→粉末过60目筛→加热浸提(搅拌)→离心分离(5000 r/min,5 min)→醇沉→离心分离(5000 r/min,5 min)→溶解→真空冷冻干燥→芡实皮渣多糖
1.2.4 芡实皮渣多糖含量和纯度测定
1.2.4.1 标准曲线绘制 采用苯酚-硫酸法[9],在波长 490 nm处测定吸光度,以吸光度为纵坐标,葡萄糖含量为横坐标绘制标准曲线。
1.2.4.2 多糖得率和纯度测定 取5.0 mL多糖提取液,于100 mL容量瓶中定容,取稀释液1.0 mL于比色管中,加入蒸馏水1.0 mL,6%苯酚溶液1.0 mL,浓硫酸5.0 mL后摇匀,以2.0 mL水作为空白对照液,在沸水浴中恒温30 min,取出冷却15 min后,在波长490 nm处测定吸光度,根据葡萄糖标准曲线,计算多糖得率与纯度[9]。

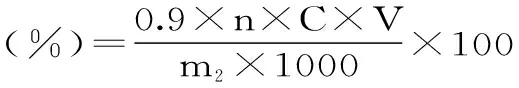
式中:0.9为葡萄糖转化为多糖的转化因子;n为稀释倍数;C为提取液中葡萄糖浓度(mg/mL);V为提取液总体积(mL);m1为原料的质量(g);m2为粗多糖的质量(g)。
1.2.5 单因素实验 以多糖得率为指标,分别考察5个提取工艺参数对得率的影响。主要因素有料液比、醇沉浓度、浸提温度、浸提时间、浸提次数。
1.2.5.1 料液比 称取0.5 g芡果实皮渣粉,按照不同的料液比1∶10、1∶20、1∶30、1∶40、1∶50 (g∶mL)加入蒸馏水,浸提温度40 ℃,醇沉浓度80%,浸提时间30 min,提取3次,考察料液比对芡果实皮渣多糖得率的影响。
1.2.5.2 醇沉浓度 称取0.5 g芡果实皮渣粉,按料液比1∶30 (g∶mL)加入蒸馏水,浸提温度40 ℃,浸提时间30 min,提取3次,分别设定不同的醇沉浓度(70%、75%、80%、85%、90%),考察醇沉浓度对芡果实皮渣多糖得率的影响。
1.2.5.3 浸提温度 称取0.5 g芡果实皮渣粉,按料液比1∶30 (g∶mL)加入蒸馏水,醇沉浓度80%,提取时间30 min,提取3次,分别设定不同的浸提温度(30、40、50、60、70 ℃),考察浸提温度对芡果实皮渣多糖得率的影响。
1.2.5.4 浸提时间 称取0.5 g芡果实皮渣粉,按料液比1∶30 (g∶mL)加入蒸馏水,设定浸提温度60 ℃,醇沉浓度80%,提取3次,分别设定不同的浸提时间(10、20、30、40、50 min),考察浸提时间对芡果实皮渣多糖得率的影响。
1.2.5.5 浸提次数 称取0.5 g芡果实皮渣粉,按料液比1∶30 (g∶mL)加入蒸馏水,浸提温度60 ℃,醇沉浓度80%,浸提时间30 min,分别设定不同的浸提次数(1、2、3、4、5次),考察浸提次数对芡果实皮渣多糖得率的影响。
1.2.6 正交试验 根据单因素实验结果选取料液比、浸提温度、浸提时间、醇沉浓度四个因素,进行L9(34)正交试验表的设计,优化多糖提取条件,实验设计见表1。
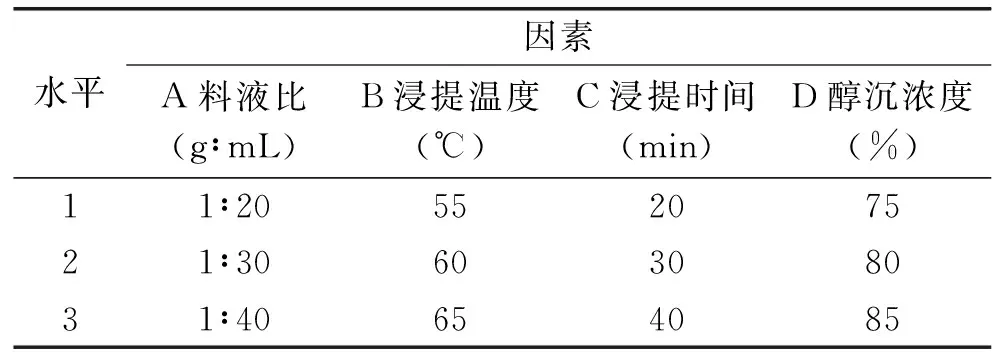
表1 因素水平设计L9(34)Table 1 Factors and levels of orthogonal experiment L9(34)
1.2.7 理化指标检测
1.2.7.1 色差 通过色差计对芡实皮渣多糖的L*、a*、b*值进行检测。
1.2.7.2 水分 参照GB 5009.3-2016《食品中水分的测定》。
1.2.7.3 吸水性 称取0.5 g多糖于离心管中,加入40 mL蒸馏水,充分混合,摇匀称重。室温下放置30 min,每间隔5 min振荡1次,共振荡3次。离心(4000 r/min,10 min)弃上清液,将离心管倒置5 min沥干水后称重。吸水指数计算公式:
式中:E-吸水指数(g/g);m-指的是样品质量(g);m1-离心后离心管(含吸水后的样品)质量(g);m2-离心管质量(g)[10]。
1.2.7.4 吸油性 称取0.5 g多糖于离心管中,加入20 mL植物油,摇匀称重。室温下放置30 min,每间隔5 min振荡1次,共振荡3次。离心(4000 r/min,10 min)弃去上层油脂,将离心管倒置5 min沥干剩余植物油后称重。吸油指数计算公式:
式中:W-吸油指数(g/g);m-样品质量(g);m3-离心后离心管(包含吸油后的样品)质量(g);m4-离心管质量(g)[10]。
1.2.7.5 碘-碘化钾反应 制备2%的碘-碘化钾溶液,向溶液中滴加浓度为1 mg/mL的芡实皮渣多糖溶液,以淀粉作为对照,观察溶液是否变蓝,判断多糖中是否存在淀粉[11]。
1.2.7.6 水解性及其水解产物测定 利用乙酸锌和亚铁氰化钾对多糖溶液进行除蛋白处理,然后用酸水解,水解结束后用碱液中和,取水解液进行衍生化,衍生化试剂选择PMP甲醇溶液。同时取葡萄糖、甘露糖、半乳糖、阿拉伯糖、岩藻糖、鼠李糖、木糖配制成标准溶液,进行衍生化[12]。采用高效液相色谱(HPLC)进行检测,使用二极管阵列检测器(DAD),检测条件为波长250 nm,带宽4 nm,温度30 ℃,进样量10 μL,流动相为乙腈与KH2PO4,设定流速1 mL/min,通过样品峰的保留时间与标准单糖峰的保留时间作对比,确定多糖组分类别。
1.2.8 多糖凝胶质构特性检测
1.2.8.1 黏度特性 配制5~30 mg/mL浓度的多糖溶液,在室温下检测多糖浓度和黏度的关系。采用黏度计4号转子,转速60 r/min,黏度单位Pa·s。
1.2.8.2 凝胶质构特性 配制10、20、30、40、50 mg/mL的多糖溶液,观察凝胶形成的最佳浓度。以凝胶形成浓度配制一定量凝胶,置于4 ℃下冰箱中冷藏,采用物性测试仪对凝胶进行检测,选用TPA模式,p36r探头,测试距离为50%(样品厚度百分数),测试速度:3 mm/s[13]。
1.2.9 芡实皮渣多糖的体外抗氧化活性检测
1.2.9.1 总还原力能力的测定 取1 mL不同浓度芡实皮渣多糖溶液于10 mL试管中,加入0.2 mol/L磷酸盐缓冲液(pH6.6)2.5 mL和1.0%的K3Fe(CN)6溶液2.5 mL,50 ℃水浴20 min,冷却后加入10%三氯乙酸溶液1 mL,3000 r/min离心10 min,取上清液2.5 mL,加入0.1% FeCl3溶液0.5 mL和蒸馏水2 mL,静置5 min后测定700 nm处的吸光值,以相同方法测定抗坏血酸VC的吸光值作对照[14]。
1.2.9.2 对羟自由基(·OH)清除能力的测定 分别吸取6 mmol/L FeSO4溶液、6 mmol/L H2O2溶液和6 mmol/L水杨酸溶液各2 mL加入10 mL试管中,然后加入1 mL不同浓度的芡实皮渣多糖溶液,37 ℃条件下水浴15 min后冷却,在510 nm测定吸光值A1,以蒸馏水代替芡实皮渣多糖溶液测定吸光值A0,同时以相同方法测定抗坏血酸VC的吸光值作对照[14-15]。计算芡实皮渣多糖对·OH的清除率:
1.2.9.3 对1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定 配制0.1 mmol/L的DPPH溶液(无水乙醇为溶剂),移取1 mL不同浓度芡实皮渣多糖溶液于10 mL试管中,依次加入2 mL蒸馏水和2 mL DPPH溶液,摇匀后室温放置20 min,517 nm下测吸光值A1,以无水乙醇代替DPPH溶液后测定吸光值A2,以去离子水代替芡实皮渣多糖溶液测定吸光值A0,同时以相同方法测定抗坏血酸VC的吸光值作对照[14,16]。计算芡实多糖对DPPH的清除率:
1.2.9.5 对亚硝酸盐清除能力的测定 吸取5 μg/mL亚硝酸钠标准液2 mL和一定量的芡实皮渣多糖溶液、混合均匀,依次加入0.4%对氨基苯磺酸溶液2 mL和0.2%盐酸萘乙二胺溶液1 mL,静止15 min后定容至50 mL,测定538 nm处的吸光值A1。同时以蒸馏水代替亚硝酸钠标准液测定的吸光值记为A2,用蒸馏水代替多糖溶液作为空白,其吸光值记为A0。同时以相同方法测定抗坏血酸VC的吸光值作对照[17]。计算芡实皮渣多糖对亚硝酸盐清除率:
1.3 数据处理
每个实验数据均独立重复3次,取平均值,且每次独立实验均设置3组平行;数据统计采用Excel 2016软件,图表绘制采用Origin 2017软件,。
2 结果与分析
2.1 干燥曲线的绘制
新鲜的芡实皮渣不宜保存,干燥不仅可以缩小芡实皮渣的体积,节省保藏空间,同时也可利于长时间保藏。热风干燥是一种常用的干燥方式,是以热空气为加热介质,通过对流传导等加热方式,以脱除物料水分的干燥技术[18]。通过干燥曲线的绘制,可以找到合适的干燥温度及时间,在保证干燥速率的同时节省干燥成本。如图1所示,干燥前期,芡实皮渣的失水率迅速升高,一定时间后达到缓升期(即失水率缓慢升高的时间,h)。随着温度的升高,失水率到达缓升期的时间逐渐减少。50 ℃条件下,芡实皮渣失水率到达缓升期的时间为4 h,此时失水率为88.82%,失水速率为1.54 g/(g·h),水分含量在14%以下,可以长期储存。由于干燥过程中会发生美拉德反应,出现褐变等不良现象,干燥温度越高,产生不良现象越明显;干燥不充分也会导致产品发生霉变,影响产品品质[19],综合考虑干燥温度和时间对干燥能耗成本的影响,将干燥的最佳条件选择为50 ℃,干燥4 h。
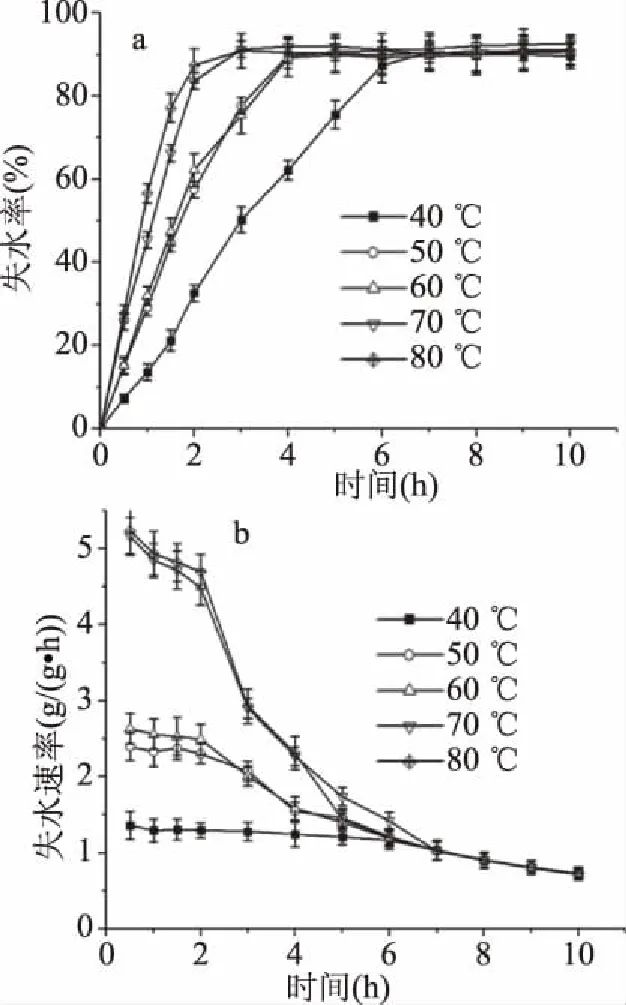
图1 不同温度下芡实皮渣的干燥曲线Fig.1 Drying curve of the pomace ofEuryale ferox pericarp residue at different temperatures 注:a.失水率-时间曲线;b.失水速率-时间曲线。
2.2 标准曲线的绘制
如图2所示,以葡萄糖浓度为横坐标(X),吸光值为纵坐标(Y),进行线性回归,得到的标准曲线对应方程为Y=0.0079X-0.0005,R2=0.9962,在0~100 μg/mL内线性良好。

图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.3 单因素实验结果
如图3a所示,料液比为1∶10时得率最小,为26.23%,料液比为1∶40时得率最高,为27.78%,总体来看料液比对多糖得率的影响变化幅度不明显;如图3b所示,随着醇沉浓度的升高,多糖得率不断增加,在醇沉为80%时得率达31.92%,随着醇沉浓度的继续升高,提取率升高幅度也不明显;如图3c所示,随着浸提温度的提升,多糖得率不断升高,60 ℃时得率可达31.57%,若浸提温度过高可能会使部分多糖的活性降低;如图3d所示,随着浸提时间的增加,多糖得率不断提高,当浸提时间达到40 min时,得率最高,为41.32%;如图3e所示,随着浸提次数的增加,多糖得率不断提高,当浸提次数为3次时,多糖得率最高可达40.33%。因此料液比选择1∶20、1∶30、1∶40 (g∶mL),浸提温度选择55、60、65 ℃,浸提时间选择26、30、40 min,醇沉浓度选择75%、80%、85%作为正交实验的水平。

图3 单因素水平对多糖得率的影响Fig.3 Effect of single factor level on the polysaccharide yield注:a.料液比;b.醇沉浓度;c.浸提温度;d.浸提时间;e.浸提次数。
2.4 正交试验结果
在单因素实验结果的基础上,设计L9(34)正交试验优化多糖提取工艺条件。试验设计及试验结果见表2。

表2 正交试验结果Table 2 Results of orthogonal experiment
由表2可以看出,各因素对芡实皮渣多糖得率的影响次序为C>A>B>D,即浸提时间对多糖得率的影响最大,醇沉浓度对多糖得率的影响最小。各因素的最优水平为A3B1C3D2,即料液比1∶40、浸提温度55 ℃、浸提时间40 min、醇沉浓度80%,由于这一试验组合在正交表中7号,且为得率最高,证明该工艺为最佳提取条件。
2.5 理化指标检测结果分析
2.5.1 理化性质 从表3可以看出,多糖的颜色偏暗,色泽偏向红黄,提取的芡实皮渣多糖纯度可达82.67%,具有很强的吸水性和吸油性,吸水和吸油指数分别为(65.15±1.52)和(1.27±0.04) g/g。

表3 多糖的理化性质Table 3 Physicochemical properties of polysaccharide
2.5.2 碘-碘化钾反应结果 芡实皮渣多糖的类别通过碘-碘化钾反应检测,结果未有蓝色反应发生,判断芡实皮渣多糖为非淀粉类多糖。已有的研究表明,非淀粉类多糖(nonstarch polysaccharides,NSP)是由一系列理化性质和生理功能不同的组分组成,具有降胆固醇、降血脂、防心血管疾病和增强免疫力等生理功效[20-21]。
2.5.3 多糖水解产物分析 通过HPLC分析芡实皮渣多糖的水解产物,结果如图4所示,水解产物仅有一个较为明显的峰,根据对照组单糖出峰时间,确定芡实皮渣多糖是由单一组分葡萄糖组成。芡实皮渣多糖的组成和芡实多糖的组成有所差异,陈蓉等对芡实多糖理化性质进行了相关研究,结果显示芡实多糖的单糖组成为葡萄糖和鼠李糖[22]。
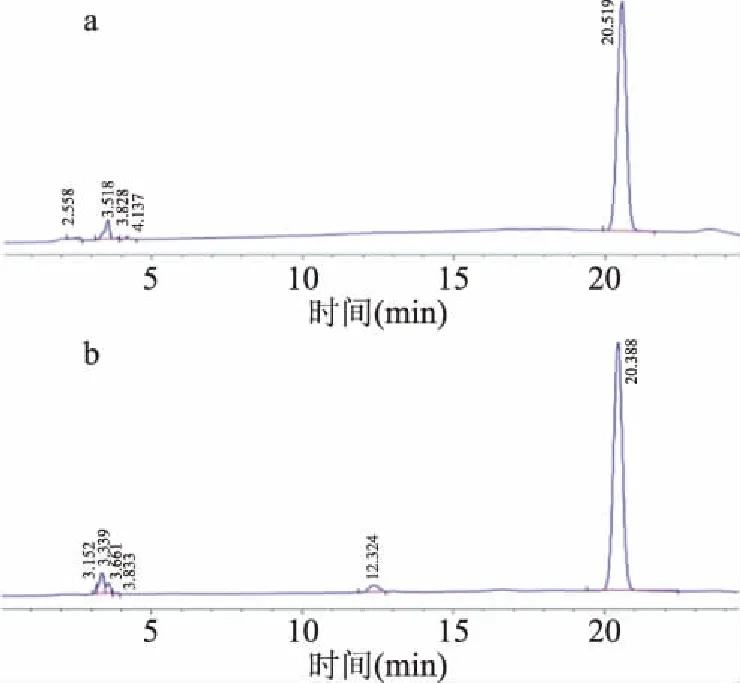
图4 多糖水解产物的HPLC检测图Fig.4 HPLC detection chart of polysaccharide hydrolysate注:a.水解产物;b.葡萄糖标准品。
2.5.4 多糖凝胶及其质构特性 如图5所示,芡实皮渣多糖的黏度随着浓度的增加而增加。随着多糖浓度的增大,多糖溶液逐渐形成了凝胶。当浓度为10 mg/mL时,溶液很黏,但仍是溶液状态;在20 mg/mL的浓度时,溶液黏度继续增加,但仍未有凝胶形成;当浓度增到30 mg/mL,多糖溶液无法流动,紧紧的吸附在离心管壁上,形成了凝胶。30 mg/mL的芡实皮渣多糖凝胶质构特性结果如表4所示,多糖凝胶的粘性很大,弹性较低,回复能力弱。

表4 多糖凝胶的质构特性Table 4 Gel texture characteristics of polysaccharide

图5 多糖浓度与黏度的关系Fig.5 Relationship between polysaccharide concentration and viscosity
2.6 抗氧化活性分析
2.6.1 总还原力 抗氧化剂的还原力与其抗氧化性之间存在一定的关系,抗氧化剂是通过自身的还原作用给出电子而清除自由基,还原力越强,抗氧化性越强。因此,可通过测定还原力来说明其抗氧化活性的大小[23]。如图6所示,芡实皮渣多糖和抗坏血酸VC的还原能力均随着浓度的增加而增加,同等条件下,芡实皮渣多糖的总还原力要低于抗坏血酸VC。
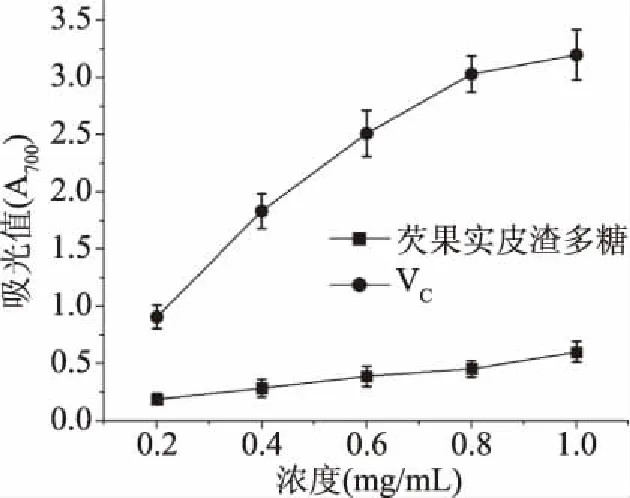
图6 多糖的总还原力Fig.6 Total reducing power of polysaccharides
2.6.2 对羟基自由基、DPPH自由基、超氧离子和亚硝酸盐的清除能力 自由基是人体某些疾病和衰老发生的重要原因,当人体内自由基产生过多或清除过慢,会引起细胞氧化性损伤,加速衰老并诱发疾病[24]。通常,活性物质的抗氧化作用归因于其供氢能力,Wang等研究发现,多糖中糖醛酸基团的存在可以触发异头碳的氢原子,发生抗氧化反应[25]。
羟基自由基(·OH)是生物系统中与细胞膜磷脂中的多不饱和脂肪酸分子发生反应并对细胞造成损伤的最活跃的一种活性氧,被认为是活性最强、毒性最大的自由基,是造成机体过氧化损伤的重要因素[26-27]。由图7a可知芡实皮渣多糖对羟基自由基的清除能力呈现出良好的量效关系,多糖浓度为1.0 mg/mL时,对羟基自由基清除率可达到35.56%。但同样浓度下芡实皮渣多糖对羟基自由基的清除率要弱于VC。

图7 芡实皮渣多糖对(a)羟基自由基、(b)DPPH自由基、(c)超氧离子和(d)亚硝酸盐的清除能力Fig.7 Effects of polysaccharides on scavenging hydroxyl radical(a),DPPH radical(b),superoxide ion(c)and nitrite(d)reducing-antioxidant power
如图7b所示,在芡实皮渣多糖浓度为0.2~1.0 mg/mL之间,其对DPPH自由基有明显的清除作用,且随着浓度升高,清除率不断升高。当浓度为1.0 mg/mL时,芡实皮渣多糖对DPPH自由基的清除率可达到85.64%,和同浓度下的VC相当。芡实皮渣多糖对DPPH自由基清除率IC50为0.307±0.008 mg/mL。
如图7c所示,芡实皮渣多糖对超氧离子也有明显的清除作用,且随着浓度升高,清除率越高,当多糖浓度为1.0 mg/mL时,对超氧离子的清除率为34.88%。但同样浓度下芡实皮渣多糖对超氧离子的清除率要弱于VC。
如图7d所示,当芡实皮渣多糖浓度为1.0 mg/mL时,对亚硝酸盐的清除率为20.63%,呈现出其对亚硝酸盐具有一定的清除能力,但同等浓度下对亚硝酸盐的清除率要弱于VC。
3 结论
本实验以芡实皮渣为研究对象,通过对芡实皮渣的干燥条件进行研究,确定其最佳的干燥条件,延长其贮藏期。通过对芡实皮渣多糖的分离提取、理化性质、黏性和凝胶性展开研究,获取其最佳的提取工艺,明确其理化性质。通过测定多糖的总还原力,以及多糖对羟基自由基、DPPH自由基、超氧离子和亚硝酸盐的清除能力,综合评价了芡实皮渣多糖的体外抗氧化特性。
实验结果显示,芡实皮渣在50 ℃条件下干燥4 h,能够有效的将含水量控制在14%以内,易于长期保存,且该条件下的干燥所需能耗最低,可节约干燥成本。利用干燥的芡实皮渣作为研究对象,从中提取多糖,并经过单因素和正交试验获得最佳提取工艺为料液比1∶40、浸提温度55 ℃、浸提40 min、醇沉浓度80%,提取3次,此时得率可达45.94%,纯度82.67%。
碘-碘化钾反应显示该多糖属于非淀粉类多糖,可能具有一定的预防疾病和增强免疫力等方面的应用潜力,多糖的基本结构单元为单一组分葡萄糖,和芡实种仁多糖的组分有所差异。该多糖具有很强的吸水性和吸油性,分别达(65.15±1.52)和(1.27±0.04) g/g,因此可以在化妆品等领域具有一定的应用潜力。同时该多糖还表现出一定的总还原力以及对羟基自由基、DPPH自由基、超氧离子和亚硝酸盐的清除能力,可在食品添加剂和保健医药领域发挥应用价值。
我国的芡实种植面积广泛,芡实资源丰富,而芡实皮渣作为一种芡实加工过程中的废弃物,廉价易得,本研究为芡实加工副产物的综合开发利用提供了新的思路,既可以为芡实皮渣多糖在食品添加剂、化妆品和保健医药等应用领域的开发利用提供理论基础,又能为芡实加工产业链的延伸提供可能性。
