杜氏盐藻胞外多糖抗肿瘤活性及其机制研究
2020-11-23吴思伟何秀苗禤金彩刘红全广西民族大学海洋与生物技术学院广西多糖材料与改性重点实验室广西南宁530007
钟 闰,吴思伟,何秀苗,龙 寒,禤金彩,刘红全(广西民族大学海洋与生物技术学院,广西多糖材料与改性重点实验室,广西南宁 530007)
微藻是生活在淡水或盐水中的原核或真核光合微生物,在水生生态系统中起着关键作用,因为它们负责全球约40%的光合作用[1]。盐生杜氏藻(Dunaliellasalina),亦被称为杜氏盐藻,是一种嗜盐的绿色微藻,属绿藻纲团藻目,比较常见于海盐田。相关研究表明,杜氏盐藻及其代谢产物具有多种生物学功能,包括抗肿瘤[2]、抗氧化[3]、免疫调节[4-5]和抗炎活性[6],可广泛应用到功能性的食品中,具有非常高的研究价值[7]。
全球癌症发病率和死亡率正在迅速增长[8]。尽管癌症生物学和治疗学取得了一定进展,但耐药性仍然存在问题[9]。许多癌细胞对化疗药物表现出显著耐药性,市场上几乎所有化疗药物都会引起严重的副作用[10]。因此,迫切需要新的无毒或副作用小的替代治疗药物[11]。在过去十年中,越来越多的证据表明,海洋生物提供广泛的天然抗肿瘤化合物,可以作为抗肿瘤药物[12]。海藻是海洋中最丰富的资源,其活性代谢产物如多糖和多糖-蛋白质复合物具有抗肿瘤活性或可提高常规化疗药物的疗效[13-14]。
目前有关DsEPS的抗肿瘤活性及其作用机制仍有待阐明。本实验以人宫颈癌Hela细胞为靶细胞,研究DsEPS的抗肿瘤活性,通过转录组学分析阐明抗肿瘤与相关基因表达的关系,再通过构建PPI网络找到互作网络中关键节点对应的hub基因,从而确定DsEPS可能的作用机制。
1 材料与方法
1.1 材料与仪器
杜氏盐藻 上海光语生物科技有限公司提供;Hela细胞、Vero细胞 本课题组保存;配制F/2培养基的药品 均为国产分析纯;胎牛血清 杭州四季青生物工程材料有限公司;MTT 深圳市康初源有限公司;二甲基亚砜(DMSO)、EDTA胰蛋白酶、青链霉素 北京索莱宝科技有限公司;Trizol试剂 Takara Bio。
HBS-1096A型酶标分析仪 南京德铁实验设备公司;EYELA型冷冻干燥机 上海爱朗仪器有限公司;HPS-250型人工气候箱 哈尔滨东明医疗器械厂;TG150-WS型台式高速离心机 上海卢湘仪离心机仪器有限公司;YRE-52A型旋转蒸发仪 巩义市予华仪器公司。
1.2 微藻培养与胞外多糖提取
将微藻按照15%的接种量培养于含250 mL的F/2培养基的500 mL三角瓶中。人工气候箱的培养条件为光照强度3500 lux,暗光周期为12 h/12 h,培养温度为(24±1) ℃,每日摇动3~4次。杜氏盐藻胞外多糖(DsEPS)的提取方法参照Ishiguro等[15]略有改进。将进入稳定期的藻悬液以8000 r/min离心10 min,收集上清液。用水浴温度低于45 ℃的旋转蒸发器减压浓缩上清液,然后用阴离子交换树脂纯化胞外多糖。样品经超滤膜再浓缩后,冷冻干燥得到杜氏盐藻胞外粗多糖。
1.3 细胞培养与抗肿瘤实验
取出保存于液氮罐中的Hela细胞和Vero细胞,静置于37 ℃的恒温水浴锅中解冻1 min,将解冻后的细胞移入培养瓶内,添加DMEM培养液,置于CO2培养箱中,于37 ℃、5% CO2条件下培养2~3 d。
分别接种对数期的宫颈癌Hela细胞与普通Vero细胞于96孔板内,用含DsEPS的细胞培养液培养两种细胞,使含DsEPS的的培养液浓度分别为0.1、0.5、1.0、10.0 mg/mL,每个浓度设置5个重复。选取96孔板其中一行做空白对照,即以不加多糖的DMEM培养液来培养细胞。加样完成后振荡均匀,于37 ℃、5% CO2的条件下培养。在细胞培养时间分别达到24、48、72 h时终止,并在显微镜下观察细胞形态。然后使用MTT比色法,测定细胞数量。Hela细胞与Vero细胞增殖抑制率计算公式如下:
细胞增殖抑制率(%)=(1-实验组/空白组)×100
1.4 转录组测序
在Hela细胞表型实验结果的基础上,采用RNA-seq技术系统分析了DsEPS加入与否对Hela细胞转录组基因表达的影响。采用TRIzol(Invitrogen)法提取Hela细胞中的总RNA,再将样品送往上海美吉生物制药生物技术有限公司(中国上海)进行RNA纯化、反转录、文库构建和测序。
1.5 测序数据质控,映射与转录本组装
由测序产生的数据(图像文件)首先将转化为原始序列,即 Raw reads。使用软件:SeqPrep(https://github.com/jstjohn/SeqPrep)和Sickle(https://github. com/najoshi/sickle)去除Raw reads中的空载、接头和低质量序列(未知碱基N≥10%),得到 Clean reads。Clean reads 运用FastQC软件进行整体评估,包括:①碱基质量分布统计;②碱基错误率分布统计;③A/T/G/C碱基含量分布统计。
使用TopHat(http://TopHat. cbcb. umd. edu/,version2.1.1)[16]软件,将clean reads与具有定向模式的参考基因组分别对齐。基于所选参考基因组序列,使用StringTie软件对Mapped Reads进行拼接,并与原有的基因组注释信息进行比较,寻找原来未被注释的转录区,发掘该物种的新转录本和新基因,从而补充和完善原有的基因组注释信息。
1.6 表达量分析与差异表达基因(DEGs)分析
基于表达矩阵,进行样本间相关性分析,相关性分析有助于理解样本间特别是生物学重复间的相关性,验证实验设计的合理性。
为了确定两组样本间的差异表达基因(DEGs),可以先使用软件RSEM(http://deweylab. biostat. wisc. edu/rsem/)用于量化基因丰度[17]。后续由于本实验有生物学重复,直接使用基于负二项分布的DESeq2软件对raw counts进行分析,基于一定的标准化处理和筛选条件获得比较组间表达差异的基因/转录本,默认参数:p-adjust<0.05 & |log2FC|>=1。
1.7 GO功能注释分类和KEGG富集分析
利用GO数据库,针对选择的差异表达基因可以按照它们参与的生物学过程、构成细胞的组分,实现的分子功能等进行分类。使用软件KOBAS 2.1.1(http://KOBAS.cbi.pku.edu.cn/download.php)进行了和KEGG富集和代谢途径分析[18]。
1.8 蛋白质-蛋白质相互作用(PPI)网络和中心基因分析
为了进一步研究小球藻胞外多糖抗肿瘤的分子机制,使用生物在线数据库工具(用于检索相互作用基因的检索工具,STRING,http://string-db.org)将所有DEG用于构建PPI网络,确定并预测它们之间的相互作用[19]。综合得分>0.7(高置信度得分)被认为是有意义的,然后使用Cytoscape软件(版本3.7.2)将PPI网络可视化[20]。为了评估PPI网络中节点的重要性,在本研究中用Cytoscape软件中的CytoHubba插件用于节点的度中心计算[21-22]。
1.9 实时荧光定量PCR(qPCR)验证
为了验证转录组测序结果,从转录组测序鉴定到的在不同信号通路的13个差异表达基因,用Primer5软件设计13对(包括1个内参基因 GAPDH)荧光定量PCR引物,扩增长度为80~250 bp,引物序列见表1。提取的RNA经反转录合成cDNA 链后,进行荧光定量PCR测定,用2-ΔΔCt法计算每个基因相对于GAPDH的相对表达,所有试验均独立操作至少三次,并进行归一化处理,以保证实验结果的可重复性。
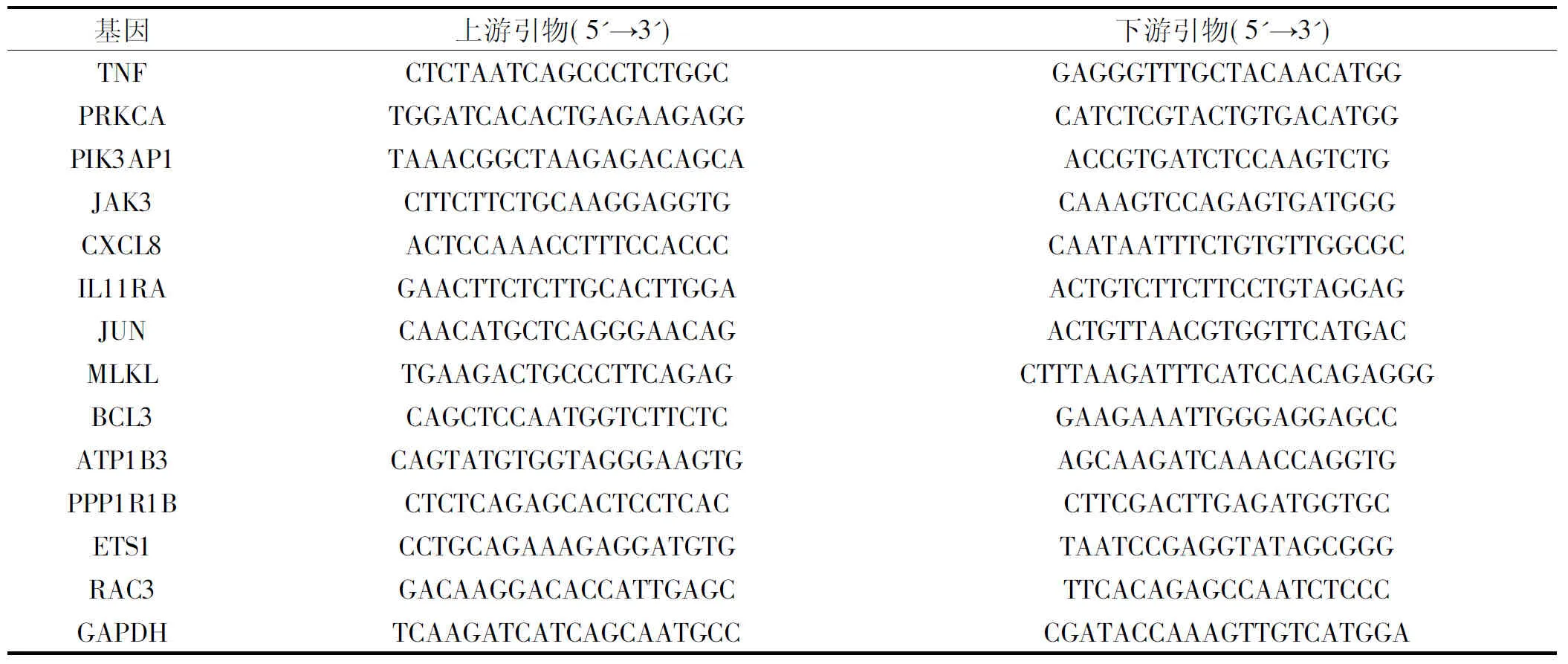
表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 抗肿瘤活性结果
DsEPS对Hela细胞作用的浓度和时间结果如图1所示。随着DsEPS浓度的增加,DsEPS对Hela细胞的抑制越来越强,但在一定时间内(72 h)随着作用时间的延长,并没有显著提升胞外多糖对Hela细胞的抑制率。当DsEPS浓度低于1.0 mg/mL时,DsEPS对Hela细胞的抑制率低于50%,当浓度为1.0 mg/mL时,DsEPS对Hela细胞的抑制率高于50%,说明浓度为1.0 mg/mL时已经达到IC50,且由图2可知,此时对正常Vero细胞几乎没有抑制,说明该浓度对Hela细胞的抑制作用显著(P<0.05)且对普通Vero细胞无毒副作用。
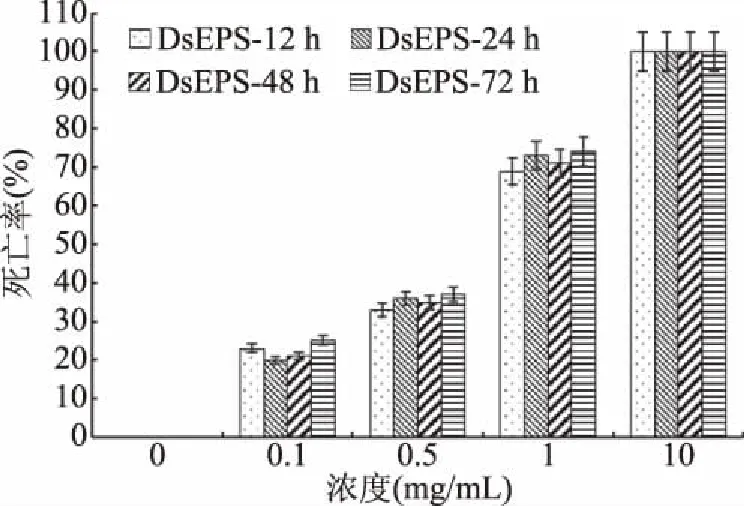
图1 DsEPS对Hela 细胞作用的浓度与时效性Fig.1 Concentration and time effect of DsEPS solution on Hela cells
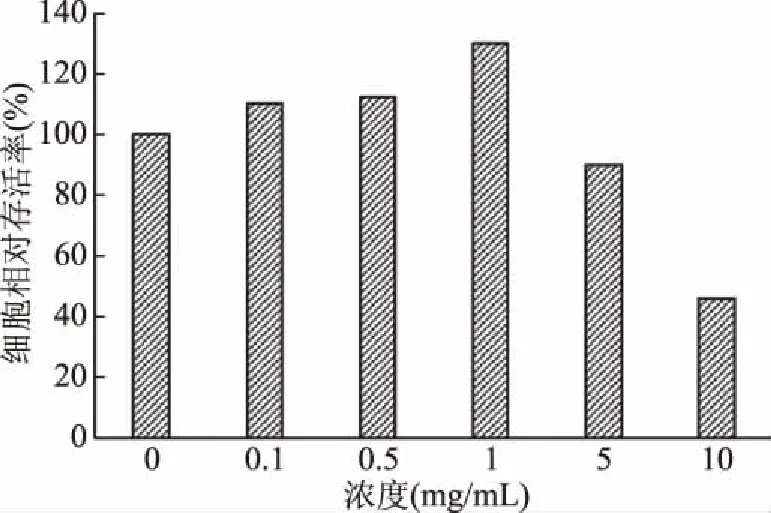
图2 DsEPS对Vero细胞生长的影响Fig.2 The effect of DsEPS on the Vero cell growth
DsEPS对Hela细胞形态的影响如图3所示。DsEPS明显抑制Hela细胞的生长和繁殖。随着浓度的增加,抑制作用也明显增强。抗肿瘤活性试验显示细胞形态发生明显变化,表现为细胞皱缩、形状异常、折射率减弱、细胞-细胞连接减少、细胞间空泡增多、重复性下降。
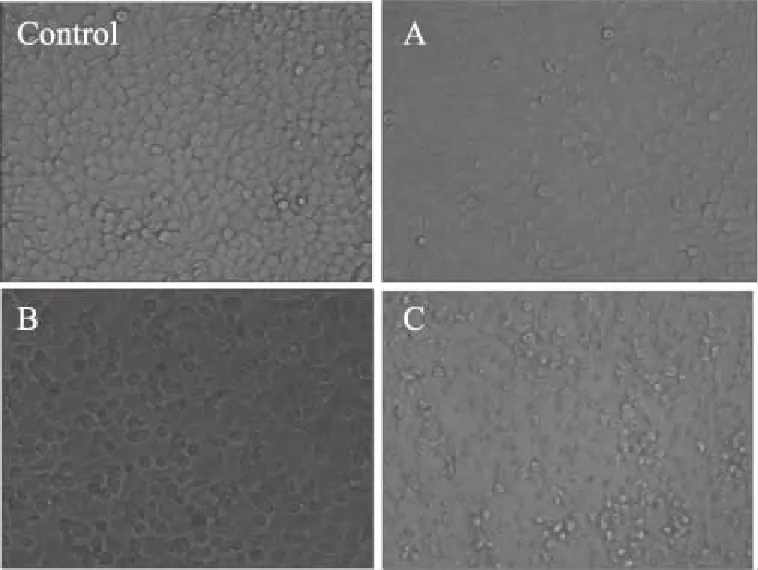
图3 DsEPS对Hela细胞形态的影响(100×)Fig.3 Morphologic changes of Hela cell with DsEPS(100×)注:Control:不加DsEPS培养的Hela细胞;A:DsEPS浓度为0.1 mg/mL时的Hela细胞;B:DsEPS浓度为0.5 mg/mL时的Hela细胞;C:DsEPS浓度为1.0 mg/mL时的Hela细胞。
2.2 测序数据质控,映射和转录组组装结果
对照组(Control)和试验组(DsEPS)分别获得大约5070万和5710万个Raw reads(表2)。对Raw reads进行质控,去除空载、接头和低质量序列(未知碱基N≥10%)后,对照组和试验组分别得到5020万和5660万的Clean reads。该结果表明经过质控后仍有很大比例(99.1%)的高质量Clean reads可用于组装和进一步的下游分析。

表2 质控数据统计表Table 2 Quality control data statistics
Clean reads被映射到人类参考基因组,详细的映射汇总在表3中。总的来说,对照组和Ds组的映射分别有96.95%和96.97%的reads可匹配到基因组中,其中唯一匹配的reads分别占93.8%和94.07%,表明两组的基因表达水平都很高。
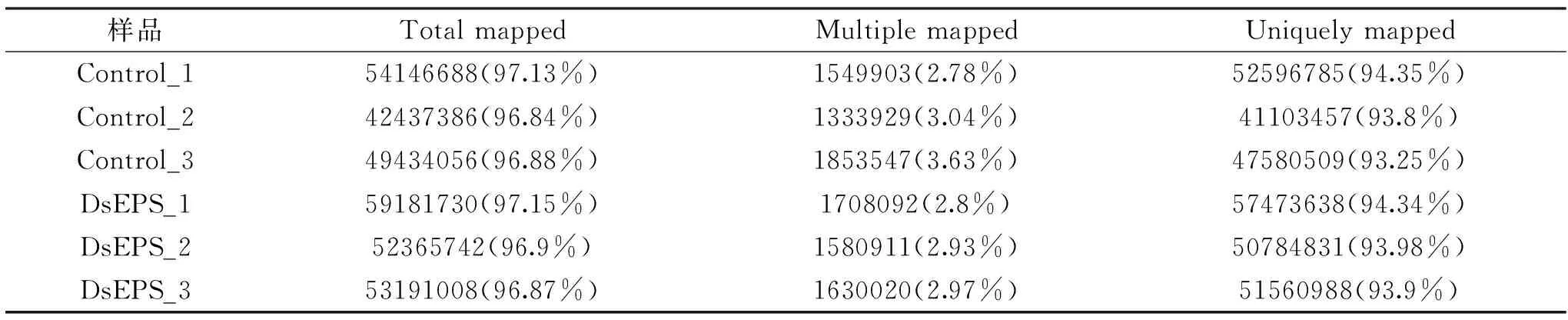
表3 比对结果统计表Table 3 Statistical table of comparison results
使用StringTie软件对每个样本进行拼接,最终merge在一起,对拼接之后的结果的统计和展示如图4所示。
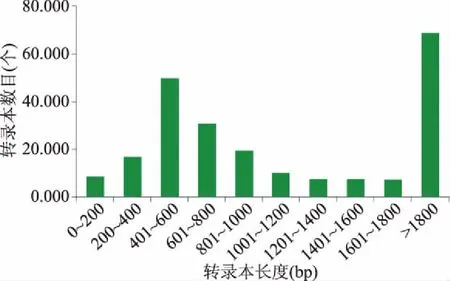
图4 不同转录本长度分布情况Fig.4 Length distribution of transcripts
2.3 样品间相关性检验与DEGs分析
本实验生物学重复样本之间的相关性分析,一方面为了检验生物学重复之间的变异是否符合实验设计的预期,另一方面为差异基因分析提供基本参考。相关系数越接近于1,表明基因/转录本在样本间的表达量相似度越高,即样本间相关性越好。如图5所示,样本间的相关系数值均在0.9以上,重复性优秀。
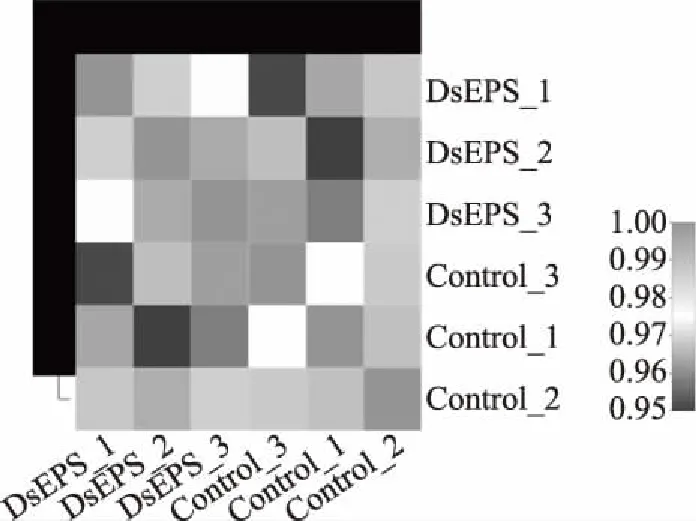
图5 样本间相关性热图Fig.5 Correlation thermogram between samples
对照组和实验组的差异基因表达分析表明,实验组(DsEPS)相较于对照组有2032个基因显著差异表达(P-adjust<0.05 & |log2FC|>=1),其中1132个基因表达上调,900个基因表达下调(表4)。这些基因的功能包括细胞内物质和能量代谢,线粒体功能,细胞周期,分化和凋亡,蛋白质氧化磷酸化和细胞信号,RNA功能,DNA修复和蛋白质合成,以及其他一些代谢酶。

表4 表达量差异统计结果Table 4 Statistical results of expression differences
如图6所示,火山图中每个点代表一个特定的基因,左侧深色点表示显著上调的基因,右侧浅色点表示显著(P<0.05)下调的基因,灰色点为非显著差异基因。将所有基因映射上去之后,可以获知,在左边的点为表达差异下调的基因,右边的点为表达差异上调的基因,越靠左边和上边的点表达差异越显著(P<0.05)。
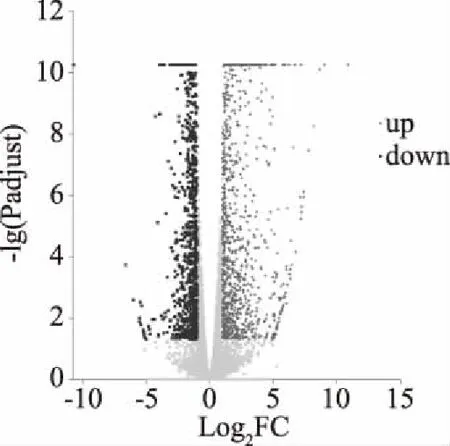
图6 Control_vs_DsEPS火山图Fig.6 Control_vs_DsEPS volcano
2.4 GO功能注释分类与KEGG富集分析
为探讨DsEPS处理肿瘤Hela细胞引起基因表达改变的功能性后果,基于GO数据库对2032 条DEGs进行GO功能注释并对其分类。图7显示了62个的GO分类,由图7可知,DEGs分别注释到生物学过程(biological process)27个亚类、细胞成分(cellular component)19个亚类、分子功能(molecular function)16个亚类。在生物学过程中,注释到该GO二级分类功能的基因或转录本数目排名前三的分别是细胞过程1427个,单一生物过程1338个,生物调节1019个。在细胞成分中,涉及细胞、细胞部分、细胞器的基因较多,分别为1466、1464和1197个。在分子功能中,涉及连接和催化活性的基因较多,分别为1370个和563个。

图7 GO分类统计柱形图Fig.7 GO classification statistical histogram注:纵坐标表示GO的二级分类术语,左方横坐标表示包含在该二级分类中的基因或转录本占总数的百分比,右方横坐标表示比对上该二级分类的基因/转录本数量,三个颜色表示三大分类。
在生物体内,基因相互协调以发挥生物学功能。路径分析有助于更好地理解基因的生物学功能。通过路径显著性富集分析,确定了差异基因参与的生化代谢和信号转导途径。结果发现,治疗组与对照组共有38条代谢途径表达差异显著(P<0.05),其中23条代谢途径表达差异极显著(P<0.01)。图8显示了KEGG 38条表达差异显著的代谢途径(P<0.05)。分别包含在KEGG代谢通路的4个分支中,其中,人类疾病(HD)7条,生物体系统(OS)17条,环境信息处理(EIP)10条,代谢(M)5条。许多信号转导途径被显著丰富(P<0.05),包括肿瘤坏死因子信号途径、MAPK信号途径、细胞因子-细胞因子-受体相互作用、VEGF信号途径、Ras信号途径、PI3K-Akt信号通路和cAMP信号途径。此外,细胞凋亡、细胞周期和代谢等生物过程调控在本研究中得到了显著的丰富(P<0.05)。这些结果可为研究DsEPS对宫颈癌Hela细胞的影响提供重要信息。
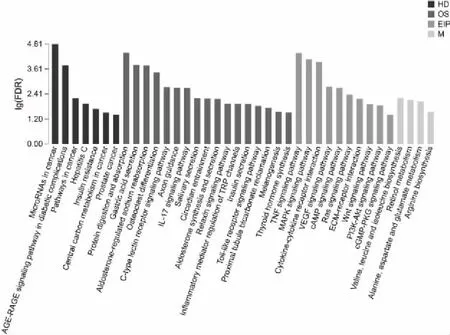
图8 KEGG富集柱形图Fig.8 KEGG enrichment histogram注:横坐标表示KEGG pathway,纵坐标表示富集的显著性水平,对应的是柱子的高度,其中,FDR越小,-lg(FDR)值越大,该KEGG pathway越显著富集。不同颜色表示KEGG代谢通路的不同分支,分别是代谢(M),环境信息处理(EIP),生物体系统(OS),人类疾病(HD)。
2.5 蛋白互作网络分析
为了进一步研究DsEPS抑制肿瘤生长的分子机制和所有DEGs之间的相互作用关系,将2032条DEGs映射到STRING数据库中,并选择综合得分大于0.7(高置信度)的验证性相互作用构建PPI网络。PPI网络由161个节点组成(图9)。在PPI网络中,包括含2个自由基S-腺苷蛋氨酸结构域(RSAD2)、ISG15泛素样修饰剂(ISG15)、干扰素诱导的四肽重复蛋白1(IFIT1)、MX动态蛋白样GTPase 2(MX2),干扰素诱导蛋白与四肽重复序列2(IFIT2),2′-5′-寡腺苷酸合成酶样(OASL),2′-5′-寡腺苷酸合成酶1(OAS1),Jun原癌基因(Jun),2′-5′-寡腺苷酸合成酶2(OAS2),XIAP相关因子1(XAF1)等10种蛋白质。用Cytoscape软件中的CytoHubba插件用于节点的度中心计算,这些蛋白与其他蛋白质(节点度大于8)紧密相连,表明它们是互作网络中的关键节点(图10),这些hub基因可能在DsEPS抑制肿瘤生长中起重要作用。hub基因及其对应各种拓扑性质如表5所示。
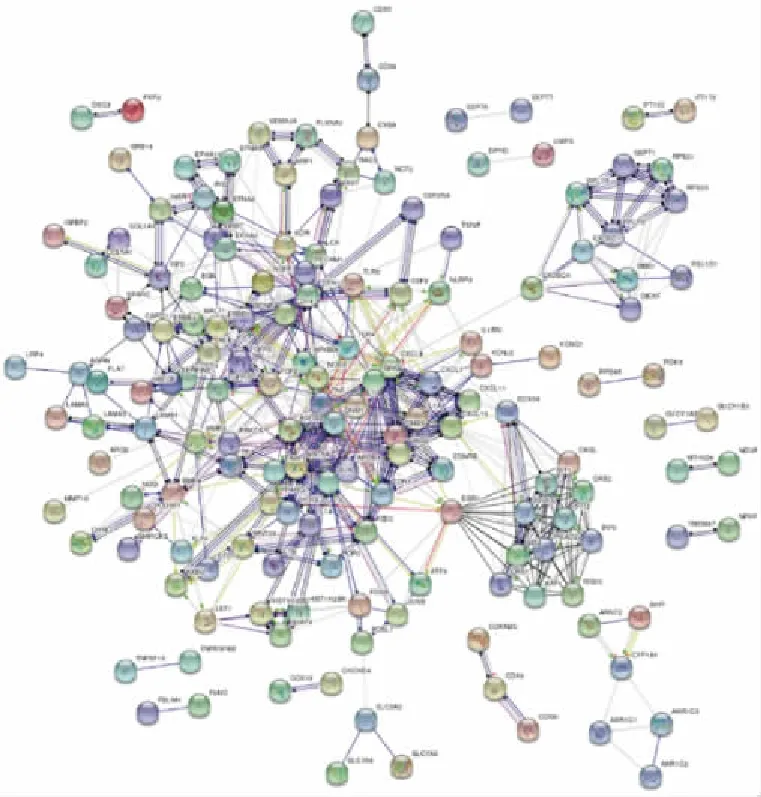
图9 STRING交互网络Fig.9 STRING interaction network
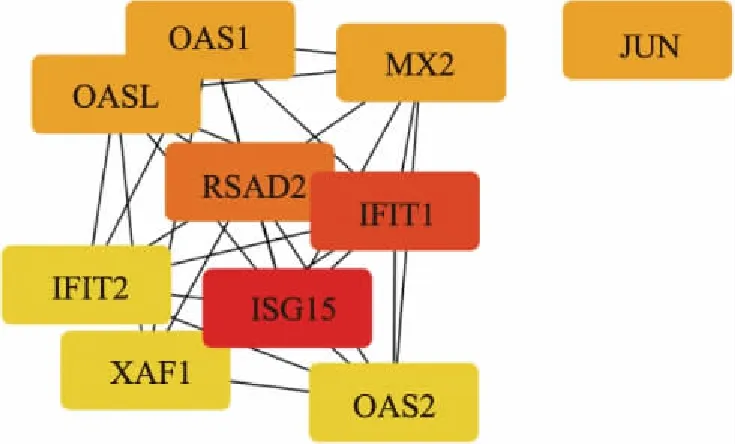
图10 PPI互作网络中的关键节点Fig.10 Key nodes in PPI interactive networks
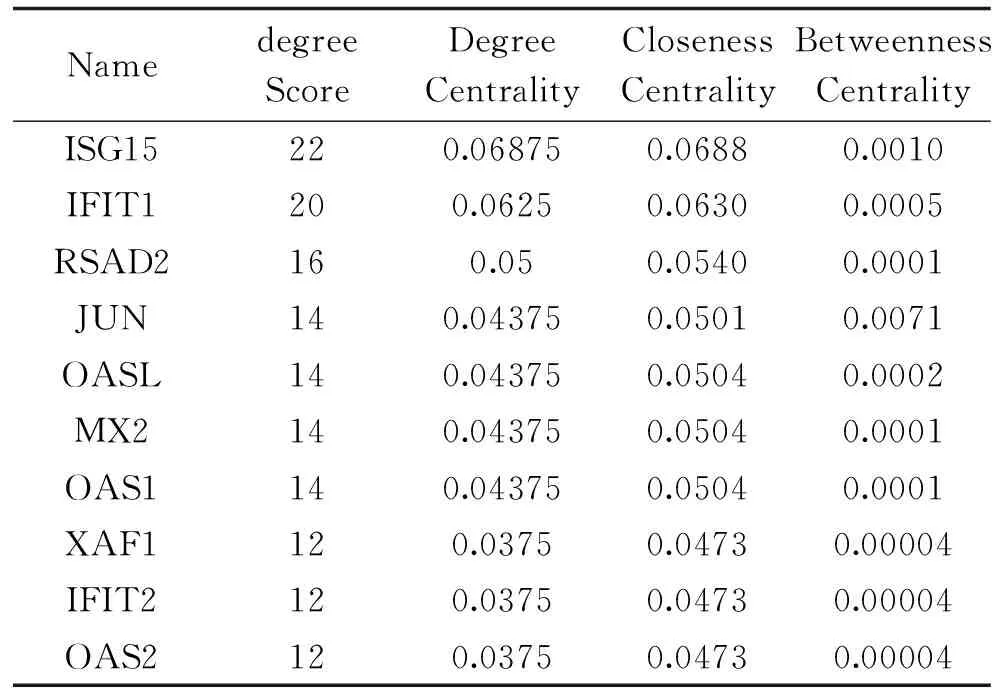
表5 基因互作关系网络统计表Table 5 Statistical table of gene interaction network
2.6 qPCR验证
为了验证转录组测序结果并进一步分析具有重要抗癌作用的基因的表达模式,13个具有不同信号通路的基因,MAPK信号通路(TNF、PRKCA)、PI3K-AKT信号通路(PIK3AP1、JAK3)、TNF信号通路(JUN、MLKL、BCL3)、cAMP信号通路(ATP1B3、PPP1R1B)、Ras信号通路(ETS1,RAC3)和细胞因子-细胞因子-受体相互作用(CXCL8,IL11RA)中的基因进行实时荧光定量PCR。qPCR验证结果如图11所示,其表达趋势与RNA-seq获得的结果一致,表明RNA-seq数据可靠地反映了基因表达的变化。
根据RNA-seq和qPCR结果,DsEPS处理的Hela细胞中,TNF、PIK3AP1、CXCL8、JUN、ATP1B3和ETS1的表达增加,而PRKCA、JAK3、IL11RA、MLKL、BCL3、PPP1R1B和RAC3等其他基因的表达显著(P<0.05)降低。
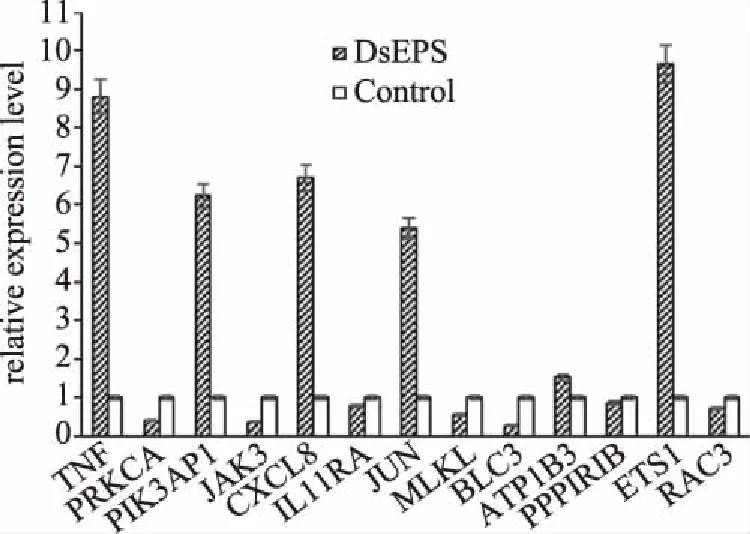
图11 DEG的qPCR验证Fig.11 qPCR validation of DEG
3 讨论与结论
本研究表明,杜氏盐藻胞外多糖(DsEPS)具有抑制Hela细胞生长、促进Hela细胞凋亡的作用。在此条件下进行了生物信息学分析,以探索与抗肿瘤相关的潜在关键DEG和涉及DEGs的生物学功能和途径。通过构建PPI,确定了一些可能在实验性肿瘤细胞抑制中起决定性作用的关键节点的hub基因。转录组分析结果显示DsEPS共筛选出2032个DEGs,其中上调的1132个,下调的900个。肿瘤细胞的凋亡已经被证明是许多癌症疗法诱导的最常见的抗肿瘤机制[23]。肿瘤坏死因子相关凋亡诱导配体(TNFSF10/TRAIL)激活的TNFRSF10A的mRNA水平增加,从而转导细胞死亡信号并诱导细胞凋亡[24]。BMF和BCL-2表达水平降低,这与抑制细胞凋亡有关。DsEPS对这些基因有明显的调控作用,诱导细胞凋亡是其抗肿瘤作用的主要原因。下调的DEGs主要参与细胞代谢、有丝分裂和分化等功能。如甾醇调节元件结合转录因子1(SREBF1)、成纤维细胞生长因子受体样1(FGFRL1)。此外,与细胞迁移和侵袭相关的基因,如迁移和侵袭增强因子1(MIEN1)[25]、固醇调节元件结合转录因子1(SREBP1)也被下调。Gao等结果表明SREBP1通过促进与p65磷酸化相关的基质金属肽酶7(MMP7)的表达而促进大肠癌细胞的侵袭和转移[26]。本研究发现MMP7和SREBP1的基因表达显著下调,提示CEPS可能通过抑制SREBP1而影响肿瘤细胞的侵袭和转移。
PI3K-Akt信号通路在人类肿瘤的恶性转化及随后的生长、增殖和转移中起着至关重要的作用[27]。大量研究表明,PI3K-Akt信号通路在多种癌症中异常激活[28]。这种途径的抑制剂被认为是潜在的候选药物,其中一些处于临床试验的不同阶段[29-30]。在人类癌症中,抗凋亡的BCL-2蛋白在保护细胞免受不可逆转的细胞死亡方面发挥着关键作用[31]。本研究提示DsEPS可能通过抑制PI3K-Akt信号蛋白的表达下调BCL-2基因,释放其对细胞凋亡的抑制作用,从而使Hela细胞凋亡。
通过PPI网络构建,可以观察到一系列hub基因形成了一个局部网络,包括RSAD2、IFIT1、MX2、IFIT2、OASL、OAS1、OAS2、XAF1和ISG15,其中大多数DEGs与癌症的发生有关。其中,OAS、OAS1和OAS2是OAS蛋白家族的成员。OAS蛋白由OAS1/2/3和OASL蛋白组成,是干扰素诱导的第一个阻碍病毒核酸翻译的抗病毒蛋白[32]。HPV与Hela细胞之间的联系已经被清楚地建立起来,人们普遍认为Hela细胞的主要原因是慢性感染致癌的HPV[33]。然而,OAS家族成员在肿瘤发展过程中的作用并没有得到很好的证实。此外,IFIT1和IFIT2两个hub基因与干扰素刺激密切相关。IFIT2与一些关键的细胞功能有关,如增殖和迁移[34]。John等识别干扰素刺激蛋白IFIT1作为炎症基因程序的负调控因子,并确定IFIT1在I型干扰素表达中的正调控作用[35]。JUN被广泛认为是一种癌基因,它是激活蛋白-1(AP-1)复合物中研究最广泛的蛋白质,参与多种细胞活动,包括增殖、迁移和肿瘤进展[36]。另一方面,c-Jun-NH2终末激酶(JNK)/c-Jun通路是癌细胞中重要的促凋亡信号通路。在目前的研究中,DsEPS处理的Hela细胞Jun显著增加。然而,没有证据表明DsEPS与这些中枢基因之间的关系。所以会进一步研究DsEPS在控制这些中枢基因及其调控网络中的作用。
