抗H9亚型禽流感病毒血凝素广谱单克隆抗体的筛选与鉴定
2020-11-18屈孟锦李雪松滕巧泱李鲁兆刘性坡崔宏锐杨健美李泽君
屈孟锦,李雪松,滕巧泱,李鲁兆,刘性坡,崔宏锐,杨健美,李泽君
(中国农业科学院上海兽医研究所,上海 200241)
H9N2亚型禽流感(avian influenza,AI)在世界范围内广泛存在,给养禽业发展和人类健康带来严重危害[1]。自1994年首次报道在我国鸡群中分离到H9N2禽流感病毒(Avian influenza virus,AIV)[2]以来,该病毒在我国已流行20多年,几乎所有的养殖场都有该亚型AIV的存在。H9N2 AIV也可以感染哺乳动物,包括猪和人类,自1999年首次从人体中分离到H9N2流感病毒后,随后又在广东、云南等地从人体分离到了该病毒[3-6]。H9N2 AIV还会与其他亚型流感病毒发生重组,如近些年引起社会恐慌的H7N9禽流感病毒,其内部基因就是由H9N2禽流感病毒提供的[7]。由此可见,H9N2 AIV造成的危害不容忽视。
AIV由8个基因组成,其中血凝素(hemagglutinin,HA)是AIV的主要抗原,变异频率很高[8],其变异会导致AIV抗原变异。Li等[9]发现1996-2002年间中国大陆地区的H9N2 AIV可分为6个抗原群,不同抗原群之间抗原差异较大;Teng等[10]发现2009-2012年在中国分离的H9N2 AIV已经形成新的抗原亚组,与中国早期的H9N2分离株抗原性不同,其流行毒株与疫苗株之间存在抗原差异,从而可造成免疫失败引发疫情。
近年来,单克隆抗体广泛应用在流感病毒抗原变异的研究中,Wan等[11]采用抗H9N2 AIV HA的单抗在鸡胚中筛选逃逸突变病毒,并从中鉴定出9个关键氨基酸,这对于H9抗原图谱的绘制具有重要意义。Chen等[12]通过中和抗体筛选逃逸突变株的方法,发现8种抗H1N1亚型HA单克隆抗体识别HA抗原表位的Sa、Sb、Ca1和Ca2位点。氨基酸的变异可能会导致抗原性的变异,通过单克隆抗体来标记HA的抗原位点对抗原变异的研究以及疫苗的研制具有重要意义。
前期实验利用表达H9N2 AIV SH441毒株HA基因的真核表达质粒免疫小鼠已获得多株抗H9亚型HA蛋白的单克隆抗体,本研究在此基础上,成功筛选到4株抗H9亚型HA的广谱中和抗体1F2、1C5、3F7和4E7(本文未列出其他不具有广谱性的单克隆抗体),这些单克隆抗体将为H9N2 AIV通用疫苗研制及高通量抗体检测方法的建立提供重要材料。
1 材料和方法
1.1 主要材料Phanta高保真酶、同源重组酶购自Vazyme公司;胶回收试剂盒购自Axygen公司;EcoR I和XhoI限制性内切酶购自NEB公司;DH5α感受态细胞购自擎科生物公司;去内毒素中提质粒试剂盒购自QIAGEN公司;DMEM培养基购自Hyclone公司;胎牛血清(FBS)购自Biosun公司;Opti-MEM购自Gibco公司;TransIT-293 Transfection Reagent购自Mirus Bio LLC公司;羊抗鼠FITC标记的IgG购自Thermo Fisher公司;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.2 病毒、质粒、载体和细胞A/Chicken/Shanghai/441/2009(H9N2)(Ck/SH/441/2009)、A/Chicken/Jiangsu/825/2009(H9N2)(Ck/JS/825/2009)、A/Chicken/Jiangsu/925/2009(H9N2)(Ck/JS/925/2009)、A/Chicken/Jiangsu/A139/2010(H9N2)(Ck/JS/A139/2010)、A/Chicken/Shandong/2612/2010(H9N2)(Ck/SD/2612/2010)、A/Chicken/Anhui/B278/2011(H9N2)(Ck/AH/B278/2011)、A/Chicken/Guangdong/B527/2011(H9N2)(Ck/GD/B527/2011)、A/Duck/Anhui/C313/2012(H9N2)(Dk/AH/C313/2012)、A/Chicken/Guangdong/C76/2012(H9N2)(Ck/GD/C76/2012)、A/Chicken/Guangdong/D1389/2013(H9N2)(Ck/GD/D1389/2013)、A/Chicken/Anhui/D483/2013(H9N2)(Ck/AH/D483/2013)、A/Chicken /Henan/E3203/2014(H9N2)(Ck/HN/E3203/2014)、A/Chicken/Guangdong/F1650/2015(H9N2)(Ck/GD/F1650/2015),质粒pCAGGS-H9、pCAGGS-H9N1SH5,pCAGGS空载体,293T细胞、MDCK细胞均由本实验室提供。
1.3 引物设计参照实验室前期测得的序列,通过Primer Primier 5.0软件设计各片段扩增所需引物(表1),在需要融合的片段上加入至少15 bp的重叠序列。同源重组引物在相应的位置加上至少15 bp的载体序列,以将其连接在载体上。
1.4 鸡胚中和实验用空白细胞培养液将SH441毒株稀释成200 EID50/100 μL,稀释好的病毒分别与单克隆抗体以及空白细胞培养液等量混和,充分混匀后37℃作用2 h;将混合液接入9~11日龄SPF鸡胚,每组3个鸡胚,每个鸡胚接种100 μL;37℃温箱孵育48 h后取尿囊液进行血凝实验。阳性血凝结果则表示病毒未被抗体中和,阴性血凝结果则表示病毒被抗体中和。

表1 各片段PCR扩增引物Table 1 Primers for every fragment
1.5 血凝抑制实验选择近年分离到的13株H9N2 AIV毒株,将毒株配制成8单位抗原,随后在血凝板加入25 μL/孔 PBS,第一列依次加入25 μL单克隆抗体细胞上清液,充分混匀后吸取25 μL于第2列,按照此方法2倍比稀释至第10列后吸取25 μL弃去。血凝板的前11列均加入25 μL已配制准确的8单位抗原,混匀室温作用30 min后,加入50 μL/孔0.5%鸡红细胞悬液,轻轻混匀,静置30 min后读数,以完全抑制8单位抗原的血清最高稀释倍数作为HI效价。以不具有广谱性的单克隆抗体10F3作为对照。
1.6 间接免疫荧光实验将MDCK细胞以合适的比例铺匀至24孔板中,待长至80%~90%时弃去培养液,用无菌PBS清洗1次后备用;将13株H9N2毒株用无血清培养基2000倍稀释接种在洗涤过的MDCK细胞中,在37℃、5% CO2培养箱中培养24 h;弃去细胞上清液,固定、通透、封闭后,将单克隆抗体和羊抗鼠FITC37℃作用1 h,每次均用PBS洗涤3次;最后使用荧光显微镜观察并拍照。以不具有广谱性的单克隆抗体10F3作为对照。
1.7 重组质粒的构建pCAGGS-H9是将H9亚型优化的SH441毒株的HA片段插入到真核表达载体pCAGGS β-actin启动子的下游;pCAGGS-H9N1 SH5是将优化的SH441毒株的HA片段和N1亚型的NA片段依次插入到真核表达载体Huang4 β-actin启动子下游,H5亚型HA片段插入到SV40启动子下游。以pCAGGS-H9N1SH5为模板分别扩增H9和H5;再以H9为模板扩增H9HA1和H9HA2,同理得到H5HA1和H5HA2;随后通过引物PCS-H9HA1-F和PCS-H5HA2-R将H9HA1和H5HA2融合成1个片段H9HA1-H5HA2,同理得到片段H5HA1-H9HA2。将融合得到的2个片段通过同源重组反应与酶切纯化过的pCAGGS载体连接重组;随后将连接产物转化至DH5α感受态细胞,菌液PCR鉴定阳性的菌液进行测序,测序正确的菌液通过去内毒素中提质粒试剂盒提取质粒,分装,-20℃保存备用。

图1 重组基因结构示意图Fig.1 Schematic diagram of recombinant gene structure
1.8 间接免疫荧光检测单克隆抗体作用区域利用293-Mirus转染试剂将2个HA重组嵌合质粒pCAGGS-H9HA1-H5HA2、pCAGGS-H5HA1-H9HA2分别转染至生长密度为80%~90%的293T细胞,并且转染pCAGGS-H9作为阳性对照,pCAGGS空质粒作为空白对照,在37℃、5% CO2培养箱培养24 h后做间接免疫荧光实验,使用荧光显微镜观察并拍照。
2 结果
2.1 中和实验结果将单克隆抗体1F2、1C5、3F7和4E7与SH441病毒的混合液接种鸡胚,48 h后取尿囊液经血凝实验测定均没有血凝现象,空白培养液与SH441病毒的混合液存在血凝现象,且血凝价为211,结果与SH441病毒自身的血凝价相同,说明这4株单克隆抗体对于SH441病毒均存在中和活性。
2.2 血凝抑制实验结果通过血凝抑制实验检测单克隆抗体对不同H9N2 AIV的反应性,结果见表2。其中1F2、1C5、3F7和4E7对这13株2009-2015年间分离到的H9N2 AIV都具有较强的反应性,而10F3与2009年的毒株反应性较强,与2009年以后的毒株反应逐渐减弱。
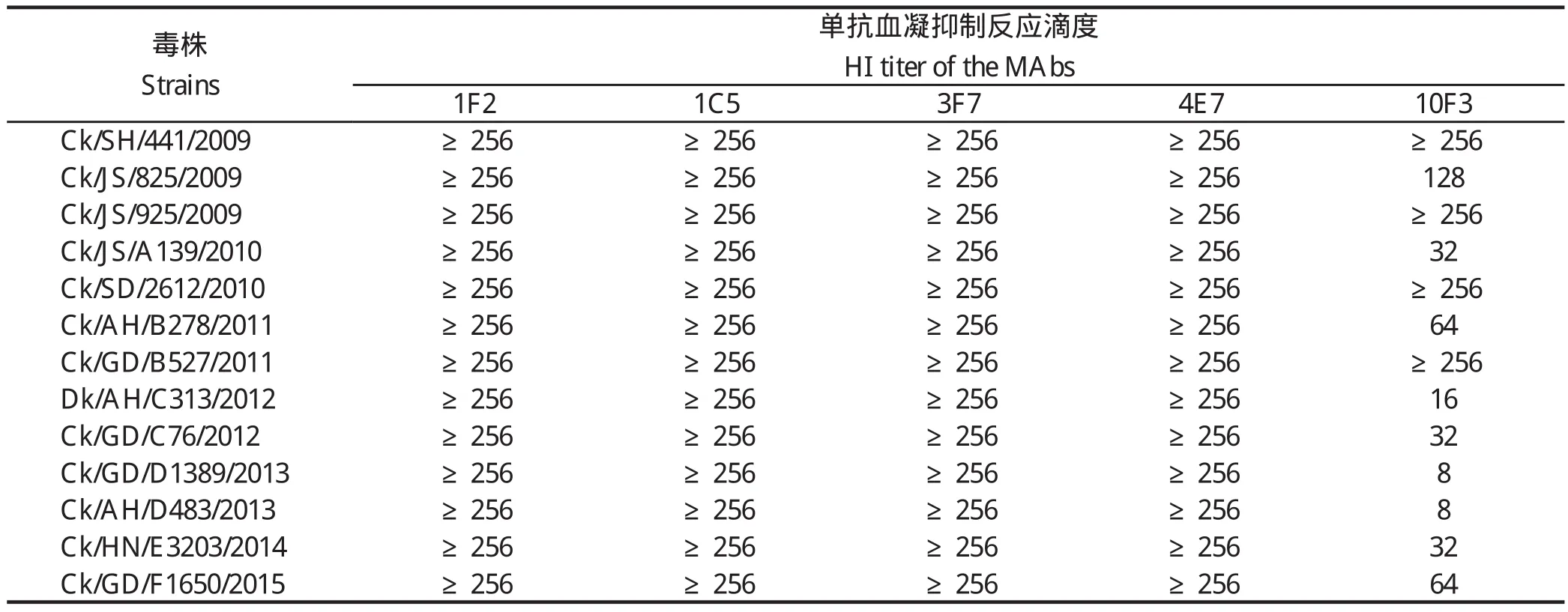
表2 单克隆抗体与不同H9N2亚型禽流感病毒血凝抑制交叉反应结果Table 2 The HI results of different H9N2 AIV against MAbs
2.3 间接免疫荧光实验结果通过间接免疫实验检测不同的H9N2 AIV感染MDCK细胞后与单克隆抗体的反应性,1F2、1C5、3F7和4E7对这13株毒株均可见明显的绿色荧光,其中1F2、1C5、3F7和4E7与SH441毒株反应结果见图2。10F3与2009年的毒株反应可见明显的荧光,与2009年后的毒株反应荧光较弱,甚至没有荧光(表3)。
2.4 重组质粒的鉴定以构建质粒为模板,使用引物对PCS-H9HA1-F和PCS-H5HA2-R扩增H9HA1-H5HA2,引物对PCS-H5HA1-F和PCS-H9HA2-R扩增H5HA1-H9HA2,1%琼脂糖电泳检测,均扩增出约1700 bp的特异性条带,与预期大小一致(图3)。将质粒测序,测序结果经比对与预期一致。

图2 4株单克隆抗体在MDCK细胞上与SH441毒株反应的IFA结果Fig.2 The IFA results of MAbs against SH441 virus in MDCK cells
2.5 间接免疫荧光检测单克隆抗体作用区域结果结果见表4,1F2、1C5、3F7和4E7均与pCAGGSH9HA1-H5HA2和pCAGGS-H9反应,有明显的绿色荧光,而与pCAGGS-H5HA1-H9HA2和pCAGGS空质粒都不反应,这说明1F2、1C5、3F7和4E7作用位点都位于HA1区域。
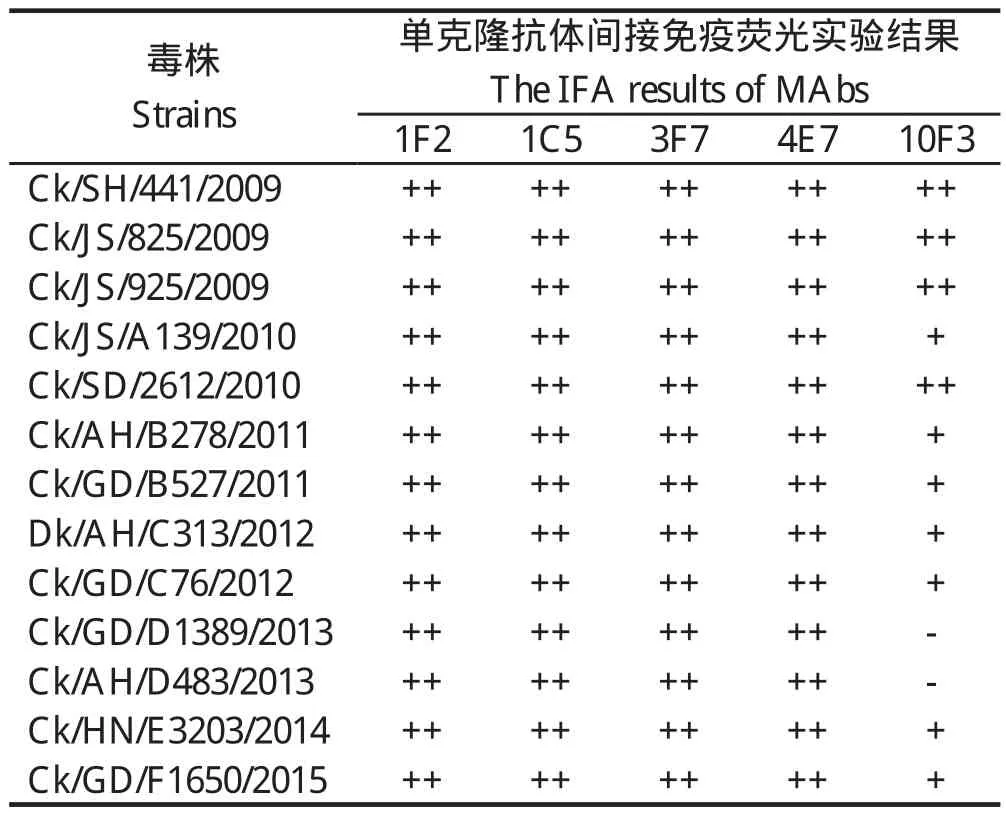
表3 单克隆抗体与不同H9N2亚型禽流感病毒间接免疫荧光实验结果Table 3 The IFA results of different H9N2 AIV against MAbs
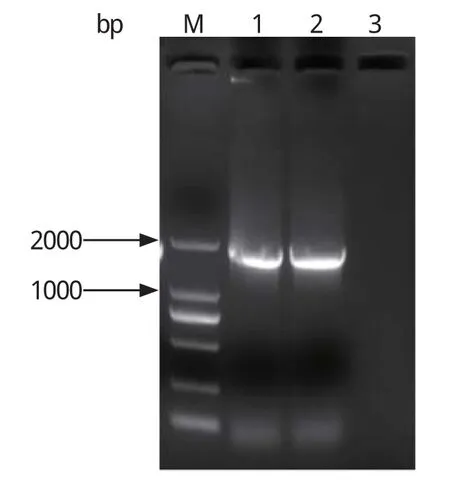
图3 重组质粒的PCR鉴定Fig. 3 Identification of recombinant plasmids by PCR

表4 单克隆抗体与HA重组质粒IFA结果Table 4 The IFA results of MAbs with HA recombinant plasmids
3 讨论
本研究中选择了13株2009-2015年间不同地域分离到的H9N2 AIV,HA基因皆属于Ck/BJ/1/1994分支下的Subgroup Ⅱ亚分支,彼此抗原性存在差异。HI和IFA实验表明,10F3与2009年毒株具有较强反应性,与2009年以后毒株反应性逐渐减弱,说明其识别的是一个易变异的表位,这13株毒株的抗原性在不断的发生变化;而1F2、1C5、3F7和4E7与这些毒株都具有较强的反应性,说明这4株单克隆抗体具有广谱反应性,其识别的可能是一个保守表位。
本研究构建了H9亚型与H5亚型HA的嵌合质粒,目的是为了检测单克隆抗体的作用位点是位于HA1或者HA2亚基,结果显示这5株单克隆抗体位于HA1亚基。在流感病毒感染或者疫苗免疫的过程中,引发体液免疫产生的抗体通常针对HA的头部对机体产生保护,但是这类抗体普遍具有毒株特异性;另一类抗体针对HA茎部保守区域,可以阻止不同亚型的流感病毒[13-14],有研究报道,相较于针对HA头部和受体结合区域的抗体,流感病毒更难逃逸针对茎部的广谱抗体[15]。
总之,本研究筛选到4株广谱具有中和活性抗H9亚型HA的单克隆抗体,且其作用位点在HA1区域,这些单克隆抗体将为H9N2 AIV通用疫苗研制及高通量抗体检测方法的建立提供重要材料。
