茴香5种组织RNA提取方法比较
2020-11-18王晓敏王彩艳潘兵青周雪荣
王晓敏,王 林,王彩艳,潘兵青,周雪荣
(1.宁夏大学 农学院,宁夏 银川 750021; 2.宁夏设施园艺(宁夏大学)技术创新中心,宁夏 银川 750021;3.宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021; 4.宁夏现代设施园艺工程技术研究中心,宁夏 银川 750021; 5.澳大利亚联邦科工组织,澳大利亚 堪培拉 2600)
茴香(FoeniculumvulgareMill.)为伞形科1~2年生草本植物,原产于地中海地区,因其适应性较强,有较强的耐盐、耐旱性,在世界各地均有栽培[1]。随着茴香药用和食用价值的发现,关于茴香的研究也逐渐增多。近年来,有关茴香的研究主要集中在外观形态描述及其生理机制阐明等[2]方面,而有关茴香基因克隆、分子调控机制等方面的研究鲜有报道,为了挖掘耐盐、耐旱相关基因并了解其表达与调控,提取高质量的RNA十分必要。
提取高质量的RNA是进行cDNA文库构建、荧光定量PCR检测、Northem杂交等分子生物学研究的前提[3-4]。目前,常用的提取植物RNA的方法有CTAB法、CTAB-水饱和酚法、异硫酸氰胍法、Trizol法等[5],上述方法在植物上都有成功的报道,但由于植物组织在物质组成上存在差异、在生长过程中因生长环境胁迫积累了大量的次生代谢物质,如蛋白质、多糖和多酚等物质,易与RNA共沉淀,对RNA的提取和纯化有干扰作用,进一步影响总RNA的产量和质量[6-7]。因此,对植物不同组织总RNA提取方法进行比较显得尤为重要。
目前,对于茴香不同组织总RNA提取方法的比较研究尚未见报道。鉴于此,以宁夏海原地区的茴香为材料,采用CTAB改良法、CTAB-水饱和酚法、Trizol改良法和OMEGA植物RNA提取试剂盒(简称试剂盒法)4种方法提取茴香根、茎、叶、花和种子的总RNA,并从RNA质量、得率及成本等方面进行提取方法的比较,以筛选出提取茴香不同组织总RNA的最佳方法,为后续相关基因的表达及功能研究奠定基础。
1 材料和方法
1.1 试验材料
供试材料为宁夏大学农学院园艺课题组收集的宁夏海原地区茴香种子,种植于宁夏大学农科实训基地玻璃温室苗钵中,常规管理,根、茎、叶组织于7片叶时采样,花组织于花期采样并在液氮中速冻,保存于-80 ℃冰箱备用。CTAB缓冲液为本实验室自制。Trizol试剂购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 CTAB改良法 参照吴田等[8]的方法略有改进,不同之处在于将第4步上清液吸于新的离心管后,加入等体积的氯仿∶异戊醇(24∶1)混匀后于4 ℃、12 000 r/min离心10 min。吸上清液于新的离心管,加入1/2上清液体积的5 mol/L NaCl,摇晃混匀,再加1/2上清液体积的氯仿,振荡混匀于4 ℃、12 000 r/min离心10 min后丢弃上清液,在超净工作台内干燥10 min,溶于40 μL DEPC水中,于-80 ℃冰箱保存。
1.2.2 CTAB-水饱和酚法 操作依照水饱和酚(北京索莱宝科技有限公司)的说明书进行。具体操作步骤如下:称取0.1 g速冻的新鲜组织于研钵中充分研磨至粉末状,研磨中不断加入液氮,将研磨好的粉末迅速转移至65 ℃预热含有600 μL CTAB提取液的1.5 mL离心管中,剧烈涡旋振荡30 s,使其混匀后于65 ℃水浴2~5 min,期间振荡3~5次,待其稍微冷却后加入等体积的氯仿/饱和酚涡旋振荡1 min,混匀,于4 ℃、12 000 r/min离心15 min,再加入等体积的氯仿振荡1 min使其混合均匀后于4 ℃、12 000 r/min离心15 min,将上清转移到另一新的1.5 mL离心管中,加入1/3体积的8 mol/L LiCl,使其最终浓度为2 mol/L,4 ℃过夜沉淀。隔天再于4 ℃、12 000 r/min条件下离心20 min后弃上清,再用70%无水乙醇洗沉淀,在超净工作台内干燥10 min,溶于40 μL DEPC水中,于-80 ℃冰箱保存。
1.2.3 Trizol改良法 与尹慧等[9]的方法稍有不同:将第1步离心后上清液转入新的1.5 mL离心管中,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),充分混匀,12 000 r/min、4 ℃离心15 min。取上清液,再加入等体积的氯仿∶异戊醇(24∶1),充分混匀,12 000 r/min离心10 min后丢弃上清液,在超净工作台内干燥10 min,溶于40 μL DEPC水中,于-80 ℃冰箱保存。
1.2.4 试剂盒法 操作参照植物RNA提取试剂盒(美国OMEGA公司)的说明书进行。
1.3 总RNA质量检测
取2 μL RNA溶液,测定RNA浓度和纯度:利用核酸蛋白检测仪检测RNA样品浓度和OD值。一般情况下,纯净的RNA OD260/OD280比值约为1.8;OD260/OD230比值应大于2.0;利用公式(1)计算RNA样品得率。
RNA样品得率=RNA质量浓度(μg/μL)×RNA溶液体积(μL) /样品质量(g)
(1)
1%琼脂糖凝胶电泳检测RNA的完整性:取5 μL RNA样品,点样于1%琼脂糖凝胶(每100 mL凝胶含有10 μL GelRed)点样孔中,140 V恒压电泳15 min,在凝胶成像仪下观察并拍照记录。
2 结果与分析
2.1 不同方法提取茴香各组织总RNA的质量分析
高质量RNA的OD260/OD280应在1.8~2.0,表明不受酚类物质和蛋白质的污染,质量好;OD260/OD230应大于2.0,说明RNA较少受到小分子和盐类污染[10]。经核酸蛋白检测仪检测可得各组织RNA的浓度及纯度(表1)。针对茴香根组织而言,CTAB改良法和试剂盒法测得的OD260/OD280分别为2.00和1.96,介于1.8~2.0;OD260/OD230均为2.16,大于2.0,表明上述2种方法提取根RNA的纯度较好;CTAB-水饱和酚法和Trizol改良法测得的OD260/OD280分别为1.74和2.24,OD260/OD230分别为1.98和1.81,表明这2种方法的所提取的根组织RNA的纯度不佳。试剂盒法提取根RNA的得率最高,为99.68 μg/g,其次为Trizol改良法和CTAB改良法,分别为90.81 μg/g和71.26 μg/g,CTAB-水饱和酚法最低。因此,试剂盒法最适宜于茴香根RNA的提取。

表1 不同方法提取茴香各组织的总RNA纯度及得率分析Tab.1 Purity and yield analysis of total RNA extracted from fennel tissues by different methods
针对茴香茎组织而言,CTAB改良法和试剂盒法测得的RNA OD260/OD280在分别为1.92和1.95,OD260/OD230分别为2.04和2.12,表明这2种方法所提取的茎组织RNA的纯度较好;CTAB-水饱和酚法和Trizol改良法提取的RNA OD260/OD280分别为1.78和1.86,OD260/OD230分别为2.13和1.65,表明这2种方法所提取的茎组织RNA的纯度不佳,可能有一定程度的降解。4种提取方法得率最高的为试剂盒法,其次为CTAB改良法和Trizol改良法,CTAB-水饱和酚法最低。因此,试剂盒法最适宜于茴香茎组织RNA的提取。
针对茴香叶组织而言,CTAB改良法、Trizol改良法和试剂盒法测得的RNA OD260/OD280分别为1.82、1.95和1.93,OD260/OD230分别为2.12、2.11和2.05,表明这3种方法的所提取的叶组织RNA的纯度较好;CTAB-水饱和酚法提取的RNA OD260/OD280为2.01,OD260/OD230为1.96,表明这种方法提取的叶组织RNA纯度不佳,提取的RNA可能有一定程度的降解。4种提取方法得率最高的为试剂盒法,其次为CTAB改良法和Trizol改良法,得率最低的是CTAB-水饱和酚法。因此,CTAB改良法、试剂盒法和Trizol改良法均适宜于茴香叶片组织RNA的提取,其中,试剂盒法提取效果最好。
针对茴香花组织而言,CTAB改良法和试剂盒法提取的RNA OD260/OD280均为1.91,OD260/OD230分别为2.11和2.13,表明这2种方法的所提取的花组织RNA的纯度较好;CTAB改良法、试剂盒法、CTAB-水饱和酚法提取的RNA OD260/OD280分别为1.91、1.91、1.99,OD260/OD230分别为2.11、2.13、2.22,表明这3种方法的所提取的花组织RNA的纯度较好;Trizol改良法提取的RNA OD260/OD280为2.05,OD260/OD230为1.79,表明这种方法所提取的花组织RNA的纯度不佳,存在一定的污染或降解。4种提取方法得率最高的为试剂盒法,其次为CTAB改良法和Trizol改良法,得率最低的是CTAB-水饱和酚法。因此,试剂盒法最适宜于茴香花组织RNA的提取。
针对茴香种子而言,CTAB改良法提取的RNA OD260/OD280为1.84,OD260/OD230为2.19,表明这种方法所提取的种子RNA纯度较好;CTAB-水饱和酚法、Trizol改良法和试剂盒法提取的RNA OD260/OD280分别为1.79、1.77和1.53,OD260/OD230分别为1.88、2.08和2.23,表明这3种方法所提取的种子RNA纯度不佳,得率很低。4种提取方法得率最高的为CTAB改良法,试剂盒法、Trizol改良法和CTAB-水饱和酚法的得率都很低。因此,CTAB改良法最适宜于茴香种子RNA的提取。
2.2 不同方法提取茴香各组织总RNA的完整性比较
完整性好的RNA经琼脂糖凝胶电泳后,其28S与18S条带亮度的比值约为2∶1。若发生部分降解,一方面28S会降解为18S,导致两者比例的改变;另一方面28S与18S降解为更小的片段,导致RNA条带拖尾。若发生彻底降解,则RNA在泳道内呈弥散状,无任何条带[11-13]。茴香根总RNA经1%的琼脂糖凝胶电泳检测结果(图1)表明,CTAB改良法及试剂盒法提取的根组织RNA的28S与18S条带亮度的比值约为2∶1,但试剂盒法提取的RNA的28S条带存在弥散现象;而其他2种方法的比值几乎为1,甚至小于1,表明这些RNA样品存在部分降解。综合来看,CTAB改良法提取茴香根的RNA的完整性最好。

1.CTAB改良法; 2.CTAB-水饱和酚法;3.Trizol改良法; 4.试剂盒法。下同1.CTAB improved method; 2.CTAB-water saturated phenol method;3.Trizol improved method; 4.The kit method.The same below
茴香茎总RNA经1%的琼脂糖凝胶电泳检测结果(图2)表明,试剂盒法提取的茎组织RNA的28S与18S条带亮度的比值是2∶1;而其他3种方法的比值几乎为1,甚至小于1,表明这些RNA样品有部分降解或污染。综合来看,试剂盒法提取茴香茎RNA的完整性最好。

图2 不同方法提取茴香茎总RNA的电泳结果Fig.2 Electrophoresis result of total RNA extracted from fennel stems by different methods
茴香叶片总RNA经1%的琼脂糖凝胶电泳检测结果(图3)表明,CTAB改良法及试剂盒法提取的叶组织RNA的28S与18S条带亮度的比值约为2∶1;而CTAB-水饱和酚法及Trizol改良法提取的茴香叶片RNA的28S与18S条带亮度的比值约为1∶1,在点样槽内有基因组的荧光亮度,表明这2种方法提取的RNA中有部分DNA污染。综合来看,CTAB改良法和试剂盒法提取茴香叶片RNA的完整性较好。
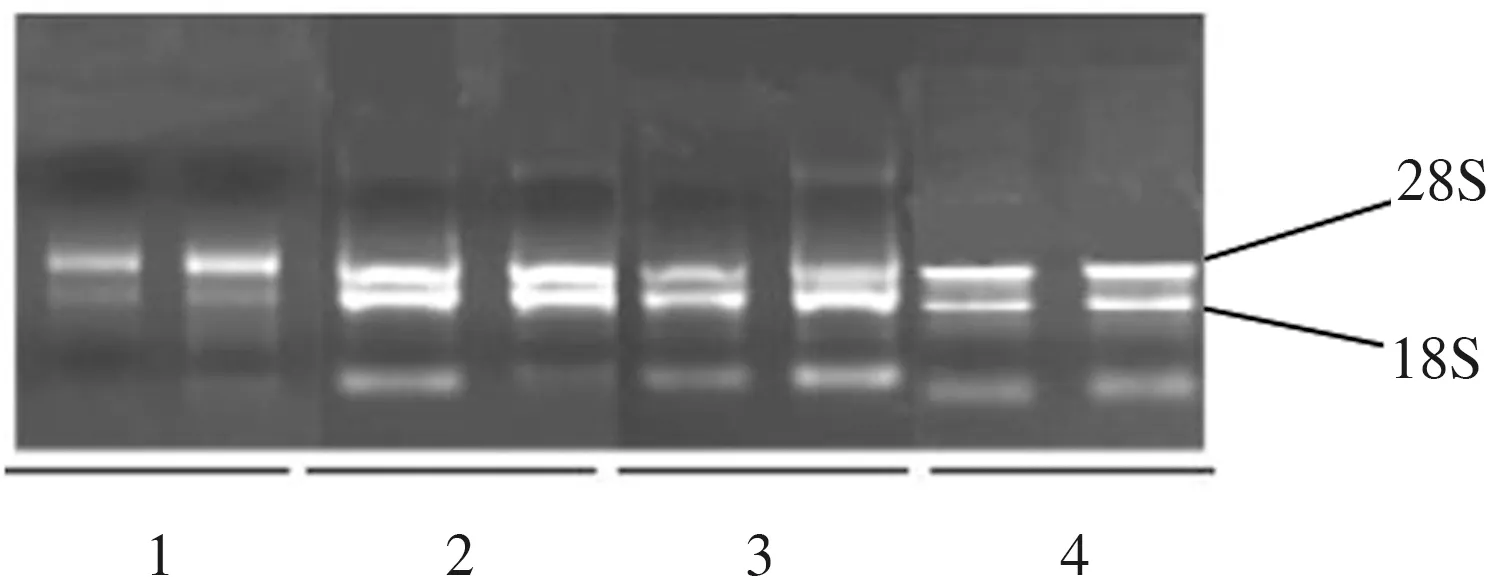
图3 不同方法提取茴香叶总RNA的电泳结果Fig.3 Electrophoresis result of total RNA extracted from fennel leaves by different methods
茴香花总RNA经1%的琼脂糖凝胶电泳检测结果(图4)表明,试剂盒法提取的花组织RNA的28S与18S条带亮度的比值是2∶1,说明提取的RNA完整性好;CTAB改良法、CTAB-水饱和酚法提取的比值几乎为1∶1,表明RNA样品有部分的降解及拖尾现象;而Trizol改良法提取的RNA条带在泳道内严重弥散。综合来看,试剂盒法提取茴香花RNA的完整性最好。

图4 不同方法提取茴香花总RNA的电泳结果Fig.4 Electrophoresis result of total RNA extracted from fennel flowers by different methods
茴香种子总RNA经1%的琼脂糖凝胶电泳检测结果(图5)表明,CTAB改良法提取的种子RNA的28S与18S条带亮度的比值约为2∶1;CTAB-水饱和酚法、Trizol改良法提取的茴香种子RNA的条带几乎看不清且存在严重的拖尾现象;试剂盒法提取茴香种子的RNA泳道内无任何条带,表明RNA已严重降解。综合来看,CTAB改良法提取茴香种子RNA的完整性最好。

图5 不同方法提取茴香种子总RNA的电泳结果Fig.5 Electrophoresis result of total RNA extracted from fennel seeds by different methods
2.3 不同方法提取茴香各组织总RNA的耗时与成本比较
通过对各方法提取茴香不同组织RNA的耗时与成本比较(表2)可知,CTAB改良法成本低廉,且能够有效去除样品中的蛋白质、多糖、多酚等物质,提取的RNA完整性好,纯度高,用时约8 h。试剂盒法具有高效的提取特点,能够快速地从茴香根、茎、叶、花组织中提取到RNA,但不适用于种子RNA的提取,且提取过程操作简单、耗时较短,需6 h左右,但成本较高。综合来看,CTAB改良法及试剂盒法最适于茴香各组织总RNA的提取。
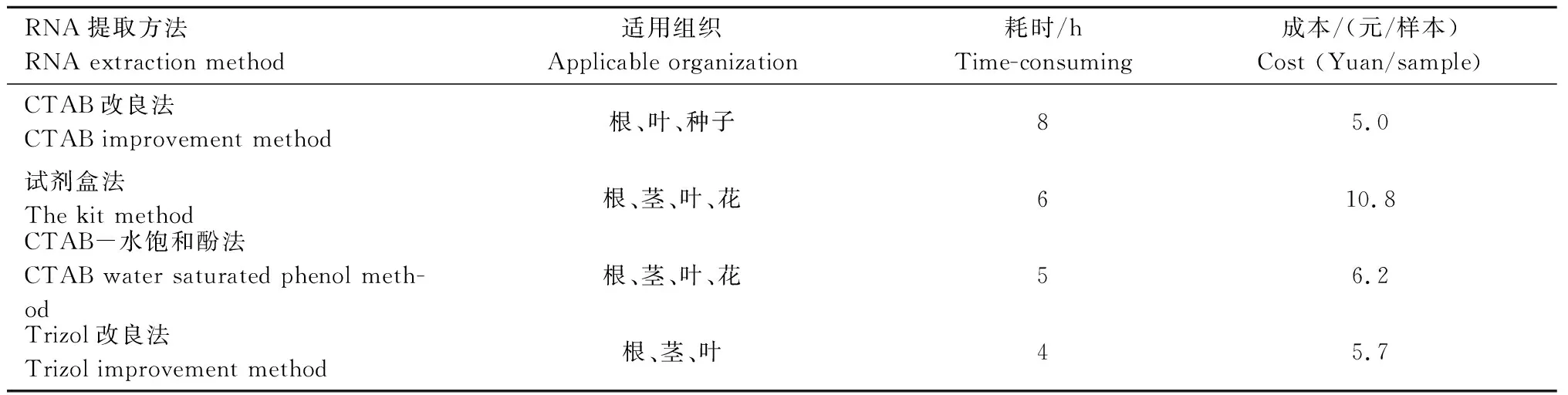
表2 RNA提取方法的耗时与成本Tab.2 Comparison of time-consuming and cost of RNA extraction methods
3 结论与讨论
获得高质量的RNA是进行分子克隆及基因表达研究的基础。目前,已有多种植物RNA提取分离的报道[14-15],由于各植物组织成分差异较大,为确保获得高质量的RNA,有必要筛选出最适宜植物各组织RNA的提取方法。
本研究通过对4种方法提取茴香不同组织总RNA的效果进行比较,筛选出提取茴香各组织最适宜的方法。在试验中,对于茴香根、茎、叶和花组织,试剂盒法提取的组织RNA得率最高,质量最好;对于根和叶组织,CTAB改良法提取的RNA纯度和得率较高,质量较好,但耗时较长,且CTAB改良法在提取樟树、枣、剑麻、甘薯等[15-19]植物的根、茎、叶及花组织的总RNA方面已有成功报道。Trizol改良法提取的RNA浓度较高,其中,提取叶的质量浓度高达2 587.8 ng/μL,但OD260/OD280部分值大于2.0,OD260/OD230部分值大于1.8,说明提取的RNA完整性较差,RNA存在拖尾或降解现象,电泳结果发现有严重的弥散现象,也证明了这一点。CTAB-水饱和酚法提取的RNA质量、得率等各方面均较低,经琼脂糖凝胶电泳检测电泳条带完整性较差,混杂有较多的DNA,该方法在试验沉淀中出现了少量的白色胶状物,推测是茴香叶片中蛋白质及多酚等物质与RNA未完全分离导致,也可能是该方法试验操作步骤繁多及叶片中RNase活性比较高,在RNA得率少的基础上又被逐渐降解,最终导致无法得到高质量的RNA;Trizol改良法和CTAB-水饱和酚法不适合提取茴香根、茎、叶、花组织的总RNA。综合来看,试剂盒法提取茴香叶片、根、茎、花RNA的质量最好。为茴香各组织的基因克隆、mRNA表达分析等分子生物学试验奠定了基础,也为同类植物RNA的提取提供了一定的借鉴。
与其他4种组织相比,茴香种子富含挥发油,达31.5 mL/kg,而根、茎、叶、花的挥发油含量分别为4.9、9.3、12.0、28.8 mL/kg[20]。油料作物种子中的大量油脂、蛋白质、酚类物质的存在和易氧化的特点均会影响RNA的提取,普通CTAB法、Trizol法和试剂盒法提取的油菜、大豆、花生和芝麻的晚期种子RNA的效果也不理想[21]。本研究中,CTAB改良法提取茴香种子RNA的效果相对于其他3种方法最好,试剂盒法提取效果最差,可能是由于茴香种子为双悬果,种皮较厚,且富含茴香精油及多酚等物质,降低了种子RNA的得率和浓度。可见,茴香种子的RNA提取方法有待进一步改善和探索。
