禽腺病毒4型ZZ株的分离鉴定及系统进化分析
2020-11-19金前跃王寅彪柴永笑卢清侠郭振华邢广旭邓瑞广张改平
金前跃,王寅彪,柴永笑,卢清侠,李 鹏,郭振华,邢广旭,邓瑞广,张改平,7
(1.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 2.河南省农业科学院中英禽病国际研究中心,河南 郑州 450002; 3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009; 4.新乡医学院 公共卫生学院,河南 新乡 453003; 5.西北农林科技大学 动物医学院,陕西 杨凌 712100; 6.新乡学院 生命科学技术学院,河南 新乡 453003;7.河南农业大学 牧医工程学院,河南 郑州 450002)
禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科(Adenoviridae)、禽腺病毒属(Aviadenovirus),分为A、B、C、D、E等5个种,12个血清型(1~8a、8b~11)[1]。其中,FAdV-1型属于A种,FAdV-5型属于B种,FAdV-4型和FAdV-10型属于C种,FAdV-2、FAdV-3、FAdV-9、FAdV-11型属于D种,FAdV-6、FAdV-7、FAdV-8a、FAdV-8b型属于E种。FAdVs可感染鸡、鸭、鹅、鸽子、鹌鹑和鸵鸟等禽类群体,一般仅造成亚临床症状,致病性较强的FAdVs可引起心包积水综合征(HPS)、鸡包涵体肝炎(IBH)和肌胃糜烂(GE)等[2-4]。HPS也称为肝炎-心包积水综合征(HHS),主要由FAdV-4感染引起,剖检可见淡黄色心包积液或心包内出现胶冻状物质和严重的肝炎病变。患病鸡常突然发病,迅速死亡,死亡率高达30%~70%[5]。FAdVs是无囊膜的双股线性DNA病毒,基因组全长在40~46 kb,六邻体(Hexon)蛋白是病毒表面含量最高的蛋白,富含主要的抗原决定簇,可用于FAdVs的基因分型[6-7]。
2014年以来,IBH和HPS病例在我国多个省份鸡群中不断出现且呈增加趋势,对国内养禽业造成了巨大损失[8-9]。ZHAO等[9]从2013年采集的病鸡样品中首次分离到FAdV-4型病毒,命名为JSJ13株。同时,多项研究表明,国内当前流行的FAdV-4变异株感染是引起此次HPS疫情的主要原因[10-11]。与国外无毒力的FAdV-4 ON1株和FAdV-4 KR5株相比,国内流行的FAdV-4存在ORF19基因缺失,而且与JSJ13株相比,2015年以来分离的多株FAdV-4同时存在ORF29基因的部分缺失,这可能暗示国内的FAdV-4流行株在进一步适应禽类宿主[12-13]。河南省多个地市也出现了HPS疫情,流行病学调查显示,5~11周龄鸡群发病率较高,死亡率达30%~80%[14-15]。为明确FAdV-4河南流行株的基因组特征和分子进化关系,从新郑某鸡场采集了患有HPS的病鸡样品,通过盲传分离FAdV毒株,并通过免疫荧光分析和PCR检测确定分离毒株的血清型,对其进行全基因组序列分析和分子进化分析,以期为有效防控HPS暴发及FAdV感染在河南省的流行奠定基础。
1 材料和方法
1.1 主要试剂
DME/F12培养基购自HyClone公司;青链霉素混合液、胰蛋白酶、4’,6-二脒基-2-苯基吲哚(DAPI)购自Solarbio公司;胎牛血清购自Gibco公司;Premix ExTaqDNA聚合酶、病毒基因组提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)购自Takara公司;多聚甲醛、Triton X-100均购自国药集团;FITC标记的羊抗鼠IgG购自北京博奥森;FAdV-4特异性单克隆抗体由河南农业大学牧医工程学院王江教授惠赠。
1.2 病料和细胞
患有HPS的病鸡来源于河南省郑州市(新郑)某鸡场。解剖后,收集心脏、肝脏、肺脏等组织,冻存于-40 ℃冰箱。鸡肝癌细胞系(LMH)由本实验室保存,利用含10%胎牛血清的DME/F12培养基于含5% CO2的37 ℃培养箱中进行培养。
1.3 病料的处理
无菌条件下取适量病料,以1∶3的质量体积比加入含青链霉素的无菌磷酸盐缓冲液(PBS)彻底研磨。将组织研磨液收集于无菌Eppendorf管中,在-80 ℃和室温间反复冻融3次,10 000 r/mim离心15 min,使用0.22 μm的滤器过滤上清液,冻存于-80 ℃。
1.4 病毒的分离
在LMH细胞汇合度约达到80%时,弃去培养基并用无菌PBS洗涤3次。使用无血清DME/F12培养基将上述处理后的病料研磨液稀释50倍后接种于细胞上,在37 ℃、5% CO2培养箱中培养1.5 h。然后弃去病毒液,加入含2%胎牛血清的DME/F12培养基继续培养72 h。之后通过-80 ℃与室温间反复冻融,2 000 r/min离心15 min,收集病毒液。过滤后,再次接种于LMH细胞,盲传3代以分离获得病毒,并将其继续传至第11代以获得稳定毒株。
1.5 病毒的鉴定
1.5.1 细胞病变 制备LMH单细胞悬液并将其稀释至约1.0×105个/mL,向96孔细胞培养板各孔中加入100 μL上述悬液于含5% CO2的37 ℃培养箱中培养。至细胞汇合度约为80%时,弃去培养基并使用无菌PBS洗涤后,向各孔中接种100 μL病毒液。孵育1.5 h后,弃去病毒液,加入含2%胎牛血清的DME/F12培养基继续培养,每24 h观察细胞病变。
1.5.2 免疫荧光检测 按照1.5.1中的方法将盲传获得的病毒接种至LMH细胞,以未接毒的LMH细胞作为对照,24 h后,弃掉细胞上清,用预冷的PBS洗涤3次。使用4%多聚甲醛在室温下固定细胞30 min,PBS洗涤2次,之后加入100 μL的0.1% Triton X-100室温作用2 min,弃Triton X-100溶液,各孔加满含5%脱脂奶粉的封闭液于4 ℃封闭过夜。PBS洗涤3次,加入抗FAdV-4的特异性单克隆抗体(1∶100),37 ℃孵育1 h。PBS洗涤3次,加入FITC标记的羊抗鼠IgG (1∶100),37 ℃孵育1 h。PBS洗涤3次,加入DAPI (1∶1 000)对核酸进行染色。然后再次洗涤,加入100 μL PBS防止干燥,并使用荧光显微镜观察。
1.5.3 PCR检测 根据FAdV-4 MX-SHP95毒株(GenBank登录号:KP295475.1)的DNA聚合酶基因序列设计引物。PCR上游引物序列为5′-GCAGCGTGGTCTTGAAGATGGTTC-3′,下游引物序列为5′-CGCATTCAAGCCCGTTCGATTC-3′,预期扩增片段大小为632 bp。PCR反应条件:顶盖温度99 ℃,预变性95 ℃ 5 min;变性95 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 40 s,循环30次;72 ℃延伸10 min,4 ℃停止反应。采用1.0%琼脂糖凝胶电泳对PCR产物进行鉴定。
1.5.4 全基因组测序 按照病毒基因组提取试剂盒说明,提取FAdV-4毒株的全基因组,由生工生物工程(上海)股份有限公司进行全基因组二代测序。
1.6 分子进化分析
将分离株的全基因组序列和Hexon基因序列与GenBank中相关序列进行比对。利用MegAlign软件的View/Sequence distance功能分析分离株与其他FAdV毒株的全基因组序列相似性,利用Mega 6.06软件中的Clustal W程序完成分离株全基因组序列比对,并采用邻接法构建遗传进化树,步长值(Bootstrap value)设置为1 000。利用DNAStar软件对相关毒株的Hexon蛋白氨基酸序列进行比对。
2 结果与分析
2.1 分离毒株细胞病变观察
正常LMH细胞形态为梭形,呈单层贴壁生长(图1A)。病料研磨液接种24 h后,部分细胞出现变圆的病变状态(图1B);接种后48 h,几乎所有的细胞都出现病变,呈葡萄串珠状聚在一起(图1C);72 h后,病变的细胞大量脱落,部分细胞崩解,培养基变浑浊(图1D);说明分离的病毒能够感染LMH细胞并产生明显的细胞病变。

A:正常细胞; B:接种后24 h; C:接种后48 h; D:接种后72 hA:Normal cells; B:24 h after inoculation; C:48 h after inoculation; D:72 h after inoculation
2.2 分离毒株免疫荧光检测结果
免疫荧光检测结果表明,分离毒株感染LMH细胞24 h后,能在细胞质中观察到绿色荧光信号,而对照组没有荧光信号(图2),进一步说明病毒成功适应了LMH细胞,并获得了良好增殖。

A:病毒感染的LMH细胞; B:未感染的LMH细胞A:Virus-infected LMH cells; B:Mock-infected LMH cells
2.3 分离毒株PCR鉴定结果
将处理过的病料研磨液接种LMH细胞,收集1~11代病毒液进行PCR检测后,均扩增得到了632 bp大小的条带(图3)。表明成功分离了1株FAdV,命名为FAdV ZZ株。
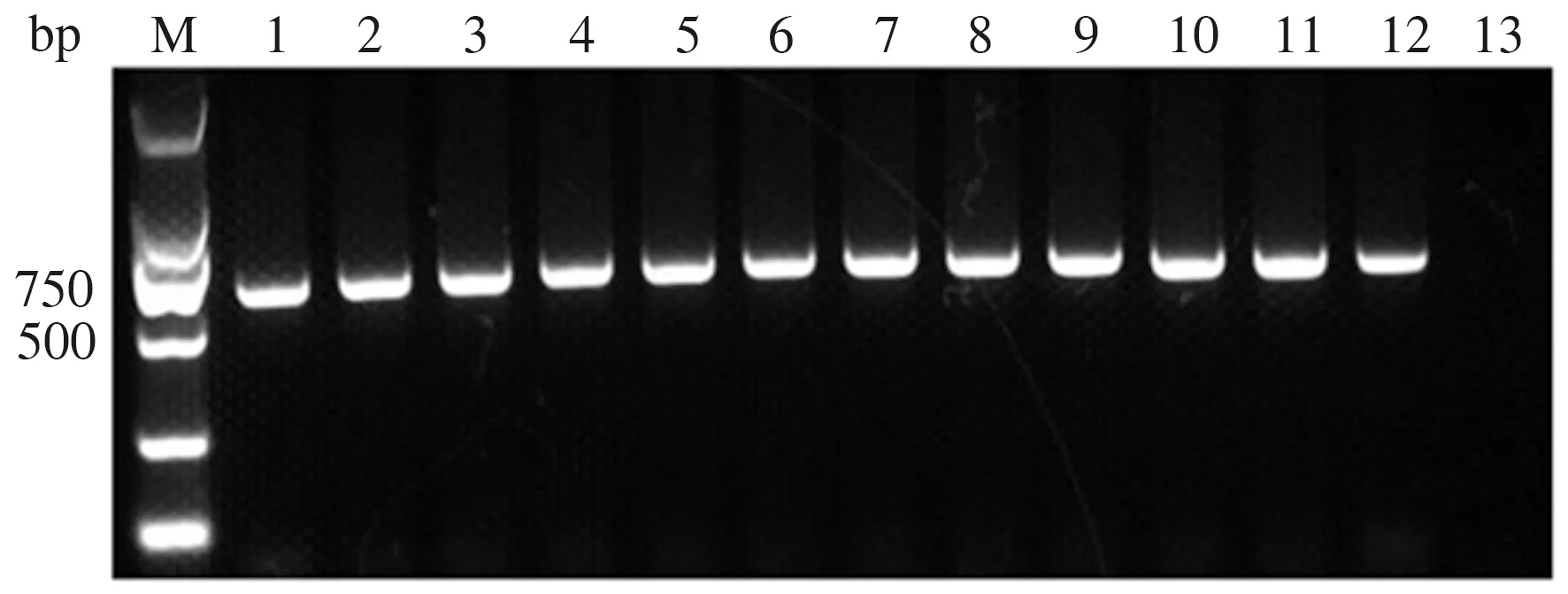
M:DL2000 DNA Marker; 1—11:1~11代收集的病毒液; 12:阳性对照; 13:阴性对照M:DL2000 DNA Marker; 1—11:Virus from the different passages(1—11); 12:Positive control; 13:Negative control
2.4 分离毒株全基因组序列分析
本研究分离的FAdV ZZ株(GenBank登录号:MN337322.1)的基因组全长为43 725 bp,GC含量为54.87%。基于全基因组序列的系统进化分析表明该分离株为禽腺病毒C亚群血清4型,命名为FAdV-4 ZZ株(图4)。与无毒力的FAdV-4 ON1和FAdV-4 KR5株相比,FAdV-4 ZZ株存在ORF19、ORF27和ORF30基因的缺失,FAdV-4 ZZ株与ON1株和KR5株的核苷酸序列相似性分别为98.45%和98.77%。FAdV-4 ZZ株与国内首次分离的JSJ13株相比,ORF29序列存在33个碱基缺失,表明我国不同地区流行的FAdV-4毒株在序列上存在差异。
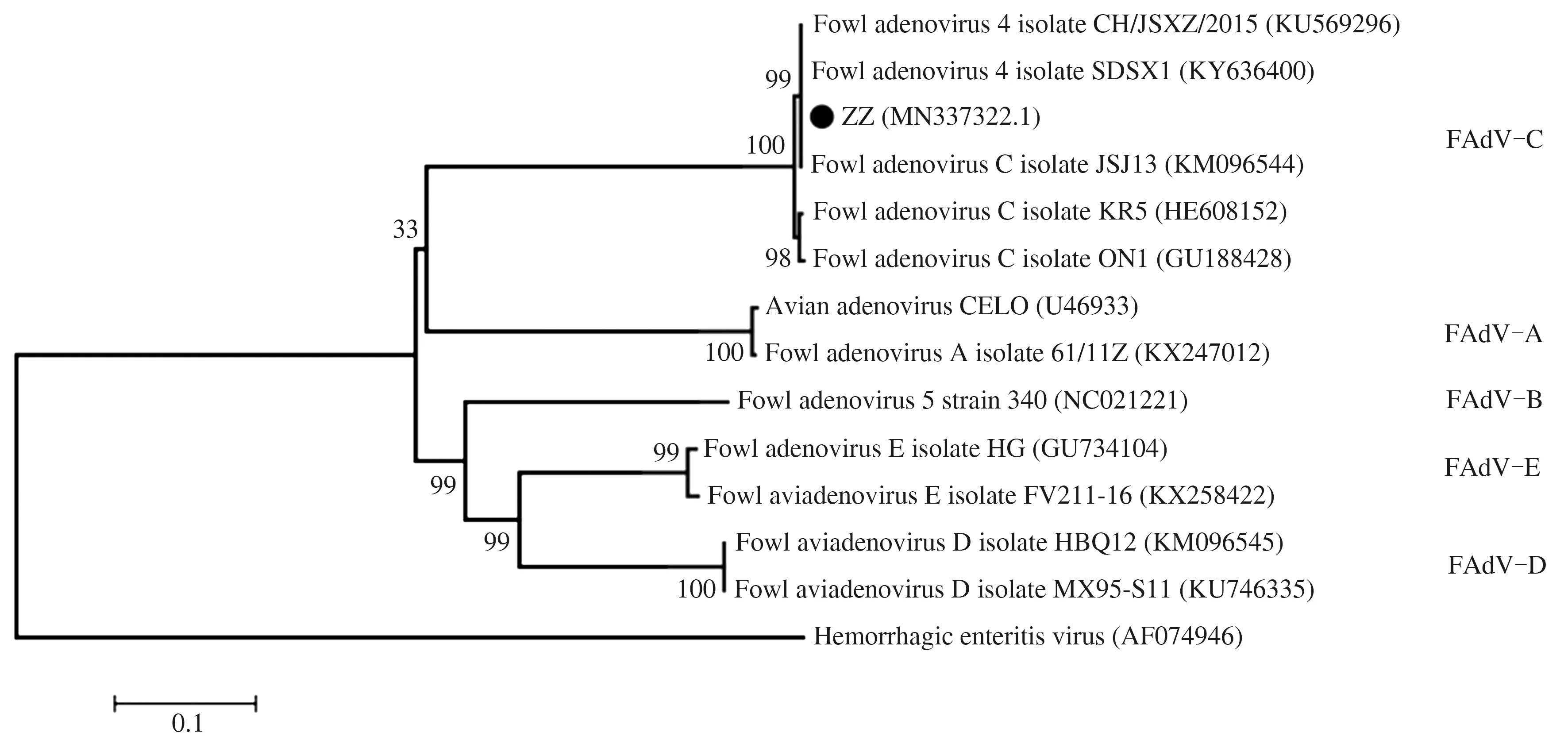
图4 FAdVs的全基因组分子进化分析Fig.4 The genome-wide phylogenetic analysis of FAdVs
2.5 分离毒株Hexon基因的分子进化分析
FAdV-4 ZZ株的Hexon蛋白含937个氨基酸。基于Hexon基因的分子进化分析同样表明该分离株为禽腺病毒C亚群血清4型(图5)。FAdV-4 ZZ株的Hexon基因与国内流行的CH/JSXZ/2015和SDSX1株的核苷酸序列相似性均为100%;与ON1株和KR5株的Hexon基因核苷酸序列相似性分别为98.69%和98.90%。FAdV-4 ZZ株的Hexon蛋白与国内流行的CH/JSXZ/2015株和SDSX1株的氨基酸序列完全一致,与ON1株和KR5株的Hexon蛋白氨基酸序列分别存在13个和12个氨基酸突变,可能对其抗原表位和免疫原性产生影响(表1)。

图5 FAdVs Hexon基因的分子进化分析Fig.5 Phylogenetic analysis of FAdVs Hexon gene
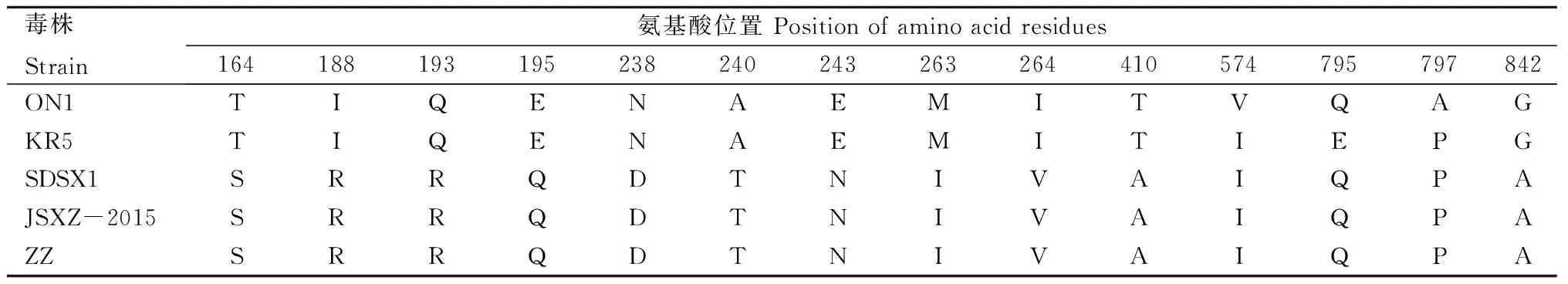
表1 Hexon蛋白氨基酸序列的比对Tab.1 Alignment of amino acids of Hexon protein of FAdV-4 ZZ
3 结论与讨论
1987年,鸡心包积水综合征(HPS)在巴基斯坦的安卡拉地区首次被报道,因此它也被称为“安卡拉”病,随后该病出现在印度、墨西哥、俄罗斯、韩国、日本等国家[16]。2007—2013年,IBH和HPS病例在我国以散发为主,但2014年以来,国内鸡群HPS病例迅速增加[3]。研究表明,FAdV-4变异株感染是引起此次HPS疫情的主要原因[10-11]。河南省是家禽养殖大省,HPS疫情对全省的家禽养殖造成了严重影响。深入研究FAdV-4病毒的基因组特征和分子进化关系对有效防控FAdV-4感染和HPS暴发具有重要意义。
基于全基因组序列和Hexon基因的分子进化分析均表明,该分离株为FAdV-4。进一步研究发现,FAdV-4 ZZ株可以使LMH细胞产生明显的病变,并可在该细胞系上稳定传代。与无毒力的ON1株和KR5株相比,FAdV-4 ZZ株以及国内流行的JSXZ-2015、JSJ13株和SDSX1株均存在ORF19、ORF27、ORF30基因缺失。ORF19基因编码病毒的脂肪酶(Lipase),研究推测国外流行株FAdV-4 SHP95的高致病性可能与ORF19基因被终止密码子打断有关[17]。国内FAdV-4流行株是否因ORF19基因缺失而使毒力增强有待进一步研究。FAdV-4 ZZ株以及CH/JSXZ/2015株和SDSX1株与国内首次分离的JSJ13株相比,ORF29序列均存在33个碱基缺失,表明我国不同地区流行着含有2种不同ORF29序列的FAdV-4毒株,目前尚不清楚这一基因缺失对FAdV-4毒株复制和致病力的具体影响。Hexon蛋白是FAdV的主要结构蛋白,具有血清型特异性,含有中和性抗原表位[6,18]。FAdV-4 ZZ株的Hexon蛋白与国内流行的JSXZ-2015株和SDSX1株的氨基酸序列完全一致,与ON1株和KR5株的Hexon蛋白氨基酸序列分别存在13个和12个氨基酸突变,这些变异对Hexon蛋白抗原表位和免疫原性的影响有待研究。
2014年以来,HPS疫情在我国多个省份出现,对养禽业造成了巨大损失。研究发现,从商品化的新城疫弱毒苗中可以分离出FAdV-4型病毒,这可能是FAdV感染在国内鸡群中大面积流行的原因之一[19]。此外,除了FAdV-4型,我国部分地区也流行着FAdV-8b、FAdV-10、FAdV-11等血清型[20-21]。可见,当前防控FAdV感染的形势较为严峻。分析国内FAdV流行株的基因组特征和分子进化关系,对于有效防控FAdV感染和HPS暴发具有重要价值。本研究对FAdV-4 ZZ株的分离及全基因组序列测定明确了FAdV-4河南流行株和国内外流行株的进化关系,为建立FAdV-4特异性检测方法和疫苗研究奠定了基础。
